一种绿色合成含氟异黄酮的新方法
代丽雁,张尊听
(1.周口师范学院化学化工学院,河南 周口 466000;2.陕西师范大学化学化工学院 药用资源与天然药物化学国家重点实验室,陕西 西安 710062)
一种绿色合成含氟异黄酮的新方法
代丽雁1,张尊听2
(1.周口师范学院化学化工学院,河南 周口 466000;2.陕西师范大学化学化工学院 药用资源与天然药物化学国家重点实验室,陕西 西安 710062)
目的 开发一种新的合成异黄酮的方法,使其合成更高效、低毒、有抗癌活性的含氟异黄酮化合物。方法 以3-碘色原酮为原料经锌粉插入合成3-碘色原酮锌试剂,再在6% NiCl2(PPh3)2催化下与卤代芳烃经Negishi交叉偶联反应合成含氟异黄酮化合物。结果 合成了7种含氟异黄酮,其中2’-三氟甲基异黄酮、3’-三氟甲基异黄酮、4’-三氟甲基异黄酮、6-氟-2’-三氟甲基异黄酮、6-氟-3’-三氟甲基异黄酮共5种含氟异黄酮尚未见文献报道。目标产物经IR、HRMS、NMR结构表征确定。结论 本合成方法具有环境友好、快速便捷、反应路线短,总产率高、易于放大等优点,是一种绿色、高效合成含氟异黄酮的新方法。
含氟异黄酮;3-碘色原酮;合成方法;Negishi交叉偶联反应
异黄酮类化合物广泛存在于大多数植物体中,具有多种生物活性,目前对异黄酮的大量研究表明,异黄酮对人体有多种生理活性,特别是抗肿瘤活性[1-2]。但由于其在体内吸收少或者完全不吸收导致活性较低。由于伪拟效应和C-F键的特性[3-5],在有机分子中引入氟元素或含氟基团会使有机分子的理化性质和生物活性产生显著变化。
异黄酮类化合物经典合成方法有查尔酮途径、苯基苄基酮途径[6]等,反应路线长,收率低,对环境不友好,因而逐渐被放弃使用。之后出现了Suzuki[7]和Stille有机锡[8]、有机铋[9]偶联反应合成异黄酮,但是Suzuki反应使用的有机硼试剂较难制备,且其对特殊官能团的限制,使得在合成一系列具有生物活性的药用异黄酮时需要对特殊官能团进行保护和去保护处理,在延长了合成路线的同时也损失了一定产率,使得该方法的应用受到一定的限制[10-11];Stille反应用到的金属锡有较大毒性,对环境不够友好,而有机铋试剂虽然满足了环保要求,但由于其催化活性的先天不足,导致其应用受到一定限制;Negishi偶联反应[12]采用对环境更友好的有机锌试剂与卤代烃等进行交叉偶联,反应温和、官能团兼容性强、产率较高[13]。
本文首次报道以(含氟)碘代色原酮为原料,锌粉直接插入法合成(含氟)色原酮锌试剂后与(含氟基团)卤代烃经Negishi交叉偶联反应得到一系列含氟元素或含氟基团的新的异黄酮(见图1)。该方法反应路线简洁,反应条件温和,产率高,是一种绿色、高效的合成含氟异黄酮的新方法[14-16]。
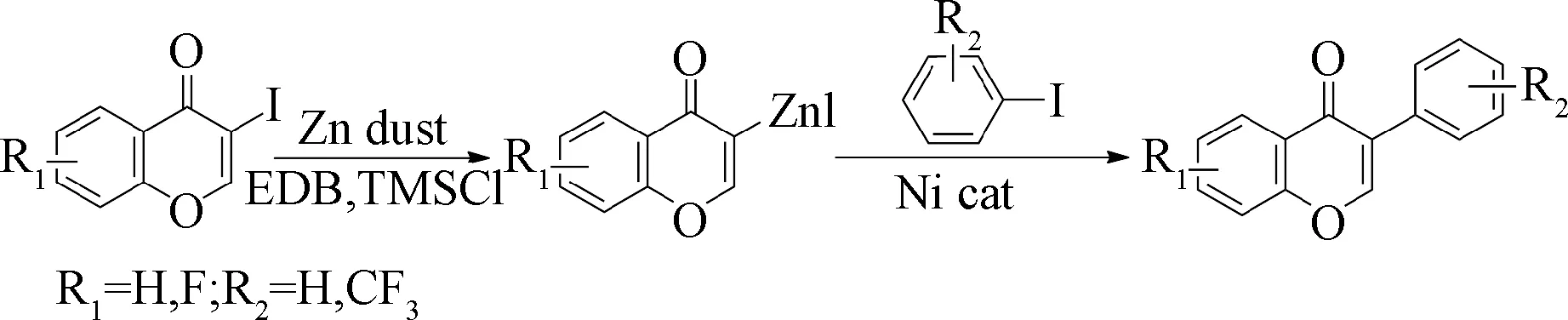
图1 含氟异黄酮的合成路线Fig.1 The synthetic route of fluoride isoflavone
1 材料与方法
1.1 材料
1.1.1 仪器:YLN-II型紫外分析仪(上海驰唐电子有限公司);X-5显微熔点测定仪(控温型,温度未经校正)(巩义科瑞仪器有限公司); Nicolet 170SX FT-IR红外光谱仪(KBr压片法)(美国Nicolet公司);Bruker AM-300超导傅立叶数字化核磁共振仪(TMS为内标)(德国Bruker公司);Bruker Smart-1000 CCD型单晶衍射仪(德国Bruker公司);Bruker Daltonics Data Analysis 高分辨飞行时间质谱仪(德国Bruker公司)。
1.1.2 试剂:邻羟基苯乙酮购于北京恒业中远化工有限公司(纯度>97%,生产批号H106327);镍催化剂Ni(acac)2(生产批号N105676)、NiCl2(dppp)(生产批号N101085)、NiCl2(dppf)(生产批号D101071)、NiCl2(dppe)(生产批号D101082)、NiCl2(生产批号N128397)和PPh3(生产批号T104478)购于上海柏卡化学有限公司(纯度>97%);N,N-二甲基甲酰胺二甲缩醛购于百灵威科技有限公司(纯度>98%,生产批号OR28611);石油醚、四氢呋喃、乙醇、乙酸乙酯等试剂均为分析纯;GF254硅胶(400目) 、硅胶H(200-300目)均购自青岛海浪化工厂。
1.2 方法
1.2.1 色原酮的合成方法:据文献报道[17],邻羟基苯乙酮与N,N-二甲基甲酰胺二甲缩醛(N,N-dimethylformamide dimethyl acetal,DMF-DMA)在二甲基甲酰胺(dimethylformamide,DMF)等溶剂体系里制备出中间体烯氨酮类化合物,并将其与碘单质环合制得原料3-碘色原酮类衍生物[18-20]。

图2 3-碘色原酮类化合物的合成Fig.2 The synthetic of 3-iodine chromone compounds
称取13.6 g (0.1 mol) 2-羟基苯乙酮,加入到23.8 g (0.2 mol) DMF-DMA和150 mL DMF的混合溶液中,80 ℃下磁力搅拌,约1 h后,TLC检测,反应完毕,将反应液倒入饱和食盐水中,抽滤烘干得(E)-3-(二甲氨基)-1-(2-羟基苯基)丙-2-烯-1-酮粗品。取2 g (E)-3-(二甲氨基)-1-(2-羟基苯基)丙-2-烯-1-酮粗品与38.1 g (0.15 mol)碘单质在氯仿溶剂中室温下磁力搅拌反应,约2 h后,TLC监测,反应完毕,将反应液倒入200 mL 5%亚硫酸氢钠溶液中搅拌淬灭反应。分出有机相,水相用氯仿反复萃取。合并有机相,以蒸馏水水洗有机相至中性,用无水硫酸镁干燥有机相。抽滤得3-碘色原酮(1a)粗品,乙醇重结晶即可得相应纯品,产率达85%。
同种方法制得6-氟-3-碘色原酮(2a),产率为80%。
1.2.2 3-碘色原酮锌试剂的合成方法:在众多锌粉活化方法中,1,2-二溴乙烷(EDB)和三甲基氯硅烷(TMSCl)联用是一种比较成功的活化方法[21]。商品级的锌粉用这种方法活化后,也可以与反应活性较低的有机卤代烃在相当温和的条件下高产率地得到有机锌试剂[22]。
首先,优化3-碘色原酮锌试剂的合成条件。以1 mmol 3-碘色原酮原料,固定活化剂1,2-二溴乙烷0.08 mL(5 mol%)及三甲基氯硅烷0.01 mL(1 mol%),对锌粉的用量进行探索优化(见表1)。

表1 3-色原酮碘化锌合成中锌粉用量的优化
a产率都采用碘滴定法[23]计算得到。
当锌粉的用量最高为10 mmol%的时候,反应完毕锌粉大量剩余,锌试剂产率约87%(Entry 1);当锌粉用量为最低3 mmol%的时候,反应完毕没有锌粉剩余,锌试剂产率约73% (Entry 2);当锌粉用量为3.5 mmol%时,锌粉几乎反应完全,锌试剂产率约85%(Entry 3)。由于锌粉用量为3.5 mmol%与10 mmol%时锌试剂产率并无很大差别[24],所以确定3.5 mmol%为锌粉的最佳实验当量(表1),即3-碘色原酮与锌粉的摩尔比为1:3.5。
确定锌粉用量后,探索溶剂用量对锌试剂产率的影响。实验结果显示,由于活化过程中伴随放热及气体产生,会有部分溶剂挥发,因此3.5 mmol%的锌粉需要最少2 mL无水四氢呋喃;溶剂过多会影响活化效果[25-26]。最终确定3.5 mmol%锌粉需加入到3 mL四氢呋喃中进一步活化。
最终,确定了3-碘色原酮锌试剂的合成方法:1 mmol 3-碘色原酮为起始原料,无水四氢呋喃为溶剂。将208 mg (3.2 mmol%)锌粉加入装有3 mL无水四氢呋喃的双口瓶(侧口用耐腐蚀的橡胶塞塞紧)中,氮气保护密封。由侧口注射器注入约0.08 mL(5 mol%)1,2-二溴乙烷,快速加热至微沸后停止加热,缓慢搅拌至反应瓶中不再出现气泡,再次加热至微沸,缓慢搅拌,待反应液恢复室温时,注入0.01 mL(1 mol%)三甲基氯硅烷,快速搅拌3~5 min,静置恢复室温,锌粉活化完毕,活化后的锌粉呈蓬松状态。将272 mg 3-碘色原酮溶解于3 mL无水四氢呋喃后注射入反应瓶。65 ℃油浴加热,磁力搅拌1 h,TLC监测反应完全,以碘滴定法测定各锌试剂浓度进而计算出产率[10]。以此方法合成了3-碘色原酮锌试剂(1b)、6-氟-3-碘色原酮锌试剂(2b),产率分别为85%、88%。
1.2.3 含氟异黄酮的合成方法:首先,以3-色原酮碘化锌试剂(1b)与碘苯反应为例,对催化剂及配体的种类与比例、催化剂用量进行探索与优化。
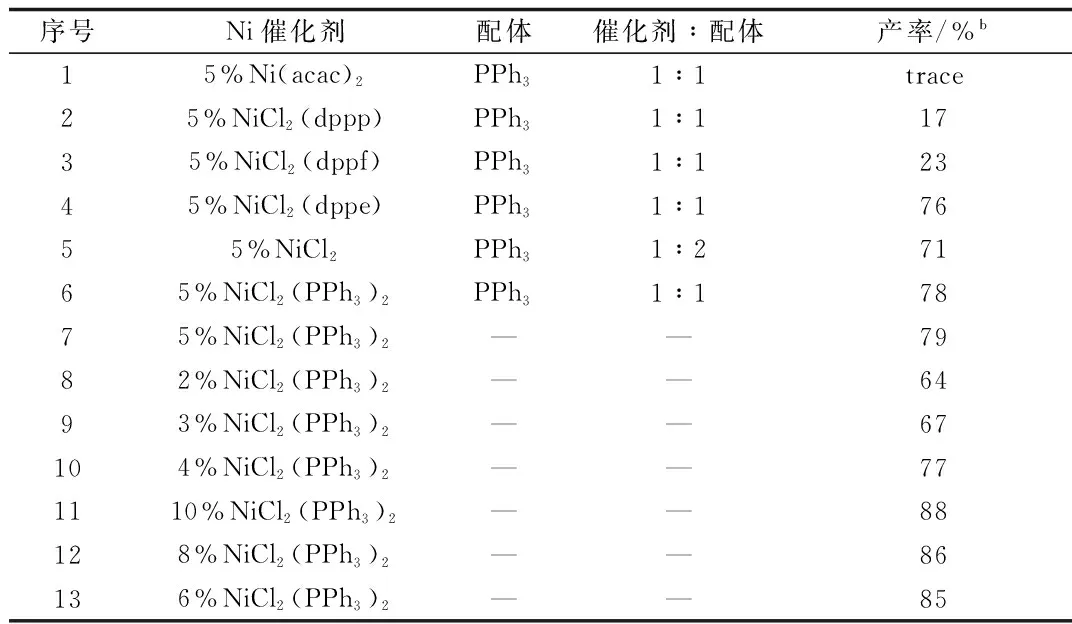
表2 催化剂、配体及2者比例的优化a
a1.2 mmol(1b),6 mL THF,65 ℃,磁力搅拌2 h,TLC监测反应进程;b柱层析分离提纯得确切产率。
由于室温几乎没有反应发生,因此将温度直接设定到溶剂的回流温度65 ℃。由表3可以看出,NiCl2(PPh3)2和NiCl2(dppe)均能在PPh3作配体的情况下给出较好的产率(Entries 4,6),但NiCl2(PPh3)2稍胜一筹,且NiCl2(PPh3)2较廉价易得,因此确定用NiCl2(PPh3)2作为催化剂[27]。此后在无配体情况下对NiCl2(PPh3)2用量作筛选,确定6%NiCl2(PPh3)2为最佳催化剂用量。
综上所述,合成含氟异黄酮的最佳反应条件为无水四氢呋喃作溶剂,6% NiCl2(PPh3)2为催化剂,65 ℃油浴搅拌约2 h。
最终,确定了含氟异黄酮的合成方法:称取0.06 mmol 二(三苯基)二氯化镍[NiCl2(PPh)3]放入25 mL圆底烧瓶中,抽真空氮气球保护,注入4 mL无水四氢呋喃,65 ℃油浴搅拌约3 min后将新制的锌试剂注入反应瓶,继续65 ;油浴反应约2 h,TLC监测反应进程(图1)。反应完毕后,冷却至室温,蒸干四氢呋喃溶剂并加入氯仿完全溶解剩余固体,饱和无水氯化铵中和萃取,水洗中中性,有机相中加入适量柱层析硅胶,石油醚和乙酸乙酯混合溶剂做洗脱剂经硅胶柱层析梯度洗脱分离得异黄酮类化合物纯品[28-29]。产物经1H NMR、13C NMR、IR、HRMS结构表征确定。
2 结果
2.1 产物列表 产物经1H NMR、13C NMR、IR、HRMS结构表征确定,其中2c、3c、4c、5c、6c未见文献报道。
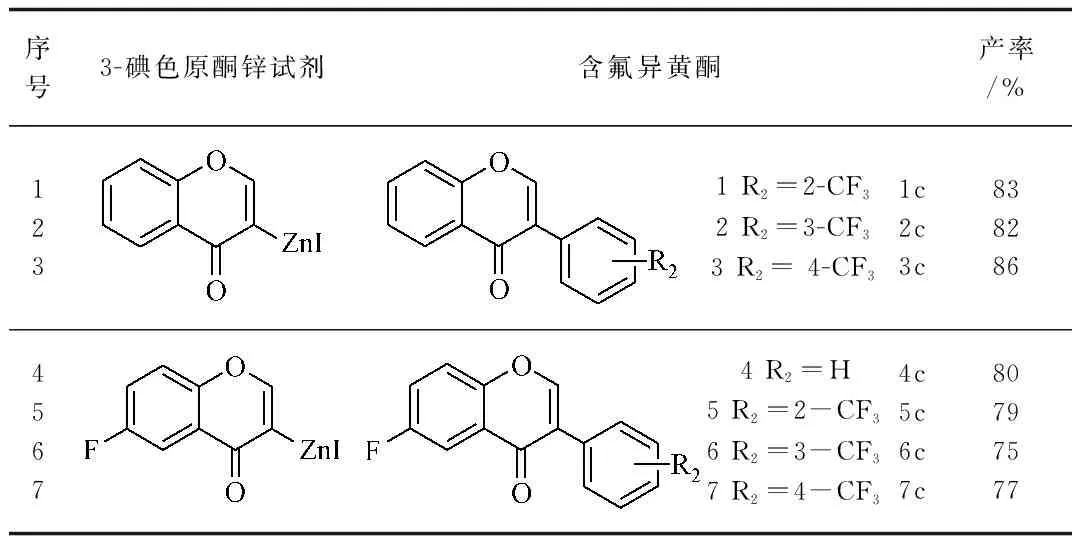
表3 含氟异黄酮产物列表及产率
2.2 产物(1c-7c)的结构表征 3-(2-(trifluoromethyl)phenyl)-4H-chromen-4-one(1c): White solid, m.p.: 126.8~127.6 ℃.1H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.45 (s, 1H), 8.13 (d, J = 7.9 Hz, 1 H), 7.88 (t, J = 7.8 Hz, 2 H), 7.81-7.65 (m, 3 H), 7.54 (dd, J = 18.3, 7.5 Hz, 2 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 175.7, 156.4, 154.9, 135.0, 134.0, 132.8, 131.0, 129.5, 126.6, 126.6, 126.3, 125.8, 124.0, 123.9, 122.7, 119.0.IR (KBr), ν (cm-1): 3054, 1639, 1464, 1316, 1157, 1102, 890, 773, 758.HRMS: m/z (rel intensity): (M+Na), Cal: 313.0452; found: 313.0449.
3-(3-(trifluoromethyl)phenyl)-4H-chromen-4-one(2c): White power, m.p.: 110.2~110.5 ℃.1H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.71 (s, 1 H), 8.18 (d, J = 7.5 Hz, 1 H), 8.02 (s, 1 H), 7.97~7.82 (m, 2 H), 7.74 (dd, J = 14.1, 8.2 Hz, 3 H), 7.55 (t, J = 7.4 Hz, 1 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 175.4, 156.1, 155.9, 143.2, 134.8, 133.5, 133.3, 129.7, 129.4, 129.0, 126.2, 126.0, 124.9, 124.2, 122.9, 118.9.IR (KBr), ν (cm-1): 3476, 1638, 1572, 1512, 1466, 1411, 1377, 1110, 1073, 1014, 856, 833, 759.HRMS: m/z (rel intensity): (M+Na), Cal: 313.0452; found: 313.0458.
3-(4-(trifluoromethyl)phenyl)-4H-chromen-4-one(3c): White solid, m.p.: 152.8~156.7 ℃.1H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.69 (s, 1 H), 8.18 (d, J = 7.9 Hz, 1 H), 7.84 (d, J = 4.3 Hz, 5 H), 7.74 (d, J = 8.3 Hz, 1 H), 7.56 (t, J = 7.5 Hz, 1 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 175.3, 166.9, 157.5, 156.1, 153.3, 135.0, 132.0, 130.1, 129.2, 128.6, 126.3, 126.0, 125.5, 125.5, 125.4, 119.0.IR (KBr), ν (cm-1): 3450, 1635, 1495, 1376, 1268, 1143, 1071, 953, 859, 789.HRMS: m/z (rel intensity): (M+Na), Cal: 313.0452; found: 313.0447.
6-fluoro-3-phenyl-4H-chromen-4-one(4c): White solid, m.p.: 190.9~191.7 ℃.1 H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: 8.00-7.44 (m, 8 H), 8.60(s, 1 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: 109.83, 110.14, 121.18, 121.29, 122.21, 122.54, 123.24, 127.99, 128.19, 128.90, 131.55, 152.09, 154.96, 157.44, 160.67.IR (KBr), ν (cm-1): 3076, 1638, 1575, 1481, 1364, 1266, 1211, 1164, 1133, 1097, 942, 878, 821, 735, 690, 614, 549.HRMS: m/z (rel intensity): (M+Na), Cal: 263.0484; found: 263.0469.
6-fluoro-3-(2-(trifluoromethyl)phenyl)-4H-chromen-4-one(5c): White solid, m.p.: 135.4~136.5 ℃.1 H NMR[300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.50 (s, 1 H), 7.83 (dd, J = 20.5, 7.2 Hz, 5 H), 7.70 (d, J = 7.0 Hz, 1 H), 7.51 (d, J = 6.9 Hz, 1 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 174.5, 160.8, 157.5, 154.7, 152.4, 133.4, 132.3, 129.1, 128.7, 126.1, 124.5, 122.8, 121.5, 121.4, 110.0, 109.7.IR (KBr), ν (cm-1): 3080, 1643, 1479, 1320, 1273, 1157, 1037, 826, 772, 766, 725.HRMS: m/z (rel intensity): (M+Na), Cal: 331.0358; found: 331.0357.
6-fluoro-3-(3-(trifluoromethyl)phenyl)-4H-chromen-4-one(6c): White solid, m.p.: 108.1~108.4 ℃.1 H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.74 (d, J = 6.3 Hz, 1 H), 8.00 (s, 1 H), 7.91 (d, J = 7.4 Hz, 1 H), 7.87~7.68 (m, 5H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 174.3, 160.8, 157.5, 155.8, 152.1, 132.8, 132.7, 129.6, 125.4, 124.6, 122.7, 122.4, 121.8, 121.3, 110.2, 109.8.IR (KBr), ν (cm-1): 3075, 1634, 1476, 1326, 1261, 1177, 1118, 888, 829, 814, 804, 727.HRMS: m/z (rel intensity): (M+Na), Cal: 331.0358; found: 331.0359.
6-fluoro-3-(4-(trifluoromethyl)phenyl)-4H-chromen-4-one(7c): White solid, m.p.: 148.6~149.8 ℃.1H NMR [300 MHz, DMSO-d6/TMS, δ (ppm)]: δ 8.62 (s, 1 H), 7.95 (d, J = 8.8 Hz, 1 H), 7.82 (d, J = 4.3 Hz, 5 H), 7.21 (s, 1 H), 7.12 (d, J = 7.3 Hz, 1 H).13C NMR [75 MHz, DMSO-d6/TMS, δ (ppm)]: δ 174.6, 164.5, 158.0, 155.6, 131.8, 130.0, 126.4, 126.2, 124.0, 124.5, 123.2, 122.4, 122.0, 116.0, 114.5, 107.6.IR (KBr), ν (cm-1): 3070, 1633, 1479, 1324, 1170, 1119, 1103, 842, 830, 728.HRMS: m/z (rel intensity): (M+Na), Cal: 331.0358; found: 331.0353.
以上分析测试结果表明产物1c~7c均为目标产物,总产率约为60%。
3 讨论
本文以邻羟基苯乙酮为初始原料,参考相应文献制备3-碘色原酮;以3-碘色原酮为原料合成了3-碘色原酮锌试剂。在此基础上以3-碘色原酮锌试剂和卤代芳烃经Negishi交叉偶联反应合成含氟异黄酮化合物,并对反应条件进行了一系列优化探讨。
通过对锌粉活化发现,溶剂四氢呋喃用量对锌粉活化成功与否非常关键。四氢呋喃用量过多或过少锌粉都不能充分活化,3.5 mmol%的锌粉需要3 mL无水四氢呋喃[30]。通过对偶联反应中催化剂、配体实验条件优化发现,NiCl2(dppe)和NiCl2(PPh3)2都具有较好的催化效果,但相比NiCl2(dppe),NiCl2(PPh3)2催化效果更好且更加廉价易得;NiCl2(PPh3)2的用量对产率也有一定的影响,在确保经济且高效地前提下,6%NiCl2(PPh3)2为最佳用量。经过一系列实验探索,最终合成了7种含氟异黄酮,且有5种未见文献报道。
本文提出了一种绿色、高效合成异黄酮的新方法,该方法具有对环境友好、快速便捷、反应路线短,总产率高、易于放大等优点,对大批量、工业化生产含氟异黄酮有重要意义。
[1] Chang YC,Nair MG,Santell RC,et al.Microwave-Mediated Synthesis of Anticarcinogenic Isoflavones from Soybeans[J].J Agric Food Chem,1994,42(9):1869-1871.
[2] Wahlquist MT.Role of dietary phytoestrogens in the protection against cancer and heart disease[J].J Aust Prescr,1999,22(6):142-144.
[3] Costa AMBSRCS,Dean FM,Jones MA,et al.β-Deprotonation by lithium diisopropylamide.Vinyl carbanions from oxygen heterocycles in the synthesis of carboxylic acids in the benzofuran,flavone,and coumarin series and in the regiospecific acylation of 2,6-dimethylchromone[J].J Chem Soc Commun,1980,1224-126.DOI: 10.1039/C39800001224.
[4] CostaAMBRCS, Dean FM, Jones MA et al.Lithiation in Flavone,Chromones,Coumarines,and Benzofuran Derivatives[J].J Chem Soc,Perkin Trans.I.1985.DOI: 10.1039/P19850000799.
[5] Larget R,Lockhart B,Renard P,et al.Convenient extension of the Wessely-Moser rearrangement for the synthesis of substituted alkylaminoflavones as neuroprotective agents in vitro[J].Bioorg Med Chem Lett,2000,10(8):835-838.
[6] 蔡小华,姚祖凤,颜文斌,等.抗癌药物金雀异黄酮的合成进展[J].吉首大学学报,2001,2(2):71-74.
[7] Yokoe I,Sugita Y,Shirataki Y.Facile Synthesis of Isoflavones by the Cross-Coupling Reaction of 3-Iodochromone with Arylboronic Acids[J].Chem Pharm Bull, 1989,37(2):529-530.
[8] David AV,Andrew DW,Charles SM,et al.Structural Studies on Bioactive Compounds: Synthesis and Biological Properties of Fluoro-,Methoxyl-,and Amino-Substituted 3-Phenyl-4H-1-benzopyran-4-ones and a Comparison of Their Antitumor Activities with the Activities of Related 2-Phenylbenzothiazoles [J].Med Chem, 2006,49(13):3973-3981.
[9] Rao MLN,Venkatesh V,Jadhav DN.Pd-Catalyzed Efficient Cross Couplings of 3-Iodochromones with Triaryl bismuths as Substoichiometric Multicoupling Organometallic Nucleophiles[J].Synlett, 2009,16:2597-2600.
[10] Welch JT.Advances in the preparation of biologically active organofluorine compounds[J].Tetrahedron,1987.43(14):3123-3197.
[11] Rühl T, Böttcher C, Hennig L,et al.Hexafluoroacetone as protecting and activating reagent: Site-selective functionalization of iminodiacetic acid[J].Amino Acids,2004(3-4).DOI: 10.1002/chin.200521196.
[12] Anthony O King,Nobuhisa Okukado,Ei-ichi Negishi.Highly general stereo-,regio-,and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides[J].JChem Soc Chem Commun,1977,683-684.
[13] Haevey A.Chemistry of dihydroquercetin.I.Acetate derivatives[J].J Org Chem,1961.
[14] Prakash GK,Yudin AK.Perfluoroalkylation with Organosilicon Reagents[J].Chem Rev,1997,97:757-786.
[15] Sosnovskikh VY, Usachev BI, Sevenard DV,et al.Regioselective Nucleophilic 1,4-Trifluoromethylation of 2-Polyfluoroalkylchromones with (Trifluoromethyl)trimethylsilane.Synthesis of Fluorinated Analogs of Natural 2,2-Dimethylchroman-4-ones and 2,2-Dimethylchromenes[J].J Org Chem,2003.DOI: 10.1002/chin.200405110.
[16] Sosnovskikh VY,Sevenard DV,Usachev BI,et al.The first example of a preparative 1,4-perfluoroalkylation using (perfluoroalkyl)trimethylsilanes[J].Tetrahedron Lett,2003,34(22).DOI: 10.1002/chin.200322132.
[17] Biegasiewicz KF, Denism JDSt,Carroll VM,et al.An efficient synthesis of daidzein,dimethyldaidzein,and isoformononetin[J].Tetrahedron Letters,2010,51(33),4408-4410.
[18] Li YL,Zhang FJ.Synthesis of 3-iodo derivatives of flavones,thioflavones and thiochromones.[J].Synthesis,2010,24(30).DOI: 10.1002/chin.199350121.
[19] 蒋柳云,刘玉明.黄酮类化合物抗氧化活性的构效关系研究[J].化学研究与应用,2004,(4):510-512.
[20] 刘澎,谢晶曦.大豆异黄酮及其衍生物的合成及抗肿瘤活性研究[J].药学学报,2000,(8):583-586.
[21] Prasad ASB,Stevenson TM,Paul K,et al.Preparation and reactions of new zincated nitrogen-containing heterocycles [J].Tetrahedron,1997,53(21):16711.
[22] 张红雨.黄酮类抗氧化剂结构—活性关系的理论解释[J].中国科学B辑,1999,29(1):91-96.
[23] Arkady Krasovskiy,Paul Knochel.General Preparation of Primary,Secondary,and Tertiary Aryl Amines by the Oxidative Coupling of Polyfunctional Aryl and Heteroaryl Amidocuprates [J].Angew Chem Inted,2006,45(46):7838-7842.
[24] 林莉莎,林永成,Chan WL.黄酮类化合物清除对苯半醌负离子自由基研究(Ⅰ)[J].中山大学学报:自然科学版,2002,41(5):124-125.
[25] 何晓树,杨福秋,雷兴翰,等.B-环具不同取代基的5,7-二羟基黄烷酮的合成及其对离体豚鼠心脏的影响[J].医药工业,1988,(10):447-451.
[26] 许实波,林永成.艾纳香素对实验性肝损伤的保护作用[J].中国药理学报,1993,14(4):376-378.
[27] 金叶,李洪启.含全氟烷基磺酰基新型异黄酮化合物的合成[J].化学研究与应用,2007,19(8):928-932.
[28] 黄玉艾,严明霞,赵大云.高速逆流色谱结合制备型高效液相色谱法分离制备大豆皂苷单体[J].食品科学,2013,34(6):27-32.
[29] 吴永慧,贾竞夫,唐波,等.高速逆流色谱分离大豆皂苷和异黄酮[J].中国粮油学报,2010,25(12):24-27.
[30] 郑奇志,卫永第.大豆皂甙对胰岛素下的平滑肌细胞脂质过氧化反应的影响[J].白求恩医科大学学报,1998,24(5):455-457.
(编校:王冬梅)
A new method for green synthetic of fluoride isoflavone
DAI Li-yan1, ZHANG Zun-ting2
(1.School of Chemistry & Chemical Engineering, Zhoukou Normal University, Zhoukou 466000, China; 2.State Key Laboratory of Medicinal Resources and Natural Pharmaceutical Chemistry, School of Chemistry & Chemical Engineering of Shannxi Normal University, Xi’an 710062,China)
ObjectiveTo develop a new method for synthesis of isoflavones in order to synthetic more efficient,low toxicity and have antitumor activity isoflavones.Methods3-iodochromonone zinc reagent was synthetised by the insert of zinc to 3-iodochromonone,then Negishi cross-coupling reaction happened under the catalyst of 6% NiCl2(PPh3)2with halogenated benzene.ResultsSeven fluoride isoflavones were synthetised,and five of them have not been reported in literature,they were 2’-CF3isoflavone,3’-CF3isoflavone,4’-CF3isoflavone,6-F-2’-CF3isoflavone,6-F-3’-CF3isoflavone.The target products have been characterized by IR,HRMS,NMR spectroscopy. ConclusionThis is a kind of green and efficient new method for the synthesis of fluoride isoflavones.This method has advantages of environment friendly,fast and convenient,short reaction routes,high output rate,and easy to enlarge,etc.
fluoride isoflavones; 3- iodine chromone; synthetic method; Negishi cross-coupling reaction
周口师范学院青年科研基金(zknuc0203)
代丽雁,女,硕士,助教,研究方向:有机分析及新药开发,E-mail: lzx18738847807@163.com。
TQ460.31
A
1005-1678(2015)01-0156-05

