胰腺神经内分泌肿瘤2例报道
刘 涛,李争艳,杨巧蓉,张 茜,方捷迪,张梦玲,易慕华
(三峡大学仁和医院病理科,湖北 宜昌443001)
胰腺神经内分泌肿瘤2例报道
刘 涛,李争艳,杨巧蓉,张 茜,方捷迪,张梦玲,易慕华
(三峡大学仁和医院病理科,湖北 宜昌443001)
神经内分泌瘤;胰腺肿瘤/病理学;免疫组织化学
胰腺神经内分泌肿瘤(NENs)是起源于肽能神经元和神经内分泌细胞的复杂异质性肿瘤,其发病率较低,占所有胰腺肿瘤的1%~2%[1]。现报道NENs患者2例并进行文献复习,对其临床病理特征、鉴别诊断及预后影响因素进行分析,以提高对该肿瘤的认识。
1 临床资料
收集2014年三峡大学仁和医院最终确诊为NENs的患者2例,其中1例经会诊后确诊。复习患者的全部病史资料。标本均经10%中性福尔马林固定,石蜡包埋,苏木精-伊红(HE)染色,镜下观察。采用免疫组化SP两步法,所用抗体Syn、CgA、CD56、PCK、PR、CD99、E-cadherin、CD10、β-catenin、S-100、Vimentin、CyclinD1、EMA、Ki-67均购自福州迈新公司。具体操作步骤按试剂盒说明书进行,二氨基联苯胺(DAB)显色,HE复染,各设阳性及阴性对照。
患者1,女,45岁,于2014年8月14日因“体检发现胰腺占位入院”,取材肉眼见灰白色包块3.5 cm×2.0cm× 2.5 cm,切开囊实性,囊性区1.8 cm×1.2 cm,囊内为红色胶冻样物,内壁光滑,实性区为灰白色,质软。镜下见瘤细胞呈腺样、管泡状排列,有“器官样”结构,胞质嗜酸性、细颗粒状,核居中,圆形或卵圆形(图1)。部分区域呈囊性,囊内衬覆立方上皮。可见透明泡沫状胞质的细胞,未见明显坏死和核分裂象。本院诊断:经免疫组化显示PCK(+)、PR(+)、S-100(+)、β-catenin膜(+)、CD99膜(+)、E-cadherin浆(+)、CyclinD1弱(+)(图 2)、CD10(-)、Syn(-)、CgA(-)(图3)、Vimentin(-)、EMA(-)、Ki-67(LI约2%),结合临床、镜下及免疫组化符合胰腺实性-假乳头状瘤。后经华中科技大学同济医院会诊:NENs(WHOⅡ级)。
患者2,女,51岁,于2014年9月5日因“右下腹疼痛1 d入院”,取材肉眼见带脂肪组织包块5 cm×4 cm× 2 cm,部分区域见一3.0 cm×1.8 cm×2.0 cm的类圆形结节,临床已切开,切面灰白、灰褐,实性,包膜完整。镜下同患者1镜下所见。本院诊断:(胰尾部)神经内分泌肿瘤(G1)。免疫组化:Syn(+)、CgA(+)(图 4)、CD56(+)、PCK(+)、PR(+)、CD99(+)、E-cadherin(+)、CD10(+)、βcatenin膜浆(+)、S-100弱(+)、Vimentin(-)、CyclinD1(-)、EMA(-)、Ki-67(LI约2%)。
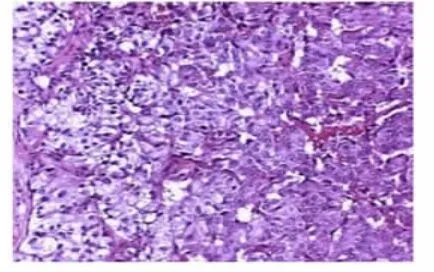
图1 瘤细胞呈腺样排列,有“器官样”结构(HE,200×)

图2 患者1的CyclinD1呈弱阳性表达(HE,200×)

图3 患者1 CgA呈阴性表达(HE,200×)
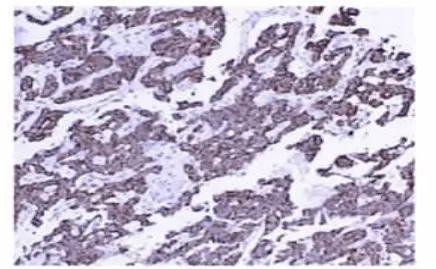
图4 患者2的CgA呈阳性表达(HE,100×)
2 讨 论
NENs是一类发病率较低、恶性程度也较低的肿瘤。由于肿瘤细胞可以摄取胺类物质作为生物合成的前体物质,该类肿瘤以往也称为弥散的神经内分泌系统细胞来源的肿瘤。组织学分为神经内分泌瘤(NET)、神经内分泌癌(NEC)和混合性腺神经内分泌癌(MANEC)[2]。
根据其临床表现可分为功能性和非功能性2类,以无功能性居多,占NENs的45%~60%。前者具有激素分泌功能并表现出相应的症状,如顽固性低血糖、难治的消化性溃疡等。而无功能性神经内分泌肿瘤生长过程较为缓慢,早期无明显症状,主要表现为肿瘤生长的占位性病变,诊断时往往已局部或远处转移[3]。本文报道的患者1因体检发现胰腺包块入院,患者2因阑尾炎腹痛入院发现,均属偶然发现,符合无功能性神经内分泌肿瘤的临床表现。但因本院缺乏功能性激素类抗体,如胃泌素、胰岛素、胰高血糖素等,未能用免疫组化证实。其发病的高峰年龄30~60岁,无明显性别差异。本文2例患者的发病年龄分别为45岁及51岁,在该年龄区间内。虽然2例均为女性,但是因样本量太小,不能提示女性发病率高。其发现率较高可能与影像学诊断技术的发展进步及现代女性在该年龄段更加注重身体健康,可偶然发现一些无症状的患者有关。
NENs的瘤细胞形态相对一致,核居中,圆形或卵圆形,呈实性、梁状、腺样、脑回状、管泡状或假菊形团状排列。可见间质不同程度的纤维化,有的肿瘤甚至基本被纤维替代,只有数个肿瘤细胞散在其中。偶见透明细胞,富于脂质的空泡状细胞。2例患者镜下见瘤细胞呈腺样、管泡状排列,有“器官样”结构,胞质嗜酸性、细颗粒状,核居中,圆形或卵圆形。部分区域呈囊性,囊内衬覆立方上皮。未见明显坏死和核分裂象。目前神经内分泌肿瘤尚无一个理想标记[4],多为几个抗体联合检测,表达PCK、Syn、CgA,不表达Vimentin、EMA等。但不能仅以免疫组化的表达作为诊断的依据,还要与镜下的组织学形态相结合。本文初诊为胰腺实性-假乳头状瘤的病例就没有出现Syn和CgA的表达。该例患者与胰腺实性-假乳头状瘤的表现有许多相似的地方,如包块为囊实性,囊性区1.8 cm×1.2 cm,囊内为红色胶冻样物,内壁光滑,实性区为灰白色,质软;且都只有局部症状而没有激素综合征,镜下均有透明泡沫状胞质的细胞,不表达CgA及Syn等。因为NENs与腺泡细胞癌、肾透明细胞癌相比恶性程度较低,患者的预后相对较好,诊断时更要慎重。
Ki-67是一种与细胞周期和有丝分裂相关的核抗原,其阳性率通常可提示有丝分裂的活跃程度。有研究就认为Ki-67增殖指数不仅与肿瘤的诊断和治疗有关,而且与肿瘤的级别高低有关,对NENs患者的预后评估密切相关[5]。按照增殖活性的不同,WHO(2010)分级系统将其分为G1、G2、G3 3个级别。2例患者Ki-67增殖指数均约为2%,术后至今无复发及转移。转移和邻近器官的侵犯同样提示该肿瘤的生物学行为为恶性。还有研究认为患者的预后与发病部位有关[6]。故推测可能与不同部位的肿瘤出现临床症状的时间不同,而发现较早的可早接受治疗有关。本研究患者1肿瘤发生在胰头,患者2发生在胰尾,前者发现就较早,在45岁接受手术治疗,后者51岁接受治疗。但预后情况还有待更长时间的随访观察。
另外,有研究报道胰腺NEC存在pl6INK4a/Cyclin Dl/RB和P53的过表达及相关的杂合性缺失,而在低级别的NET却很少有这2条通路的异常[7]。虽然研究表明二者在遗传学上是完全不同的个体,但是也不能完全排除低级别的NET转化为高级别的NEC的可能[8]。因此,推测P16、CyclinD1、P53的表达可能与患者的预后有关。有研究表明CyclinD1的表达情况与患者的生存率密切相关,高表达的患者易复发[9]。这与本研究报道一致,本研究中患者1有CyclinD1的弱表达,而患者2为阴性,随访至今均生存状况良好,未发生肿瘤转移与复发。这与另外的研究结果刚好与之相反,认为CyclinD1低表达的肿瘤侵袭性强,临床进程发展快,患者预后差[10]。但因本研究随访时间短、样本量小,还不能完全说明Cy clinD1的表达情况对其预后的影响。总之,目前虽然都认为CyclinD1与肿瘤恶性程度及临床预后相关,但高表达预后差还是低表达预后差尚未达成统一意见。
有研究表明,散发性胰腺胰岛细胞瘤只有3%发生P53突变,于是推测该基因突变在胰腺NEN中可能不起主导作用[11]。而P16表达的缺失与非小细胞肺癌、食管鳞状细胞癌、前列腺癌等肿瘤患者生存期短相关[12]。但有研究表明P16在胰腺NEN中虽有异常表达,该异常表达与患者预后相关资料欠缺[13]。出于对患者经济方面的考虑,该研究2例患者均未做P16及P53的免疫表达。
综上所述,NENs因其起病隐匿,诊断时多数患者已发生转移,且因其发病率较低,在认识方面仍存在不足,较易误诊。因此,还有待对其发病机制、诊断方法及预后影响因素的进一步研究,以期为临床提供一定的理论基础,从而指导临床对患者的治疗。
[1]Amador Cano A,García F,Espinoza A,et al.Nonfunctional neuroendocrine tumor of the pancreas:case report and review of the literature[J].Int J Surg Case Rep,2013,4(2):225-228.
[2]中国胃肠胰神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理学诊断共识[J].中华病理学杂志,2011,40(4):257-262.
[3]Burgos L,Burgos ME.Pancreatic neuroendocrine tumors[J].Rev Med Chil,2004,132(5):627-634.
[4]徐建明,杨晨.胃肠胰腺神经内分泌肿瘤国际诊断共识的解读[J].临床肿瘤学杂志,2011,16(11):1033-1038.
[5]Remes SM,Tuominen VJ,Helin H,et al.Grading of neuroendocrine tumors with Ki-67 requires high-quality assessment practices[J].Am J Surg Pathol,2012,36(9):1359-1363.
[6]Yao JC,Hassan M,Phan A,et al.One hundred years after"carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008,26(18):3063-3072.
[7]Muscarella P,MelvinWS,Fisher WE,et al.Genetic alterations in gastrinomas and nonfunctioning pancreatic neuroendocrine tumors:an analysis of p16/MTS1 tumor suppressor gene inactivation[J].Cancer Res,1998,58(2):237-240.
[8]Panarelli NC,Park KJ,Hruban RH,et al.Microcystic serous cystadenoma of the pancreas with subtotal cystic degeneration:another neoplastic mimic of pancreatic pseudocyst[J].Am J Surg Pathol,2012,36(5):726-731.
[9]Shin KY,Kong G,Kim WS,et al.Overexpression of cyclin D1 correlates with early recurrence in superficial bladder cancers[J].Br J Cancer,1997,75(12):1788-1792.
[10]Tut VM,Braithwaite KL,Angus B,et al.Cyclin D1 expression in transitional cell carcinoma of the bladder:correlation with p53,waf1,pRb and Ki67[J].Br J Cancer,2001,84(2):270-275.
[11]Jiao Y,Shi C,Edil BH,et al.DAXX/ATRX,MEN1,and mTOR pathway genes are frequently altered in pancreatic neuroendocrine tumors[J].Science,2011,331(6021):1199-1203.
[12]Nozoe T,Korenaga D,Kabashima A,et al.Significance of cyclin B1 expression as an independent prognostic indicator of patients with squamous cell carcinoma of the esophagus[J].Clin Cancer Res,2002,8(3):817-822.
[13]Li AF,Tsay SH,Liang WY,et al.Clinical significance of p16INK4a and p53 overexpression in endocrine tumors of the gastrointestinal tract[J]. Am J Clin Pathol,2006,126(6):856-865.
10.3969/j.issn.1009-5519.2015.14.068
:C
:1009-5519(2015)14-2247-02
2015-03-30)
刘涛(1982-),男,湖北宜昌人,主要从事临床病理诊断工作;E-mail:35249044@qq.com。
易慕华(E-mail:33784817@qq.com)。

