江浙沪甜瓜白粉病菌及其生理小种的鉴定
李苹芳 朱凌丽 羊杏平 徐锦华 刘广 姚协丰 牛徐江

摘 要: 为明确江浙沪地区甜瓜白粉病致病菌种类及优势生理小种,2014年秋季从江浙沪地区包括江苏宿迁宿城、淮安、南京六合、南京玄武、苏州吴中、南通海门,上海嘉定、奉贤,浙江宁波等地大棚甜瓜植株上采集了9份白粉病菌,通过镜检白粉孢子、考马斯亮蓝染色菌丝推断上述白粉病菌为单囊壳白粉菌Podosphaera xanthii;以南京玄武地区的白粉病菌DNA为模板扩增克隆其rDNA内转录间隔区(ITS)序列,分析确认其为单囊壳白粉菌Podosphaera xanthii;采用国际通用的13个鉴别寄主对上述白粉病菌进行喷雾接种鉴定,根据鉴别寄主抗感反应确认上述甜瓜白粉病菌为单囊壳白粉菌生理小种1,未发现其他生理小种。本研究初步明确了江浙沪地区甜瓜白粉病菌的菌种及优势生理小种,为甜瓜抗白粉病育种奠定了基础。
关键词: 甜瓜; 白粉菌; 生理小种; 江苏; 上海; 宁波
Abstract: To identify the species and physiological races of melon powdery mildew fungus from Jiangsu,Zhejiang and Shanghai areas,nine powdery mildew fungus were collected from melon plants grown in plastic tunnels in southeast China inlcuding Sucheng Suqian,Huaian,Luhe Nanjing,Xuanwu Nanjing,Wuzhong Suzhou,Haimen Nantong in Jiangsu province,Jiading and Fengxian in Shanghai and Ningbo in Zhejiang province during autumn in 2014. Microscopic observation of the conidia and Coomassie brilliant blue staining of the hyphae identified them as Podosphaera xanthii. The rDNA internal transcribed space(ITS) sequence analysis of the fungus from Nanjing Xuanwu confirmed it as Podosphaera xanthii. When these pathogens were inoculated onto the 13 international standard differential host,they were classified as P. xanthii Race 1 according to their susceptible/resistant reactions,no other races were found. This study characterized the species and predominate physiological races of melon powdery mildew fungus collected in Jiangsu,Zhejiang and Shanghai areas,which laid fundamental basis for melon powdery mildew resistant breeding.
Key words: Melon; Powdery mildew; Physiological race; Jiangsu; Shanghai; Ningbo
白粉病是一種在全世界瓜类作物上广泛发生的真菌性病害,如西瓜、甜瓜、黄瓜、南瓜、葫芦、苦瓜和丝瓜等作物在不同生育期都可遭受白粉病菌的侵害,其中黄瓜、甜瓜、南瓜和葫芦最易感病[1]。
近年来,随着设施甜瓜种植面积的急剧增加以及种植品种的单一,加上棚室内高温高湿的环境,白粉病发生严重,已成为我国甜瓜产业可持续发展的主要障碍因子。因此开展甜瓜白粉病菌的基础研究,尤其是明确各地危害甜瓜的白粉病菌菌种及相关生理小种,对于开展甜瓜抗白粉病育种至关重要。
白粉病菌属于高度专化性寄生真菌,侵染植物后在寄主表皮细胞内产生吸器,而菌丝体则匍匐在寄主体表[2]。白粉病菌主要侵染植物叶片,也危害叶柄、茎蔓,在感病严重的时期果实也会受到感染,导致坐果率降低,果实变小,品质下降[3]。研究表明甜瓜白粉病主要由单囊壳白粉菌Podosphaera xanthii和二孢白粉菌Golovinomyces cichoracearum这两种病原菌引起,而仅单囊壳白粉菌P. xanthii已经发现有11 个生理小种,分别是生理小种0,1,2U.S,2France3,4,5,6,7,N3和N4,而G. cichoracearum又有2个生理小种[4]。
目前我国学者对新疆[5]、吉林[6]、甘肃[7,8]、上海[9]、海南[10]等甜瓜主产区白粉病菌的生理小种作了初步鉴定,但江苏省的甜瓜白粉病菌生理小种尚未见报道。本文从华东江苏6个地区、上海2个地区、浙江宁波地区采集了9份白粉病菌,采用国际通用的13个鉴别寄主对上述白粉病菌进行接种鉴定,以期明确江浙沪地区,尤其是江苏省甜瓜白粉病菌致病菌种及生理小种的分化,为甜瓜抗白粉病育种奠定基础。
1 材料与方法
1.1 材料
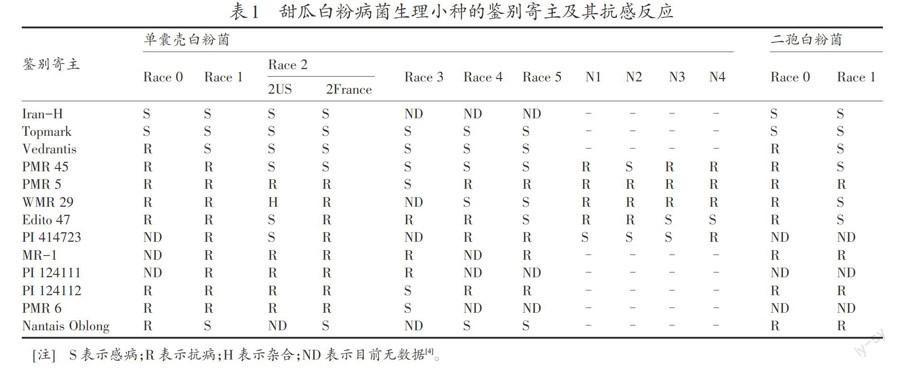
采用国际通用的甜瓜白粉病生理小种鉴定的一整套鉴别寄主(表1),分别为:‘PM‘R5‘PMR6‘PMR45‘WMR29‘MR 1‘Edisto 47‘Nantais Oblong‘Vedrantais‘Topmark‘Iran H‘PI 1241ll‘PI 124112‘PI 414723,均由程鸿博士(甘肃省农业科学院)提供。所有寄主材料在南京六合基地严格套袋自交扩繁。甜瓜鉴别寄主白粉病的抗感反应见表l。
1.2 白粉病菌鉴定方法
1.2.1 白粉病菌孢子形态观察 取白粉病菌无性世代分生孢子于载玻片上,加1滴3%的KOH溶液,盖上盖玻片,在10×40倍显微镜下观察分生孢子上是否有纤维状体。
1.2.2 白粉病菌菌丝染色观察 将长有白粉病菌的甜瓜叶片用打孔器打成小圆片,浸泡在含0.15%三氯乙酸的乙醇-三氯甲烷(75∶25,V/V)溶液中,70 ℃恒温水浴30 min以上,直至叶片脱色,用清水冲洗后,在15%三氯乙酸和0.6%考马斯亮蓝R-250(溶于99%甲醇中)混合液(体积比为1∶1)中,染色5 min,取出后用清水冲净,贮存于冰乙酸、甘油、水(体积比为5∶20∶75)混合液中,观察时以水为浮载剂,叶面朝上在光学显微镜下观察染色效果[11-12]。
1.2.3 白粉病菌ITS序列的克隆与测序 孢子的收集和DNA的提取按以下方法进行:从新鲜繁殖的长满白粉病菌的甜瓜叶片表面用干净的小毛笔刷下分生孢子,将其收集于1.5 mL离心管中,保存于-20 ℃冰箱进行DNA提取。DNA提取按照Omega真菌提取试剂盒里的方法进行。ITS区扩增引物采用真菌核糖体rDNA-ITS1(5-TCCGTAGGTGAACCTGCGG-3)和ITS4(5-TCCTCCGCTTATTGATATGC-3)[13]。PCR反应体系含DNA 模板1 μL(约30 ng),2×缓冲液10 μL、引物(2 μmol·L-1)各1 μL、Taq酶1 125 U,加ddH2O至20 μL。反应程序为:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸10 min。反应产物在琼脂糖凝胶上电泳检测。扩增的PCR 产物经纯化后连入pGEM-Teasy载体,经PCR验证阳性克隆后委托北京华大生物技术公司(上海分公司)测序。将测得的白粉病菌rDNA-ITS序列在DNASTAR软件(DNASTAR Inc.,Madison,WI,USA)进行分析后递交到GenBank,登录号为:KP980563。经Blast比对,搜索同源性序列,并在CLC sequence viewer 6.0软件中对3个白粉病菌序列进行同源比对分析。
1.2.4 白粉病菌生理小种的鉴定 感染白粉病菌的甜瓜叶片于2014年9月期间采自江苏宿迁宿城、淮安、南京六合、南京玄武、苏州吴中、南通海门,上海嘉定、奉贤,浙江宁波地区。白粉病菌13个鉴别寄主播种于50孔穴盘,1叶1心时进行喷雾接种,接种浓度为105个·mL-1,每个材料接10~15株苗,2次重复。鉴定所用瓜苗放置于长1.5 m,宽1.2 m,高1.5 m的不锈钢架内,架子四周与顶部用塑料薄膜封闭,架子置于塑料大棚内,大棚顶部覆盖遮阳网。不锈钢架内前两天保持90%以上湿度,后面通过顶部通风保持70%左右湿度,观察其发病情况,接种2周统计病情。甜瓜苗期病情鉴定采用6级分级标准:0级:整个植株没有病斑;1级:仅子叶有很少量病斑;2级:仅子叶有较多病斑或子叶有病斑,茎上有很少量病斑;3级:子叶有很多病斑,茎上有少量病斑;4级:子叶和茎上布满病斑,真叶有病斑;5级:植株因感病而死。病情指数=Σ(病级×该病级株数)/(最高病级×调查总株数)×100。病情指数≤45为抗(R);45<病情指数≤100为感(S)[14]。
2 结果与分析
2.1 白粉病菌孢子的形态观察
来自不同地方的白粉病菌首先进行镜检,其分生孢子均为椭圆形,无色,单胞,大小为约25 μm×12 μm,有发达的纤维状体。不同地方的白粉病菌形态大小无差异,如图1-A所示。进一步通过考马斯亮蓝染色法观察其菌丝体(图1-B),可清晰看到其分生孢子梗,分生孢子梗与菌丝呈垂直生长,孢子串生成念珠状,由此可初步推断本研究中接种的白粉病菌为瓜单囊壳白粉病菌。
2.2 白粉病菌ITS序列的分析
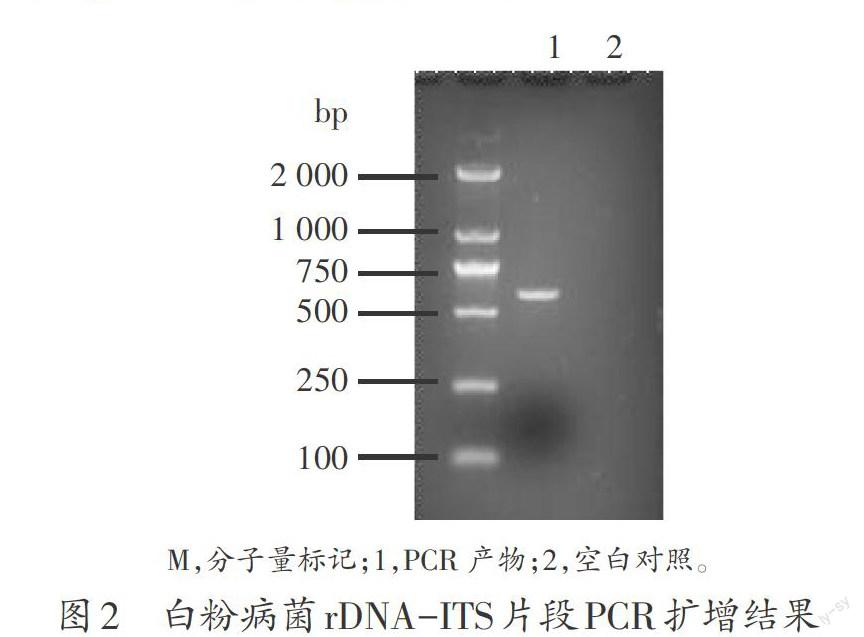
为进一步明确本研究中白粉病菌种类,我们选取江苏南京玄武地区甜瓜白粉菌进行rDNA-ITS序列分析。首先以病菌总DNA为模板,用ITS1和ITS4引物均扩增出大小为563 bp的目标片段(图2)。将PCR产物克隆到T载体,并进行测序,通过Blast发现南京玄武地区的白粉病菌与已报道的Podosphaera xanthii相似度达100%。
2.3 白粉病菌生理小种的鉴定
接种试验观察结果表明,在感病品种如‘Topmark上,白粉病菌接种1周肉眼可观察到明显的病斑,接种10天发病明显,2周已充分发病,可达到4级,不同的品种之间抗感差异明显。所接白粉病菌均可使‘IranH,‘Topmark,‘Vedrantais和‘Nantais Oblong4个品种发病,病情指数达到60%以上,最高达89.1%(表2),而其他材料除‘PI124112和‘PMR6有零星轻度发病外,均未出现白粉病症状。即9个地区的白粉病菌侵染13个鉴别寄主,只有‘IranH,‘Topmark,‘Vedrantais和‘ Nantais Oblong表现为感病(S),其他材料均表现抗病(R)(表3)。对照13个鉴别寄主抗感反应(表1),表明江苏宿迁宿城、淮安、南通海门、南京玄武、南京六合、苏州吴中,上海嘉定、奉贤,浙江宁波等地的甜瓜白粉病菌为单囊壳白粉菌生理小种1,未发现其他生理小种(表3)。
3 讨 论
试验采用国际通用的标准鉴定体系,对来自江苏省、上海市、浙江省的9份白粉病样品进行了白粉病菌菌种及生理小种的鉴定,明确了江苏省、上海市和宁波地区温室大棚甜瓜白粉病菌的生理小种为单囊壳白粉菌P. xanthii的生理小种1。
以往研究表明,单囊壳属单囊壳白粉菌(Podosphaera xanthii)和白粉属二孢白粉菌(Golovinomyces cichoracearum)是引起我国甜瓜白粉病的2个最主要的病原菌[15],二者无性阶段形态相似,而有性阶段的闭囊壳不经常出现,所以给病原物分类鉴定工作造成困难。Vakalounakis等[16]提出了2种病菌的结构差异,根据Podosphaera xanthii的分生孢子是椭圆形、有发达的纤维状体,而Golovinomyces cichoracearum 的分生孢子为细长的圆柱形、其上没有纤维状体而区分。本研究中,对不同地方的白粉菌孢子通过镜检、考马斯亮蓝染色菌丝初步确认江浙沪地区白粉菌可归为单囊壳白粉菌P. xanthii。近年随着分子生物学的发展,运用ITS序列进行真菌分类越来越普遍。ITS序列具有受外界环境影响较小、进化速度快的特点,既具保守性又在科、属、种水平上具有特异性,而且序列长度适中,含足够量的遗传信息[17-19]。如马原松等[20]对河南省几种作物的白粉菌进行了ITS序列分析,与形态观察结果一致。赵冰等[21]应用ITS序列快速鉴定了豌豆白粉菌种。为进一步确认形态观察的结果准确性,选取南京玄武地区的白粉菌进行ITS序列分析,blast结果表明南京玄武地區白粉病菌为单囊壳白粉菌P. xanthii。
甜瓜白粉病菌生理小种分化复杂,我国对各地甜瓜的白粉病菌的鉴别已有不少报道。在北京[14]、海南[10]、吉林[6]、上海[9]四个地区存在P. xanthii的生理小种1和2France,其中北京、海南和吉林的致病菌以2France为优势生理小种;而在上海以生理小种1为优势生理小种。这与本研究结果一致,本研究从上海奉贤和嘉定取样鉴定结果为P. xanthii的生理小种1,此前研究中上海的生理小种2只在浦东发现。徐志豪等[22]研究认为,P. xanthii 中的生理小种2 是引起浙江地区甜瓜白粉病的主要病原菌。但徐等采样地点只选取了杭州地区,不能说明整个浙江地区的甜瓜白粉病菌。本研究取了宁波地区甜瓜白粉病菌,结果表明宁波地区的甜瓜白粉病致病菌为P. xanthii的生理小种1。
马鸿艳等[23]对2009—2010年黑龙江省主要瓜类作物上的白粉病菌做了鉴定,发现了生理小种1和6,优势生理小种为1。刘东顺等[8]和张莉等[7]在不同年份对甘肃省甜瓜主要区进行了白粉病菌生理小种鉴定,刘东顺等[8]认为甘肃省甜瓜白粉病菌为单囊壳生理小种1和2Fance,还有7存在,优势小种为1,张莉等[7]鉴定结果为单囊壳生理小种1和2US,优势小种为1,这可能是取样年份不同,采样地点不同引起的鉴定结果差异。但引起甘肃甜瓜白粉病的白粉病菌优势生理小种一致,都是生理小种1。赵光伟等[24]鉴定认为单囊壳白粉菌生理小种1为郑州地区甜瓜白粉病致病生理小种。我们的研究采集了江苏6个地区、上海2个地区和浙江宁波地区共9份甜瓜白粉病菌样品,鉴定结果为P. xanthii的生理小种1是引起上述地区甜瓜白粉病的致病菌,并未发现其他生理小种。从以上研究可看出,引起我国甜瓜白粉病致病的病原菌主要为P. xanthii的生理小种1或2France,大部分地区仍然以生理小种1为优势种。
甜瓜白粉病菌生理小种复杂,明确引起各地甜瓜白粉病的致病菌生理小种,对于开展甜瓜白粉病防治,引进抗病材料和选育抗病品种具有重要意义。本研究只是选取了一部分地区的样品,应该加大采样地点,同时对某一地点开展连续多年的监测,密切关注生理小种的分布变化,从而可及时改变育种方案,培育具有针对性的抗性材料。
参考文献
[1] Sitterly W R.Powdery mildews of cucurbits[J].The powdery mildews,1978: 359-379.
[2] Kuzuya M,Yashiro K,Tomita K,et al.Powdery mildew(Podosphaera xanthii) resistance in melon is categorized into two types based on inhibition of the infection processes[J].Journal of Experimental Botony,2006,57(9): 2093-2100.
[3] Perez-Garcia A,Romero D,Fernandez-Ortuno D,et al. The powdery mildew fungus Podosphaera fusca(synonym Podosphaera xanthii),a constant threat to cucurbits[J]. Molecular Plant Pathology,2009,10(2): 153-160.
[4] 王娟,邓建新,宫国义,等. 甜瓜抗白粉病育种研究进展[J].中国瓜菜,2006(1): 33-36.
[5] 张学军,季娟,翟文强,等. 新疆地区厚皮甜瓜白粉病菌生理小种的鉴定[J].新疆农业科学,2013(8): 1450-1455.
[6] 张波,王利波,崔四川,等. 吉林省薄皮甜瓜主产区白粉病菌生理小种的初步鉴定[J]. 吉林蔬菜,2011(6): 100-101.
[7] 张莉,张慧君,张建农,等. 甘肃甜瓜白粉病病原种及生理小种的鉴定[J].甘肃农业大学学报,2011(2): 87-91.
[8] 刘东顺,程鸿,孔维萍,等. 甘肃甜瓜主产区白粉病菌生理小种的鉴定[J]. 中国蔬菜,2010(6): 28-32.
[9] 顾海峰,张旭,张文芳,等. 上海地区西甜瓜白粉病菌生理小种的鉴定[J]. 上海农业学报,2010(4): 155-158..
[10] 包海清,许勇,杜永臣,等. 海南三亚地区葫芦科作物白粉病菌生理小种分化的鉴定[J]. 长江蔬菜,2008(1): 49-51.
[11] Wolf G,Fric F.A rapid staining method for Erysiphe graminis f. sp. hordei in and on whole barley leaves with a protein-specific dye[J].Phytopathology,1981,71(6): 596-598.
[12] 王萍,欒非时,陈克农,等.4种染色方法对甜瓜白粉病菌染色效果的观察比较[J]. 菌物学报,2008(5): 673-678.
[13] White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A,Gelfand D H,Sninsky J J,White T J. In PCR Protocols: A Guide to Methods and Applications,San Diego,Academic Press,1990: 315-322.
[14] 王娟,宫国义,郭绍贵,等. 北京地区瓜类蔬菜白粉病菌生理小种分化的初步鉴定[J].中国蔬菜,2006(8): 7-9.
[15] 郑儒永. 中国真菌志. 白粉菌目[M]. 北京: 科技出版社,1987: 354-369.
[16] Vakalounkis D J,Klirenomou E,Papadakis A. Species spectrum,host range and distribution of powdery mildews on Cucurbitaceae in Crete[J]. Plant Pathology,1994,43(5): 813-818.
[17] 匡治州,许杨.核糖体rDNA ITS序列在真菌学研究中的应用[J].生命的化学,2004,24(2): 120-122.
[18 ] 李依韦,银玲.rDNA-ITS序列分析在植物病原真菌分类鉴定中的应用[J]. 内蒙古民族大学学报(自然科学版),2012,27(1): 66-67.
[19] Takamatsu S.Phylogeny and evolution of the powdery mildew fungi(Ersiphales,Asomycota) inferred from Iluclear ribosomal DNA sequences[J]. Mycroseience,2004,45(2): 147-157.
[20] 马原松,裴冬丽,王文静,等.河南省几种白粉菌的ITS序列分析[J].河南农业科学,2012,41(9): 87-90.
[21] 赵冰,刘铁志,文静.豌豆白粉菌ITS基因的快速克隆及序列分析[J].江苏农业科学,2013,41(3):34-35.
[22] 徐志豪,寿伟林,黄凯美,等.白粉病菌的生理小種及其对不同基因型甜瓜的致病性(英文)[J].浙江农业学报,1999(5): 29-32.
[23] 马鸿艳,魏尊苗,祖元刚,等. 2009-2010年黑龙江省主要瓜类作物白粉病菌生理小种鉴定[J]. 植物保护学,2011,38(3):287-288.
[24] 赵光伟,徐志红,徐永阳,等.郑州地区甜瓜白粉病菌生理小种鉴定[J].中国瓜菜,2012,25(6): 13-15.

