铈源及其组成对乙苯脱氢制苯乙烯催化剂结构和性能的影响
崔裕洋, 李 扬, 袁成龙, 方维平, 杨意泉
(1. 厦门大学 化学化工学院 化学工程与生物工程系, 福建 厦门 361005;2. 厦门大学 化学化工学院 化学系 醇醚酯清洁生产国家工程实验室, 福建 厦门 361005)
铈源及其组成对乙苯脱氢制苯乙烯催化剂结构和性能的影响
崔裕洋1, 李 扬1, 袁成龙1, 方维平1, 杨意泉2
(1. 厦门大学 化学化工学院 化学工程与生物工程系, 福建 厦门 361005;2. 厦门大学 化学化工学院 化学系 醇醚酯清洁生产国家工程实验室, 福建 厦门 361005)
以Ce(NO3)3和CeO2为混合铈源制备了一系列Fe-K-Ce-Mo乙苯脱氢催化剂,并采用BET、XRD、CO2-TPD和XPS等手段对其进行表征,考察了m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)对该催化剂结构、酸碱性以及催化乙苯脱氢反应性能的影响。结果表明,m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0.60时,催化剂具有中等水平的比表面积、较低的孔体积和较大的孔径,产生较多的活性相,酸碱中心数目和强度达到最佳,晶格氧丰富,催化剂催化乙苯脱氢反应活性最佳。
乙苯脱氢; 催化剂; 铈助剂; 乙苯; 苯乙烯
苯乙烯主要采用乙苯催化脱氢法生产,广泛使用Fe-K系催化剂。早期使用的催化剂中还引入了Cr作为助催化剂,增加其稳定性。但是Cr有毒,随后开发了环境友好的Fe-K-Ce-Mo系催化剂,并在工业装置中广泛应用[1],Ce是除Fe、K外含量最多的助催化剂。研究表明[2],Ce源为硝酸铈时,助催化效果明显,但CeO2则不佳。Ce可明显增加高钾催化剂的活性,但对产物选择性则无明显影响。廖仕杰等[3]认为,催化剂中添加Ce会较大幅度地提高苯乙烯收率;不同Ce源所制备乙苯脱氢催化剂的表面形貌不同, Ce在催化剂表面的分布也不同,以硝酸铈为Ce源制备的催化剂具有较高的活性、稳定性和产物选择性。乙苯脱氢催化剂的活性与其表面Ce的颗粒大小和含量有关。Ce在乙苯脱氢反应中部分以Ce3+的形式存在,很可能与Fe3+形成新的活性中心Fe3+—O—Ce3+。
笔者以组合形式的Ce(NO3)3-CeO2为Ce源,制备一系列不同Ce(NO3)3/CeO2质量比的Fe-K-Ce-Mo系催化剂,并采用N2吸附-脱附、XRD、CO2-TPD和XPS对其进行表征,考察了Ce(NO3)3/CeO2质量比对催化剂结构、酸碱性及催化乙苯脱氢反应性能的影响,以期对Ce源及其组成所产生的影响能有更深入的认识。
1 实验部分
1.1 原料
Fe2O3、Ce(NO3)3,工业级,宜兴市徐驰化工有限公司产品;MgO,分析纯,国药集团化学试剂有限公司产品;K2CO3,工业级,浙江大洋生物科技集团股份有限公司产品;CeO2,自制;羧甲基纤维素钠,工业级,上海赛璐珞厂产品;水泥,工业品,福建蓝田水泥有限公司产品;(NH4)6MO7O24,工业级,天津市海润莱化工有限公司产品。
1.2 Fe-K-Ce-Mo催化剂的制备
将一定量的CeO2、Fe2O3、MgO、羧甲基纤维素钠和水泥于捏合机中混匀,然后分别加入Ce(NO3)3水溶液、K2CO3和(NH4)6Mo7O24混合水溶液,继续捏合混匀,形成有黏性、适合挤条的面团状物。挤条(直径3 mm),切粒(长5~6 mm),110℃干燥4 h,840℃焙烧4 h,制得Fe-K-Ce-Mo催化剂。将按m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)分别为0、0.25、0.50、0.60、0.65、0.75、1.00添加二者所制备的催化剂相应记为G-0、G-25、G-50、G-60、G-65、G-75、G-100。制备所得Fe-K-Ce-Mo催化剂中各元素含量按氧化物计的质量分数计,w(Fe2O3)=70%(m(Fe2O3)/m(Fe2O3·H2O)=3/2),w(K2O)=12%,w(MgO)=1%,w(CeO2)=12%,w(MoO3)=1%,另外,含羧甲基纤维素钠1%、水泥3%。
1.3 催化剂表征
采用Micromeritics公司Tristar 3000型自动吸附分析仪测定试样的N2吸附-脱附等温曲线,测试前试样于300℃下真空脱气处理。采用Panalytical公司X’Pert Pro型X射线衍射仪对试样进行XRD表征,激发源CuKα,工作电流30 mA,工作电压40 kV,2θ扫描范围10o~70o。采用自建的NH3/CO2-TPD系统测定试样的酸碱性,用Hidden公司QIC-20型四极质谱仪检测信号;200 mg样品在50 mL/min Ar下升温至500℃,吹扫1 h,后降温至50℃,切换为30 mL/min的10%NH3(或CO2),吸附30 min后用50 mL/min Ar吹扫物理吸附的气体,再以15 mL/min Ar吹扫至质谱基线平直,以10℃/min升温至720℃。采用PHI公司Quantum 2000型X射线光电子能谱仪对试样进行XPS表征,以AlKα(hv=1486.6 eV)为激发源,以C1s的结合能为内标。
1.4 催化剂活性评价
采用等温固定床反应器(长550 mm、内径14 mm)评价Fe-K-Ce-Mo催化剂催化乙苯脱氢反应活性。催化剂装填量10 mL,反应温度610℃,水/乙苯摩尔比8.8,乙苯液时空速1.0 h-1;采用上海海欣色谱仪器有限公司GC950型气相色谱仪分析乙苯脱氢产物,AT.SE-54毛细管色谱柱(30 m×0.25 mm),气化温度150℃,柱温140℃,检测器(FID)温度180℃。分别采用式(1)~(3)计算乙苯转化率(xEB)、苯乙烯选择性(sST)和苯乙烯收率(yST)。
(1)
(2)
yST=xEB·sST
(3)
式(1)~(3)中,fB、fT、fEB和fST分别表示苯、甲苯、乙苯和苯乙烯的质量校正因子,采用苯作为基准物;AB、AT、AEB和AST分别表示苯、甲苯、乙苯和苯乙烯的峰面积。
2 结果与讨论
2.1 Ce源对Fe-K-Ce-Mo催化剂催化乙苯脱氢反应活性的影响
表1列出了不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂催化乙苯脱氢反应活性。从表1可以看出,m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0制备的催化剂G-0的活性较低。在Ce的总含量相同的情况下,随着m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)的增加,催化剂活性逐渐提高,其中G-60的活性最高,其苯乙烯收率比催化剂G-0提高了62.4%;继续增加m(Ce(NO3)3)/m(Ce(NO3)3+CeO2),催化剂活性逐渐下降,m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=1.00制备的催化剂G-100的活性亦较低。
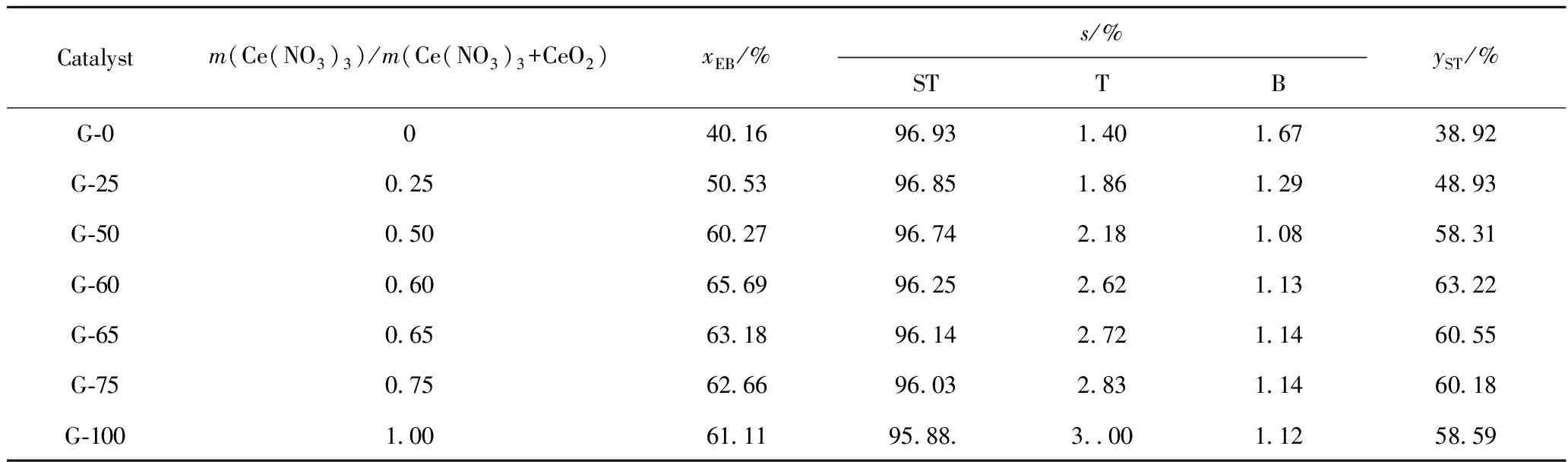
表1 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂催化乙苯脱氢反应活性
Reaction condition:T=610℃;n(H2O)/n(EB)=8.8;LHSVEB=1.0 h-1
2.2 Ce源组成对Fe-K-Ce-Mo催化剂物化性质的影响
2.2.1 对催化剂孔结构的影响
表2列出了不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的孔结构数据。从表2可见, G-0的比表面积和孔体积均较小,G-25的比表面积和孔体积均最大,此后,随着m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)的增加,催化剂的比表面积和孔体积逐渐降低;催化剂的孔径则随着m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)的增加而增加,m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)超过0.60后又逐渐减小,但G-100催化剂的孔径最大,达14.61 nm。这可能是由于当m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)超过0.60时,分解产生了过多的气体,孔结构有轻微的破坏,堵塞了部分孔道,致使制备的催化剂的孔径和比表面积稍有下降;而采用m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=1.00制备时,催化剂的孔道坍塌,堵塞了大部分微孔,所以孔径较大,孔体积和比表面积较小。
表1、表2结果表明,乙苯脱氢催化剂需要中等水平的比表面积、较低的孔体积和较大的孔径。
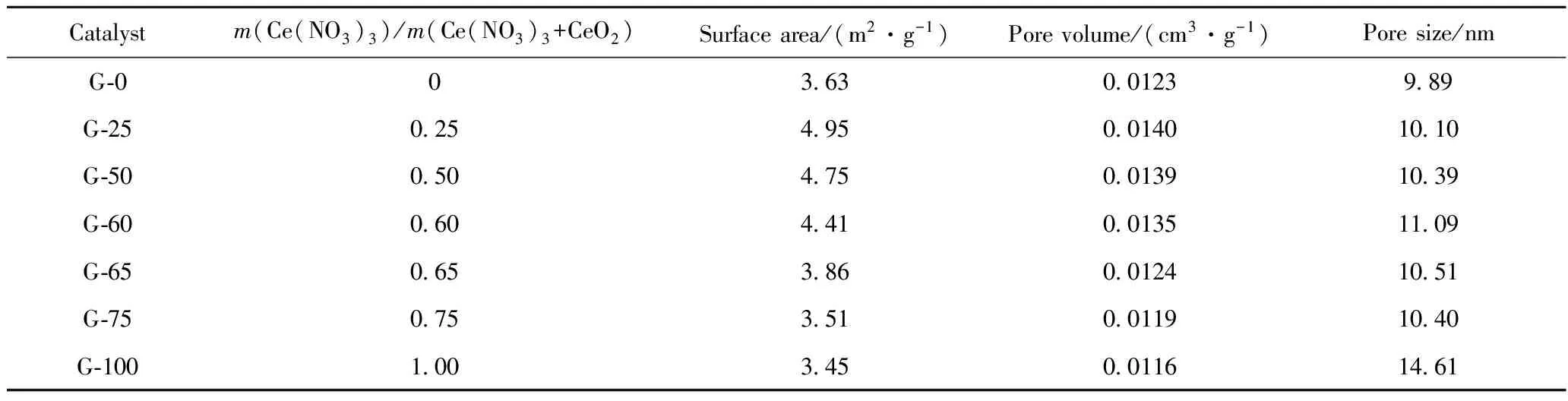
表2 m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)对所制备Fe-K-Ce-Mo催化剂比表面积、孔体积和孔径的影响
2.2.2 对催化剂物相的影响
图1为不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的XRD谱。 由图1可见,各Fe-K-Ce-Mo催化剂的XRD谱基本相同,其主要晶相为 KFe11O17和CeO2,未检测到其他物种明显的特征衍射峰。KFe11O17为Fe和K相互作用生成的具有尖晶石结构的化合物,通常被认为是反应活性相的前身; CeO2则是催化剂原料中Ce盐的分解产物[4]。催化剂样品在2θ为28.54°、33.04°、47.44°和56.30°处依次出现CeO2(111)、(200)、(220)和(311)晶面的特征衍射峰(JCPDS File no.00-029-0063),其余均为KFe11O17的晶面衍射峰。说明无论添加哪种Ce源,在成品催化剂中均以CeO2的形式存在,并且均有明显的多铁酸钾特征峰出现。然而在G-60的XRD谱中,CeO2和KFe11O17的峰形均较其他的尖锐,说明其中CeO2和KFe11O17的结晶度高。KFe11O17晶相形成与脱氢催化剂的稳定性密切相关[5-6]。这是因为KFe11O17具有K-β-Al2O3型尖晶石结构,K+隐藏在Fe—O骨架形成的尖晶石层状结构中,反应过程中,不容易从晶格中逸出,从而使KFe11O17的结构保持稳定。

图1 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的XRD谱
2.2.3 对催化剂表面酸碱性质的影响
在催化乙苯脱氢反应中,Fe3+是重要的活性位,乙苯分子首先在酸性位Fe3+上被活化,乙苯上的乙基被碱性位O夺去2个H生成2个—OH,碱性位的电子转移到酸性位,Fe3+转化为Fe2+,苯乙烯分子从酸性位脱附。然后,—OH上的H结合生成H2离开催化剂表面,Fe2+又恢复为Fe3+,碱性位复原。由于催化剂上的酸、碱位都参与了反应,这种机理被称为酸碱协同机理[7]。图2 为不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的CO2-TPD曲线。由图2可见,各Fe-K-Ce-Mo催化剂均有2组不同强度的还原峰,主要集中在50~200℃和550~700℃区域,分别对应弱碱中心和强碱中心[8-9]。随着m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)的增加,所制备的催化剂的弱碱中心和强碱中心数量逐渐减少,并且强碱中心的还原峰向低温方向移动。当m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)不高时,在100℃和520℃附近各有1个还原峰出现,随后减弱甚至消失,说明Ce(NO3)3的引入使得催化剂的碱中心峰面积减小。然而当m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0.60时,制备所得Fe-K-Ce-Mo催化剂的强碱中心还原峰面积比其他的都要大,碱强度处在中等水平,而该催化剂的乙苯脱氢的催化活性最高,说明其活性与强碱中心的数量和强度有关,而与弱碱中心的关系不大。图3 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的NH3-TPD曲线。从图3可以看出,在140℃附近有1个还原峰,归属于弱酸位;620℃附近有1个还原峰,归属于强酸位,并且随着m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)的增加,峰面积逐渐增大,表明催化剂表面强酸中心数量增加;G-60的强酸位峰面积最小,而弱酸位峰面积达到最大,与图2中碱性中心峰面积对应。根据酸碱协同理论,催化剂表面必须同时存在酸性位和碱性位,但是催化剂的碱性太强和太弱都会影响其催化乙苯脱氢活性;碱性太强会使得副产物甲苯量增多,而碱性太弱使得副产物苯量增多。因此,选择合适的m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)对制备具有高催化乙苯脱氢活性的Fe-K-Ce-Mo催化剂尤为重要。G-60的适宜的酸、碱中心数量和强度,使其催化乙苯脱氢活性达到最佳。

图2 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的CO2-TPD曲线

图3 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的NH3-TPD曲线
2.2.4 对催化剂表面晶格氧量的影响(XPS表征结果
在乙苯脱氢过程中同时存在直接脱氢和氧转移脱氢2种反应机理。晶格电子传递和邻近活性位氧化还原周期性协同进行是氧转移脱氢的必要条件。CeO2结构复杂,属立方晶系CaF2结构,当其被还原至CeO1.7时,仍保持此结构,但是出现了负离子空位。由于脱氢体系处于氧化还原动态平衡中,Ce4+和Ce3+共存,CeO2结构中出现了氧空缺和部分Ce3+,因此Ce的加入使氧缺位增多,从而增加了氧活动性和电子传递的渠道[10]。图4、图5分别表示不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂Ce 3d和O 1s的XPS谱。图4中主要有2种类型的多重谱线(U和V),二者分别对应的是自旋轨道双峰3d3/2和3d5/2的电子组态[11-13, 18]。U′′′、 U′′、U′、U分别对应能量峰916.5、907.3、903.5、900.6 eV;V′′′、V′′、 V′、 V分别对应能量峰898.4、889.9、885.3、882.2 eV。其中能量峰较强的U′′′和V′′′为Ce4+的3d104f0电子态,而能量较弱的U′和V′为Ce3+的3d94f1电子态[13, 15-17]。说明催化剂在煅烧后不仅生成CeO2,还会生成少量的Ce2O3。O的XPS谱均有2个峰,529.2 eV处的峰归属于金属氧化物晶格氧,531.6 eV处的肩峰归属为表面吸附的氧气或者表面的—OH物种[14, 19]。图5中只显示了1种峰,只是峰较宽,涵盖了529.2 eV和531.6 eV,并且变化较小,经过高斯拟合后可以发现,催化剂G-60在529.2 eV处的峰比其他催化剂的要大(峰面积为14431.89),说明其中的晶格氧较多,此与催化剂的活性数据正好对应。
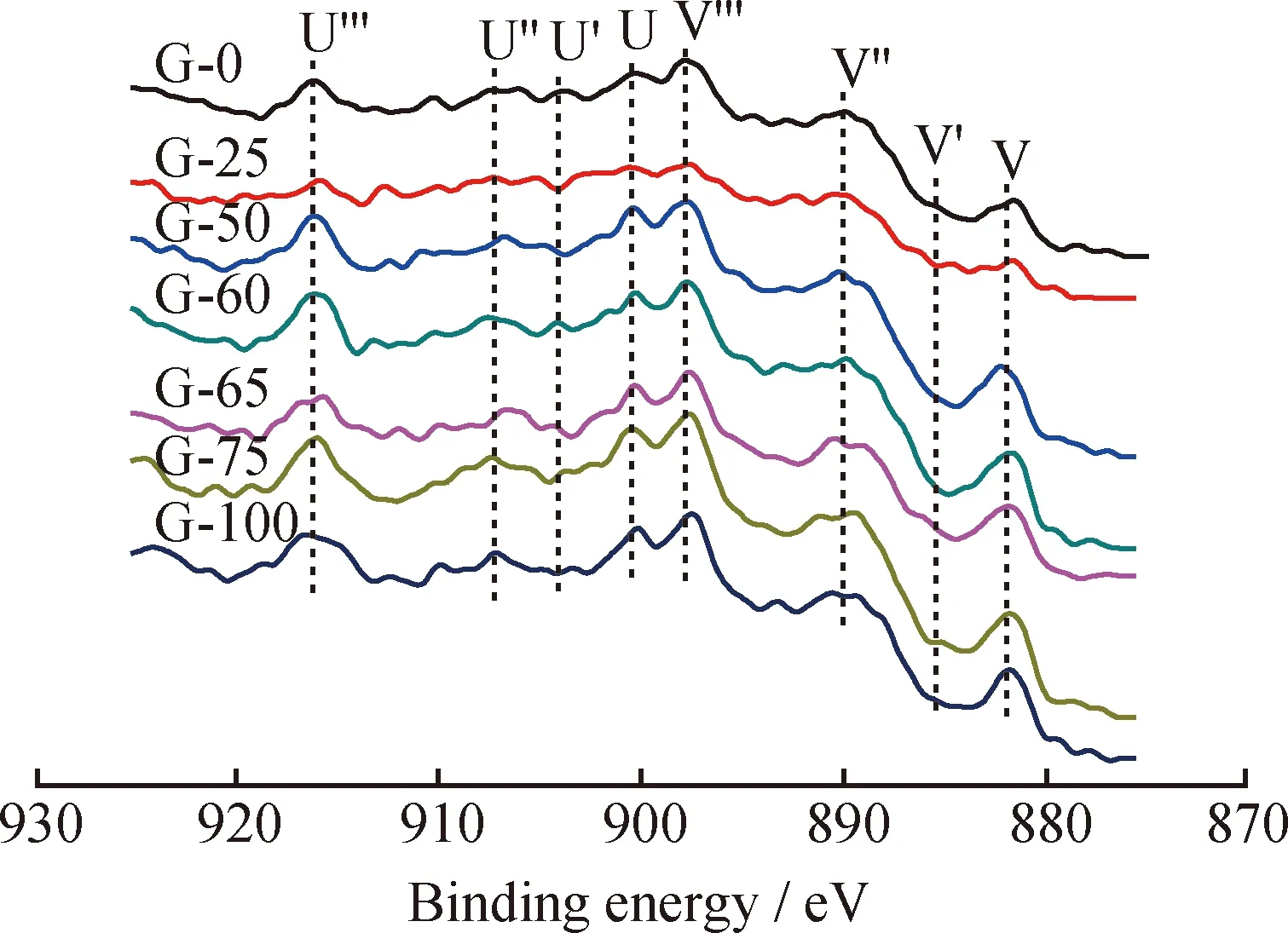
图4 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂Ce 3d 的XPS谱
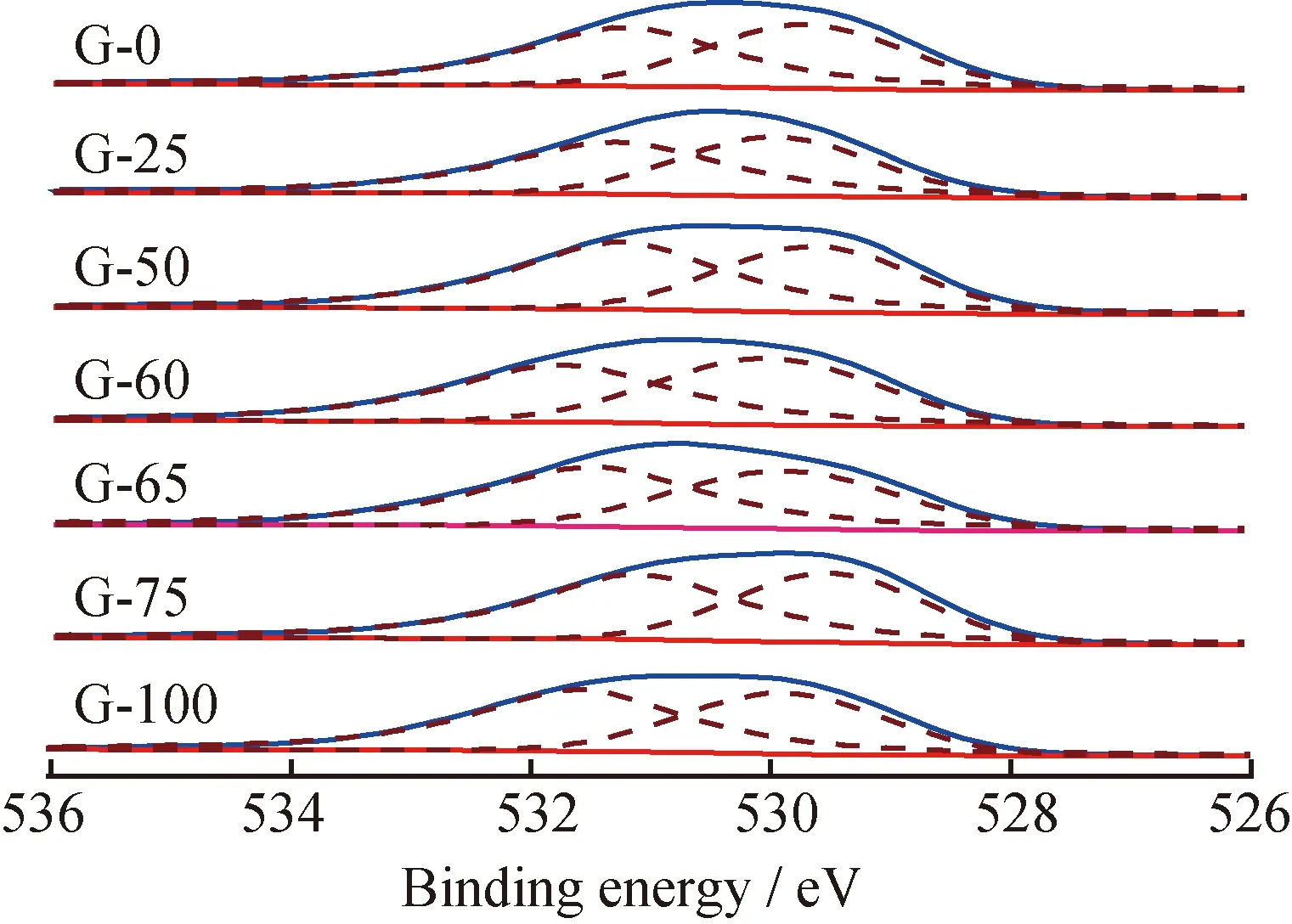
图5 不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂的O 1s的XPS谱
3 结 论
(1) 制备用于乙苯脱氢制苯乙烯的Fe-K-Ce-Mo催化剂时,采用的Ce源以Ce(NO3)3-CeO2组合较好;m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0.60所制备的催化剂能得到较高的乙苯转化率、苯乙烯选择性和苯乙烯收率。
(2) 在采用不同m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)制备的Fe-K-Ce-Mo催化剂中,m(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0.60所制得的Fe-K-Ce-Mo催化剂具有中等水平的比表面积、较低的孔体积和较大的孔径,KFe11O17相明显,催化剂表面碱性较强,酸碱中心数目和强度处于最佳,同时晶格氧丰富,氧化还原和电子传递活跃,因此催化乙苯脱氢活性最高。
[1] CAVANI F, TRIFIRO F.Alternative processes for the production of styrene[J]. Applied Catalysis A: General, 1995, 133:219-239.
[2] 祝以湘, 何淡云, 林仁存, 等. 铈在乙苯脱氢氧化铁基催化剂中的助催化作用[J]. 高等学校化学学报, 1991, 12(4):523-527. (ZHU Yixiang, HE Danyun, LIN Rencun, et al. Roles of Ce in potassium-promoted iron oxide based catalysts for ethylbenzene dehydrogenation to styrene[J]. Chemical Journal of Chinese Universities, 1991, 12(4):523-527.)
[3] 廖仕杰, 范勤, 缪长喜, 等. 铈及其前驱物对铁系乙苯脱氢催化剂性能的影响[J]. 化学反应工程与工艺, 2008, 24(6):493-497. (LIAO Shijie, FAN Qin, MIAO Changxi, et al. Effects of cerium and its precursor on performance of Fe2O3-K2O catalyst for ethylbenzene dehydrogenation to styrene[J]. Chemical Reaction Engineering and Technology, 2008, 24(6):493-497.)
[4] 黄祥健, 毛连生, 谢在库, 等. 催化剂焙烧设备的工业放大对乙苯脱氢催化剂的影响[J]. 石油学报(石油加工), 2007, 23(1):28-34. (HUANG Xiangjian, MAO Liansheng, XIE Zaiku, et al. Effect of the scale-up of calcinator on the catalyst for dehydrogenation of ethylbenzene[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2007, 23(1):28-34.)
[5] 蒋可玉, 杨燮龙, 袁怡庭. 乙苯脱氢铁系催化剂中铁钾尖晶石的穆斯堡尔谱研究[J]. 华东师范大学学报 (自然科学版), 2000, (4):61-64. (JIANG Keyu, YANG Xielong, YUAN Yiting. Mssbauer study on potassium ferrite spinal in iron catalysts for dehydrogenation of ethylbenzene[J]. Journal of East China Normal University (Natural Science Edition), 2000, (4):61-64.)
[6] IRMINA S, ANDRZEJ K, MACIEJ G, et al. Quenching of potassium loss from styrene catalyst:Effect of Gr doping on stabilization of the K2Fe22O34active phase[J]. Journal of Catalysis, 2006, 239:137-144.
[7] 何孝祥. 二氧化碳气氛下乙苯脱氢反应机理的研究[D]. 上海:华东理工大学, 2011.
[8] DE ARAUJO J C S, SOUSA C B A, OLIVEIRA A C, et al. Dehydrogenation of ethylbenzene with CO2to produce styrene over Fe-containing ceramic composites[J]. Applied Catalysis A:General, 2010, 377:55-63.
[9] EMERSON H L. Iron oxide catalysts for dehydrogenation of ethylbenzene in the presence of steam[J]. Catalysis Reviews:Science and Engineering, 1974, 8 (1):285-305.
[10] 何淡云,林仁存, 夏明,等. 乙苯脱氢制苯乙烯Fe2O3-K2O系催化剂的XPS研究[J]. 厦门大学学报(自然科学版),1991, 30(6):577-581. (HE Danyun, LIN Rencun, XIA Ming, et al. Study on Fe2O3-K2O based catalyst for dehydrogenation of ethylbenzee to styrene by XPS[J]. Journal of Xiamen University(Natural Science Edition),1991, 30(6):577-581.)
[11] BURROUGHS P, HAMNETT A, ANTHONY F O, et al. Satellite structure in the X-ray photoelectron spectra of some binary and mixed oxides of lanthanum and cerium[J]. Journal of the Chemical Society, Dalton Transactions, 1976, 17:1686-1698.
[12] PRALINE G, KOEL B E, HANCE R L, et al. X-ray photoelectron study of the reaction of oxygen with cerium[J]. Journal of Electron Spectroscopy and Related Phenomena, 1980, 21(1):17-30.
[13] PFAU A, SCHIERBAUM K D. The electronic structure of stoichiometric and reduced CeO2surfaces:An XPS, UPS and HREELS study[J]. Surface Science, 1994, 321(1-2):71-80.
[14] PAPARAZZO E, INGO G M, ZACCHETTI N. X-ray induced reduction effects at CeO2surfaces:An X-ray photoelectron spectroscopy study[J]. Journal of Vacuum Science and Technology A, 1991, 9(3): 1416-1420.
[15] ROMEO M, BAK K, EI FALLAH J, et al. XPS Study of the reduction of cerium dioxide[J]. Surface and Interface Analysis, 1993, 20(6):508-512.
[16] GUNNARSSON O, SCHÖNHAMMER K. Electron spectroscopies for Ce compounds in the impurity model[J]. Physical Review B, 1983, 28(8): 4315-4341.
[17] FUJIMORI A. Correlation effects in the electronic structure and photoemission spectra of mixed-valence cerium compounds[J]. Physical Review B, 1983, 28(8):4315-4341.
[18] KOTANI A, JO T, PARLEBAS J C. Many-body effects in core-level spectroscopy of rare-earth compounds[J].Advances in Physics, 1988, 37(1):37-85.
Effect of Cerium Sources and Their Composition on the Structure and Catalytic Performance of the Catalysts for Ethylbenzene Dehydrogenation to Styrene
CUI Yuyang1, LI Yang1, YUAN Chenglong1, FANG Weiping1, YANG Yiquan2
(1.DepartmentofChemicalandBiochemicalEngineering,CollegeofChemistryandChemicalEngineering,XiamenUniversity,Xiamen361005,China; 2.DepartmentofChemistry,CollegeofChemistryandChemicalEngineering,andNationalEngineeringLaboratoryforGreenChemicalProductionsofAlcohols,EthersandEsters,XiamenUniversity,Xiamen361005,China)
A series of Fe-K-Ce-Mo catalysts with Ce(NO3)3and CeO2as Ce precursor were prepared for ethylbenzene dehydrogenation to styrene and characterized by means of BET, XRD, TPD, and XPS techniques. The effect ofm(Ce(NO3)3)/m(Ce(NO3)3+CeO2) to the catalytic performance of the prepared Fe-K-Ce-Mo catalyst in ethylbenzene dehydrogenation was investigated. The results showed that whenm(Ce(NO3)3)/m(Ce(NO3)3+CeO2)=0.60, the prepared Fe-K-Ce-Mo catalyst possessed a middle level surface, low pore volume and large pore size, more active phase, the optimal amount and strength of acid-base center, rich lattice oxygen, so the best activity.
ethylbenzene dehydrogenation; catalyst; cerium additive; ethylbenzene; styrene
2014-07-07
崔裕洋,男,硕士研究生,从事乙苯脱氢催化剂研究;E-mail:cui.yuyang@163.com
杨意泉,研究员,从事多相催化、工业催化剂的研究与应用;Tel/Fax:0592-2880786;E-mail: yyiquan@xmu.edu.cn
1001-8719(2015)06-1402-06
TQ426
A
10.3969/j.issn.1001-8719.2015.06.022

