海水浸泡对大鼠坐骨神经损伤后促炎因子表达的影响及早期干预效果观察
王海峰,丁宏霞,胡沣,洪鹤,李葛巍,符来想,方健
海水浸泡对大鼠坐骨神经损伤后促炎因子表达的影响及早期干预效果观察
王海峰,丁宏霞,胡沣,洪鹤,李葛巍,符来想,方健
目的探讨海水浸泡加重坐骨神经损伤的机制和甲泼尼龙的保护作用,为海水浸泡坐骨神经损伤的临床治疗提供实验依据。方法健康雄性清洁级SD大鼠192只,随机分为假手术组(A组)、损伤对照组(B组)、损伤+海水浸泡组(C组)、甲泼尼龙治疗组(D组),每组48只。B、C、D组制作大鼠坐骨神经钳夹伤模型,C、D组制模成功后浸入人工海水1h,D组伤后给予甲泼尼龙20mg/(kg·d)尾静脉注射(共2d)。分别于伤后3d及1、2、4周采用坐骨神经功能指数(SFI)评定神经运动功能,然后取大鼠坐骨神经组织,采用RT-PCR检测IL-1β、IL-6和TNF-α mRNA表达水平,免疫组织化学法检测IL-1β、IL-6和TNF-α蛋白表达情况。结果伤后3d及1、2、4周A组坐骨神经功能指数无明显变化,而B、C、D组坐骨神经功能指数逐渐升高,且B、D组明显高于C组,差异有统计学意义(P<0.05)。伤后3d及1、2、4周A组坐骨神经组织中IL-1β、IL-6、TNF-α mRNA表达水平均较低,而B、C、D组IL-1β、IL-6 mRNA表达水平逐渐下降,且伤后3d及1、2周时B、D组表达水平明显低于C组(P<0.05),伤后4周时3组间比较差异无统计学意义(P>0.05);B、C、D 组TNF-α mRNA表达水平在伤后3d及1、2周时逐渐下降,且伤后3d及1周时B、D组表达水平明显低于C组(P<0.05),伤后2周及4周时3组间比较差异无统计学意义(P>0.05)。伤后3d及1、2、4周A组坐骨神经组织中IL-1β、IL-6、TNF-α蛋白均呈阴性(–)或弱阳性(+)表达,B、C、D组在伤后3d及1周时呈强阳性表达,此后逐渐减弱,至伤后4周时均呈阴性(–)或弱阳性(+)表达。结论海水浸泡增加了损伤的坐骨神经组织中IL-1β、IL-6和TNF-α的表达,导致炎症反应加重,阻碍了神经功能恢复。甲泼尼龙可促进海水浸泡大鼠坐骨神经的再生,其机制可能与抑制炎性反应有关。
海水浸泡;坐骨神经损伤;甲泼尼龙
周围神经损伤与修复过程中有多种细胞因子的参与,它们参与启动和调控瓦勒变性、保护受损神经元、促进轴突生长和髓鞘形成[1-3]。然而,坐骨神经损伤合并海水浸泡后细胞因子的表达变化及早期激素干预的影响目前尚未见报道。本研究采用海水浸泡坐骨神经损伤动物模型,以IL-1β、IL-6、TNF-α等的变化为出发点,观察海水浸泡对坐骨神经损伤的影响及早期使用甲泼尼龙的干预效果,旨在探讨海水浸泡加重坐骨神经继发性损伤的机制和甲泼尼龙的保护作用,为下一步有针对性地进行临床治疗提供实验依据。
1 材料与方法
1.1 人工海水的配制 采用Iannacone等[4]的配方配制人工海水,含460mmol/L NaCl,10mmol/L KCl,10mmol/L CaCl2,22mmol/L MgCl2,26mmol/L MgSO4和10mmol/L HEPES(pH7.8)。
1.2 主要试剂及仪器 Trizol试剂购自Invitrogen公司,反转录试剂盒、荧光定量PCR仪购自Thermo公司,荧光定量试剂及实验耗材购自QiaGen公司,免疫组化通用型二步法检测试剂盒及dab显色试剂盒购自北京中杉金桥生物技术有限公司,IL-1β、IL-6、TNF-α抗体购自北京博奥森生物技术有限公司。引物设计及合成由Invitrogen公司完成。
1.3 实验动物及分组 雄性健康清洁级SD大鼠192只,体重200~250g,由安徽医科大学实验动物中心提供,随机分为4组(n=48)。A组(假手术组):手术暴露坐骨神经,但不进行钳夹损伤、海水浸泡及药物干预处理;B组(损伤对照组):坐骨神经行动脉夹钳夹压迫致伤;C组(海水浸泡组):对坐骨神经行钳夹压迫后,将大鼠浸入人工海水1h,再清创缝合伤口;D组(甲泼尼龙治疗组):在C组的基础上,伤后给予甲泼尼龙20mg/(kg·d)尾静脉注射,共2d。实验大鼠均采用专门鼠笼分笼管理(每笼6 只),光照时间12h,专用鼠粮饲料喂养,自由饮水,饲养管理条件一致。
1.4 手术处理 参照Pan等[5]的方法制作大鼠坐骨神经钳夹伤模型。采用3%戊巴比妥钠(30mg/kg)腹腔注射麻醉大鼠,俯卧位固定,左侧股后部正中切口,自梨状肌下缘至膝关节上方暴露出长3cm坐骨神经,于梨状肌下1cm处用动脉夹钳夹坐骨神经,从相反的方向挤压2次,每次30s。损伤远端以10-0显微缝线作标记。C组及D组大鼠在坐骨神经做钳夹压迫后浸入人工海水1h,然后清创缝合伤口。钳夹伤模型制作成功的标志是压榨处肉眼可见一明显痕迹,神经外膜连续而透明,大鼠小腿及足完全瘫痪,展爪反射消失。
1.5 取材和切片 分别于伤后3d及1、2、4周取材。用3%戊巴比妥钠过量麻醉大鼠,暴露伤侧坐骨神经,取损伤远端坐骨神经1cm于–70℃冻存备用,每组6个标本,另外6个标本用4%多聚甲醛固定,组织脱水、透明、浸蜡、包埋、切片(厚度为4μm)。
1.6 观测指标
1.6.1 一般情况 包括伤后患肢伤口愈合情况,伤后患肢是否有溃疡、缺趾等,饮食、活动状况以及术侧肌肉萎缩情况。
1.6.2 坐骨神经功能评定 参照Pan等[5]的方法,采用坐骨神经功能指数(sciatic functional index,SFI)进行评分。自制大鼠足印行走箱,长50cm,宽10cm,箱底置等长等宽白纸,碳素墨水浸染大鼠足底,清晰记录大鼠双侧后足足迹3~4个,选实验侧足(E)、正常侧足(N)的足印测量3个变量:足印长度(PL)、足趾宽度(TS)、中间足趾距离(IT)。每组数据测量精确到毫米。测得数据后代入Bain公式,计算各组大鼠的SFI。SFI=–38.3(EPL-NPL)/ NPL+109.5(ETS-NTS)/NTS+13.3(EIT-NIT)/NIT-8.8。其中EPL为实验侧足印长度,NPL为正常侧足印长度,ETS为实验侧足距宽度,NTS为正常侧足距度,EIT为实验侧中间中趾宽度,NIT为正常侧中间足趾宽度。SFI=0为正常值,SFI=–100为神经完全离断损伤。A、B、C、D组分别于术前、伤后3d及1、2、4周随机选取6只大鼠进行检测。
1.6.3 RT-PCR检测IL-1β、IL-6和TNF-α mRNA的表达 取各组冻存的坐骨神经组织,Trizol法抽提总RNA,按反转录试剂盒说明书合成cDNA。所用引物设计及合成均由Invitrogen公司完成。IL-1β引物序列:上游5'-AATGACCTGTTCTTTGAGGCTGA-3',下游5'-CGAGATGCTGCTGTGAGATTTGA-3';IL-6引物序列:上游5'-TTCCAGCCAGTTGCCTTCT TG-3',下游5'-GGTCTGTTGTGGGTGGTATCCTC-3';TNF-α引物序列:上游5'-AGCAAACCACCAAG CGGAGG-3',下游5'-CAGCCTTGTCCCTTGAAGA GAAC-3';内参照β-Actin引物序列:上游5'-CCCAT CTATGAGGGTTACGC-3',下游5'-TTTAATGTCAC GCACGATTTC-3'。使用SYBR Green PCR试剂盒进行扩增,应用实时荧光定量PCR仪进行实时定量PCR分析。反应条件:95℃5min;95℃10s,60℃30s,共40个循环。PCR扩增反应结束后,进行产物的熔解曲线分析,以保证PCR产物的质量。各目的基因均与对应的参照基因进行校正。为减少误差,每个样本均重复3次,采用2–ΔΔCt法进行相对定量分析。
1.6.4 免疫组织化学法检测IL-1β、IL-6和TNF-α蛋白的表达 切片常规脱蜡至水,抗原修复后,依次加入兔抗大鼠抗体(1:200),生物素标记羊抗兔IgG(1:300)和辣根酶标记的链霉卵白素工作液(1:300),继之用DAB显色剂显色,裱片、晾干、透明、中性树脂封固。用PBS替代一抗作为阴性对照。选取组织结构较好的切片,采用Olympus AX80显微镜观察。蛋白表达结果判定:光镜下观察细胞质中是否出现淡黄色、黄色或褐黄色的染色颗粒,有颗粒存在者即为阳性细胞。根据阳性染色的显色程度分成如下4级:阴性(–),与背景颜色一致;弱阳性(+),细胞质或细胞膜呈淡黄色;阳性细胞质或细胞膜呈黄色;强阳性细胞质或细胞膜呈深黄色或褐黄色。
1.7 统计学处理 数据结果以表示,采用SPSS 13.0软件进行统计分析,多组间比较采用方差分析,进一步两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 实验中2只大鼠因麻醉过量死亡,另外有3只海水浸泡+损伤组大鼠在浸泡后2h内死亡,及时补充进行实验。其余大鼠伤后全部存活,未见伤口感染,也未因其他部位的感染而中断实验。
2.2 各组大鼠坐骨神经功能指数 A组大鼠足印无明显变化。B、C、D组大鼠伤后足印长度增大,足趾宽度及中间足趾距离均减小。B、C、D组伤后第3天坐骨神经功能指数分别为–75.22±3.15、–87.38±2.58、–84.36±3.08,B组明显高于C、D 组(P<0.05)。伤后1周3组坐骨神经功能呈缓慢而渐进的复苏,伤后2~4周恢复幅度增大。第4周末B、C、D组坐骨神经功能指数分别为–35.46±2.96,–60.42±2.36,–40.54±2.62,C组明显低于B、D组(P<0.05,图1)。
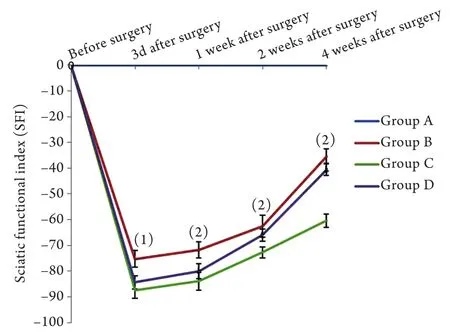
图1 各组大鼠坐骨神经功能指数变化Fig. 1 Changes of sciatic functional index (SFI) in each group of rats(1)P<0.05 compared with group C and group D; (2)P<0.05 compared with group B and group D
2.3 各组大鼠坐骨神经IL-1β mRNA及蛋白的表达
A组坐骨神经中IL-1β mRNA表达水平在各时间点均较低。B、C、D组坐骨神经中IL-1β mRNA表达水平在伤后3d最高,伤后1、2周时逐渐下降,但C组表达水平均高于B、D组,差异有统计学意义(P<0.05)。伤后4周时各组表达水平比较差异均无统计学意义(P>0.05,图2)。
A组坐骨神经中IL-1β蛋白表达在伤后各时间点均为(–)-(+),B、C、D组在伤后3d及1周时呈伤后2周呈伤后4周呈(–)-(+)。D组坐骨神经中IL-1β蛋白表达情况见图3。
2.4 各组大鼠坐骨神经IL-6 mRNA及蛋白的表达A组坐骨神经中IL-6 mRNA表达水平在各时间点均较低。B、C、D组坐骨神经中IL-6 mRNA表达水平在伤后3d最高,伤后1周、2周时逐渐下降,且2周时下降幅度较大,但C组表达水平均高于B、D组,差异有统计学意义(P<0.05)。伤后4周时各组表达水平比较差异均无统计学意义(P>0.05,图4)。
A组坐骨神经中IL-6蛋白表达在伤后各时间点均为(–)-(+),B、C、D组在伤后3d及1周时呈伤后2周呈伤后4周呈(–)-(+)。D组坐骨神经中IL-6蛋白表达情况见图5。
2.5 各组大鼠坐骨神经TNF-α mRNA及蛋白的表达 A组坐骨神经中TNF-α mRNA表达水平在各时间点均较低。B、C、D组坐骨神经中TNF-α mRNA表达水平在伤后3d最高,伤后1周时下降,但C组表达水平均高于B、D组,差异有统计学意义(P<0.05)。伤后2周和4周时各组表达水平比较差异均无统计学意义(P>0.05,图6)。
A组坐骨神经中TNF-α蛋白表达在伤后各时间点均为(–)-(+)。B、C、D组在伤后3d及1周时呈伤后2周、4周呈(–)-(+)。D组坐骨神经中TNF-α蛋白表达情况见图7。

图2 各组大鼠坐骨神经中IL-1β mRNA相对表达情况Fig. 2 Relative expression of IL-1β mRNA in sciatic nerve of each group of rats(1)P<0.01 compared with group B; (2)P<0.01 compared with group C
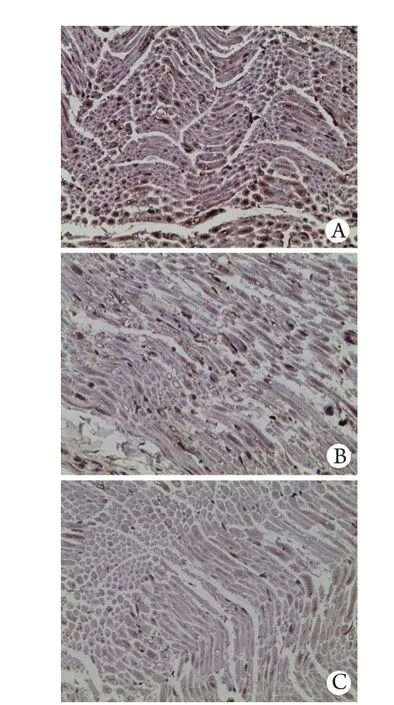
图3 D组大鼠坐骨神经中IL-1β蛋白表达情况(DAB ×400)Fig. 3 Expression of IL-1β protein in rat's sciatic nerve in group D (DAB ×400)A. 3 days after injury; B. 2 weeks after injury; C. 4 weeks after injury

图4 各组大鼠坐骨神经中IL-6 mRNA相对表达情况Fig. 4 Relative expression of IL-6 mRNA in sciatic nerve of each group of rats(1)P<0.01 compared with group B; (2)P<0.01 compared with group C
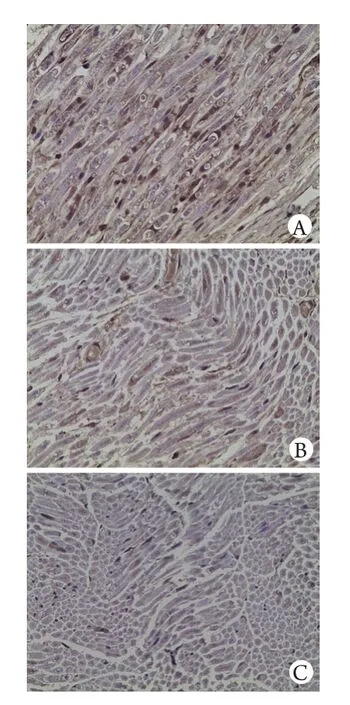
图5 D组大鼠坐骨神经中IL-6蛋白表达情况(DAB ×400)Fig. 5 Expression of IL-6 protein in rat's sciatic nerve in group D (DAB ×400)A. 3 days after injury; B. 2 weeks after injury; C. 4 weeks after injury

图6 各组大鼠坐骨神经中TNF-α mRNA相对表达情况Fig. 6 Relative expression of TNF-α mRNA in sciatic nerve of each group of rats(1)P<0.01 compared with group B; (2)P<0.01 compared with group C
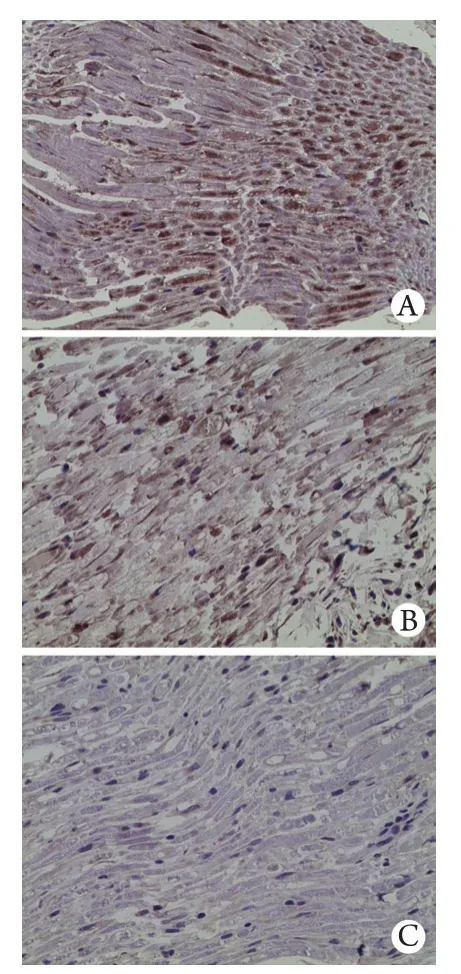
图7 D组大鼠坐骨神经中TNF-α蛋白表达情况(DAB ×400)Fig. 7 Expression of TNF-α protein in rat's sciatic nerve in group D (DAB ×400)A. 3 days after injury; B. 2 weeks after injury; C. 4 weeks after injury
3 讨 论
在各类海战及海上事故中,人员遭受战伤或外伤的机会明显增高。海水浸泡伤口或进入体腔会给创伤带来更严重的问题。目前国内外已有学者对合并海水浸泡的开放伤进行研究,主要涉及海洋生物造成的皮肤损伤、海水淹溺的影响及海水浸泡体表软组织伤、四肢骨折、脑外伤及胸腹腔开放伤等[6-9],但目前尚未见海水浸泡对坐骨神经损伤影响的相关研究。本研究采用海水浸泡坐骨神经损伤动物模型,观察了海水浸泡对坐骨神经损伤的影响及早期使用甲泼尼龙的干预效果。结果显示,与单纯钳夹伤比较,大鼠坐骨神经钳夹复合海水浸泡产生了更严重的肢体功能障碍,随后肢体功能有不同程度的恢复,在伤后第2~4周恢复较快。既往有研究显示坐骨神经钳夹伤后4周神经功能即恢复至稳定状态[10],故本研究观察到伤后第4周,结果显示在第4周末C组坐骨神经功能指数明显低于B、D组,差异有统计学意义。该结果提示,海水浸泡加重了坐骨神经损伤,阻碍了神经运动功能的恢复,早期激素治疗有利于坐骨神经功能的恢复。
海水的高渗、高碱、低温及细菌是比较公认的致伤因素。Shapior等[11]研究证实高渗液体可促进外周血单核细胞IL-8 mRNA及蛋白的表达,由于IL-8与脂多糖的协同作用,使TNF-α的合成增加,高渗刺激的时间越长,TNF-α的表达越多。TNF-α可直接激活单核/巨噬细胞和中性白细胞,导致超氧阴离子生成增加,引起组织损伤。海水偏碱的性质一方面可引起细胞膜内外离子浓度的失衡,另一方面可增强细胞的损伤反应,偏碱性环境下的损伤细胞更易发生崩解,使膜磷脂释放,发生脂质过氧化反应;还可使受损的组织形成皂化脂肪或可溶性的碱性蛋白,进一步加重组织损伤[12]。目前海水浸泡开放性创伤的损伤机制还存在较大争议,尚未得出全面而令人信服的结论。周围神经挤压伤的原发损伤为外力所致轴突损伤,而继发损伤为级联炎症反应所致,包括血管通透性改变、巨噬细胞的入侵等[13]。周围神经横断伤后,断端产生大量TNF-α、IL-1β、IFN-γ等致炎因子,参与轴索瓦勒变性[14]。这些细胞因子在周围神经损伤后的再生过程中具有重要作用,但炎性反应是周围神经损伤重要的发病机制,过度的炎性反应可造成组织细胞广泛损伤,影响轴突再生。本研究发现在伤后3d及1周、2周时,C组坐骨神经中IL-1β、IL-6 mRNA和蛋白表达水平均高于B组,而4周时两组间比较无明显差异。TNF-α与IL-1β、IL-6表达情况的不同在于伤后2周时C、B组比较无明显差异,可能与TNF-α是其他促炎因子级联反应的始动因素,可诱发IL-1、IL-6、IL-8等促炎因子的产生有关[15]。该结果表明海水浸泡增加了坐骨神经组织IL-1β、IL-6和TNF-α的表达,导致炎症反应加重,且海水浸泡坐骨神经损伤后的过度炎性反应主要发生在伤后2周内。
甲泼尼龙属于人工合成的糖皮质激素类药物,具有抗炎和免疫抑制作用。目前有关甲泼尼龙对神经损伤修复作用的研究多集中在急性脊髓损伤方面,而与周围神经损伤有关的研究相对较少。郜建飞等[16]观察了丙戊酸钠、甲泼尼龙以及两药联合应用对大鼠坐骨神经损伤的修复作用,结果显示两药联合对神经损伤的修复效果显著。姜保国等[17]观察了高、中、低剂量甲泼尼龙的神经修复作用,结果显示全身使用中、低剂量甲泼尼龙能有效促进大鼠周围神经再生,但以使用低剂量为宜,以防并发感染、精神症状等不良反应。Nachemson等[18]观察了甲泼尼龙对大鼠外周神经损伤的修复作用,结果发现伤后12周甲泼尼龙组坐骨神经运动传导速度明显高于对照组,提示甲泼尼龙对神经损伤修复有促进作用。坐骨神经功能指数除了可反映肌力恢复情况外,还可反映肌肉的协调功能,已成为评估坐骨神经功能的重要方法。本研究结果显示伤后4周D组坐骨神经功能指数明显高于C组,提示早期应用甲泼尼龙有利于坐骨神经功能的恢复。糖皮质激素在周围神经损伤中的作用较为复杂,有研究发现地塞米松可抑制免疫球蛋白在周围神经损伤部位的沉积,改善损伤神经周围的微环境,促进神经的再生及结构和功能的恢复[19]。本研究结果显示甲泼尼龙可减少海水浸泡坐骨神经损伤后IL-1β、IL-6和TNF-α的表达,从而减轻炎症反应,提示甲泼尼龙促进海水浸泡大鼠坐骨神经的再生可能是通过抑制炎性反应起作用的,但其具体机制及信号通路尚不清楚,同时最佳给药时间、给药方式及给药剂量也需进一步探讨。
本实验采用人工海水模拟了天然海水的低温、高渗、低碱理化性质,对海水中含有大量的微生物未予考虑,所以该结果虽可确定海水理化性质对坐骨神经神经损伤后功能恢复及IL-1β、IL-6、TNF-α表达的影响,并观察到早期激素的干预作用,但未能完全展示天然海水浸泡后的变化特点,仍有待后续研究进一步探讨。
[1]Li CB, Chen ZG, Chen TY,et al. Research progress of peripheral nerve defect repair[J]. Int J Orthop, 2013, 34(6): 420-423.[李春波, 陈增淦, 陈统一, 等. 周围神经缺损修复研究进展[J].国际骨科学杂志, 2013, 34(6): 420-423.]
[2]Zhang HL, Chen J. Clinical observation of nerve growth factor in the repair of peripheral nerve[J]. J Jilin Univ (Med Ed), 2011, 37(2): 303. [张涵亮, 陈俊. 神经生长因子修复周围神经的临床疗效观察[J]. 吉林大学学报(医学版), 2011, 37(2): 303.]
[3]Su JH, Lin W, Chen YF,et al. Effects of buflomedil on neural cell apoptosis and expression of vascular endothelial growth factor in dorsal root ganglionic following crushing lesion of sciatic nerve in rats[J]. J Zhengzhou Univ (Med Sci), 2011, 46(5): 674-677.[苏建华, 林伟, 陈玉芳, 等. 丁咯地尔对大鼠坐骨神经嵌压伤后背根神经元凋亡及血管内皮生长因子表达的影响[J].郑州大学学报(医学版), 2011, 46(5): 674-677.]
[4]Iannacone JM, Ren S, Hatcher NG,et al. Collecting peptide release from the brain using porous polymer monolith-based solid phase extraction capillaries[J]. Anal Chem, 2009, 18(13): 5433-5438.
[5]Pan HC, Wu HT, Cheng FC,et al. Potentiation of angiogenesis and regeneration by G-CSF after sciatic nerve crush injury[J]. Biochem Biophys Res Commun, 2009, 382(1): 177-182.
[6]Vidal HJ, Omar L,Juan PL,et al. Tropical dermatology:marine and aquatic dermatology[J]. J Am Acad Dermatol, 2009, 61(5): 733-750.
[7]Leonidas G, Nikolaos M, Vasiliki P,et al. Near drowning: clinical course of lung injury in adults[J]. Lung, 2009, 187(2): 93-97.
[8]Rui M, Duan YY, Zhang XH,et al. Urinary trypsin inhibitor attenuates seawater-induced acute lung injury by influencing the activities of nuclear factor-κB and its related inflammatory mediators[J]. Respiration, 2012, 83(4): 335-343.
[9]Ning HY, Meng YH, Liu X,et al. Analysis of factors in the process of healing delay in trauma after seawater immersion[J]. Transl Med J, 2013, 2(5): 272-276.[宁浩勇, 孟宇宏, 刘肖, 等.创伤合并海水浸泡后愈合过程延迟的因素分析[J]. 转化医学杂志, 2013, 2(5): 272-276.]
[10] Brown TJ, Khan T, Jones KJ. Androgen induced cceleration of functional recovery after sciatic nerve injury[J]. Restor Neurol Neurosci, 1999, 15(4): 289-295.
[11] Shapior L, Dinarello CA. Hypeorsmotic sterss as stimulant for porinflammatory cytokine production[J]. Exp Cell Res, 1997, 231(2): 354-362.
[12] Luo ZA, Pu T, Huang Q. The treatment analysis of leg isolated injury with seawater immersion[J]. Orthop J Chin, 1998, 5(5): 467.[罗志安, 蒲涛, 黄强. 小腿离断后高渗碱性海水损伤治疗分析[J]. 中国矫形外科杂志, 1998, 5(5): 467.]
[13] Heumann R, Korsching S, Bandtlow C,et al. Changes of nerve growth factor synthesis in nonneuronal cells in response to sciatic nerve transection[J]. J Cell Biol, 1987, 104(6): 1623-1631.
[14] Shamash S, Reichert F, Rotshenker S. The cytokine network of wallerian degeneration:tumor necrosis factor-a, interleukinlβ[J]. J Neurosci, 2002, 22(8): 3052-3060.
[15] Liu YF, Yang CX. The effect of perineural injection of clonidine on the expression of TNF-α and IL-6 in the rats with chronic constriction injury (CCI) in the sciatic nerve[J]. J Baotou Med Col, 2009, 25(5): 19-22.[刘永峰, 杨承祥. 坐骨神经周围注射可乐定对CCI大鼠促炎性细胞因子表达的影响[J]. 包头医学院学报, 2009, 25(5): 19-22.]
[16] Gao JF, Wang D, Wang B,et al. Research of the valproic acid and methyl-prednisolone combination in the rat sciatic nerve injury[J]. Nat Med Front Chin, 2010, 5(8): 9-10.[郜建飞, 王东,王博, 等. 丙戊酸钠联合甲基强的松龙治疗大鼠坐骨神经损伤的实验研究[J]. 中国医疗前沿, 2010, 5(8): 9-10.]
[17] Jiang BG, Dang Y, Zhang DY,et al. Effect of methyprednisolone on repair of oeripheral nerve injury[J]. Chin J Surg, 2001, 39(6): 476-477.[姜保国, 党育, 张殿英, 等. 甲基泼尼松龙对周围神经修复的影响[J]. 中华外科杂志, 2001, 39(6): 476-477.]
[18] Nachemson AK, Lundborg G, Myrhage R,et al. Nerve regeneration and pharmacological suppression of the scar reaction at the suture site. An experimental study on the effect of estrogen-progesterone, methylprednisolone-acetate and cishydroxyproline in rat sciatic nerve[J]. Scand J Plast Reconstr Surg, 1985, 19(3): 255-260.
[19] Wang QW, Zuo XC, Liu T. Immunological mechanism of glucocorticoid in promoting peripheral nerve regeneration[J]. Med Innov Chin, 2011, 8(11): 172-173.[王庆武, 左新成, 刘涛.糖皮质激素促进周围神经再生的免疫学机制[J]. 中国医学创新, 2011, 8(11): 172-173.]
Influence of seawater immersion on expression of proinflammatory cytokines and intervention effect of methylprednisolone for sciatic nerve injury in rats
WANG Hai-feng, DING Hong-xia, HU Feng, HONG He, LI Ge-wei, FU Lai-xiang, FANG Jian*
Department of Micro-Orthopedics, 105 Hospital of PLA (PLA Clinical College Affiliated to Anhui Medical University), Hefei 230031, China
*< class="emphasis_italic">Corresponding author, E-mail: 13956970650@139.com
, E-mail: 13956970650@139.com
This work was supported by the “Eleventh Five-Year Plan” Medical Science Development Foundation of Nanjing Command (09Z008)
ObjectiveTo explore the mechanism of aggravation of sciatic nerve injury after seawater immersion and the protective effect of methylprednisolone against injury so as to provide an experimental basis for clinical treatment of seawater immersion complicated sciatic nerve injury.MethodsA total of 192 Sprague-Dawley rats were randomly divided into group A (sham injury group), group B (injury control group), group C (seawater immersion + injury group), group D (methylprednisolone treatment group). The model of rat sciatic nerve injury was reproduced by crush injury in groups B, C and D. The sciatic nerves were crushed followed by seawater immersion for 1 hour in groups C and D. Methylprednisolone (20mg/(kg.d)) was injectedviathe tail vein in group D for 2 days. The Sciatic Functional Index (SFI) was used to assess the nerve function on 3rd day and 1, 2 and 4 weeks after injury, and IL-1β, IL-6, TNF-α mRNA and protein expression were determined with RT-PCR or immunohistochemistry.ResultsThe SFI of group A showed no significant change on 3rd day up to 4 weeks after injury. The SFIs in groups B, C and D were gradually increased from 3rd day to 4 weeks after injury. SFI was lower in group C compared with groups B and D (P<0.05). The expressions of IL-1β, IL-6 and TNF-α mRNA in group A were lower on 3rd day and 1, 2 and 4 weeks after injury. The expressions of IL-1β and IL-6 mRNA in groups B, C and D were gradually decreased from 3 days to 4 weeks after injury, and theexpression in group C was significantly higher than that of groups B and D on 3rd day and 1 and 2 weeks (P<0.05). No statistical difference was found in the 4th week among groups B, C and D. The expressions of TNF-α mRNA in groups B, C and D were gradually decreased from 3 days to 2 weeks after injury. The expression of TNF-α mRNA in group C was significantly higher than that of groups B and D on the 3rd day and 1st week (P<0.05). No statistical significant difference was found among groups B, C and D at the 2nd and 4th week. The expression levels of IL-1β, IL-6 and TNF-α protein in group A were from (-) to (+) on 3rd day and 1, 2 and 4 weeks after injury. The expression levels of IL-1β, IL-6 and TNF-α protein in groups B, C and D wereon 3rd days and 1 week after injury, while those of IL-1β and IL-6 protein wereand TNF-α protein (-) to (+) at 2 weeks. The expression levels of IL-1β, IL-6 and TNF-α protein in groups B, C and D were (-) to (+) 4 weeks after injury.ConclusionsSeawater immersion would upregulate the expressions of IL-1β, IL-6 and TNF-α after sciatic nerve injury in rats, and it would cause inflammation and hinder the recovery of nerve function. Methylprednisolone could promote the regeneration of sciatic nerve after seawater immersion in rats, probably by inhibiting the inflammatory reaction.
seawater immersion; sciatic nerve injury; methylprednisolone
R651.3
A
0577-7402(2015)10-0788-06
10.11855/j.issn.0577-7402.2015.10.04
2014-11-25;
2015-08-03)
(责任编辑:胡全兵)
南京军区“十一五”医学科研重点课题(09Z008)
王海峰,医学博士。主要从事周围神经损伤的基础与临床研究
230031 合肥 解放军第105医院(安徽医科大学解放军临床学院)显微骨四科(王海峰、丁宏霞、胡沣、洪鹤、李葛巍、符来想、方健)
方健,E-mail:13956070650@139.com

