降钙素基因相关肽调节核转录因子-κB信号转导对缺氧c-kit+心脏干细胞凋亡的影响
龙仙萍,郑小宇,王冬梅,许官学,赵然尊,石蓓
降钙素基因相关肽调节核转录因子-κB信号转导对缺氧c-kit+心脏干细胞凋亡的影响
龙仙萍,郑小宇,王冬梅,许官学,赵然尊,石蓓
目的探讨降钙素基因相关肽(CGRP)对缺氧环境下c-kit+心脏干细胞凋亡的影响。方法体外建立c-kit+心脏干细胞缺血缺氧模型,实验分为缺氧+CGRP组,缺氧+CGRP8-37(CGRP拮抗剂)组,细胞缺氧对照组,常氧细胞组,缺氧+BAY11-7082[核转录因子-κB(NF-κB)抑制剂]组。采用免疫荧光检测细胞缺氧后NF-κB转位情况;采用Western blotting检测NF-κB通道蛋白的表达,同样方法检测CGRP干预后NF-κB转位及通道蛋白表达。同时用流式细胞仪检测CGRP干预后细胞凋亡率。结果在缺氧状态下,NF-κB信号通路被激活,NF-κBP65发生核转位(呈现红色荧光)。与细胞缺氧对照组比较,缺氧+CGRP组NF-κB相关信号蛋白P-I-κB、NF-κBP65及NF-κBP50表达减少(P<0.05);与缺氧+CGRP组比较,CGRP+CGRP8-37组上述NF-κB相关信号蛋白表达增加(P<0.05)。在细胞凋亡方面,与缺氧对照组比较,缺氧+CGRP组早、晚期细胞凋亡率均降低(P<0.05);与缺氧+CGRP组比较,缺氧+CGRP8-37组细胞早期凋亡增加(P<0.05)。结论CGRP在调节NF-κB信号的同时抑制了缺氧环境下c-kit+心脏干细胞的凋亡。
降钙素基因相关肽;NF-κB;缺氧;c-kit+心脏干细胞;细胞凋亡
细胞疗法是目前治疗缺血性心肌病的重要手段之一[1],以往研究主要集中在骨髓间充质干细胞(BMSCs)作为细胞移植的种子细胞[2-3]。本课题组以往研究显示,BMSCs移植在一定程度上能改善心肌梗死后心脏功能,并可减少血管成形术后再狭窄的发生[4]。心脏干细胞(CSCs)具有组织特异性和专一性,可分化为心肌细胞、平滑肌细胞和内皮细胞。目前多项研究已证实,与BMSCs相比,CSCs具有更强的心肌修复作用[5]。然而无论何种细胞作为细胞疗法的种子细胞,皆受困于心肌梗死后局部恶劣的微环境使移植细胞存活数量极少[6-8]。目前,人们正寻求各种方法来增加移植细胞的存活力。本课题组前期研究显示,降钙素基因相关肽(calcitonin gene related peptide,CGRP)干预BMSCs后,在体外观察到CGRP抑制核转录因子-κB(NF-κB)转录,增强缺氧状态下BMSCs的存活,并且BMSCs的增殖分化不受影响[9]。针对是否CGRP对缺氧状态下CSCs也具有同样的保护作用,本实验建立体外细胞缺血缺氧模型,观察CGRP对缺氧状态下c-kit+CSCs凋亡的影响,并观察抑制NF-κB信号转导对上述CGRP 在c-kit+CSCs凋亡中的作用,以期能为心脏干细胞有效治疗心肌梗死提供实验依据。
1 材料与方法
1.1 材料 随机选择清洁级4~6周龄小鼠,雌雄不限,购自第三军医大学实验动物中心。大鼠/小鼠CGRP多肽(Phoenix Pha Rmaceuticals,美国),大鼠/小鼠CGRP8-37多肽(Phoenix Pharmaceuti Cals,美国),兔抗小鼠NF-κBP50抗体(博士德公司),兔抗小鼠NF-κBP65抗体(Santa Cruz公司),兔抗小鼠IκB-a(Phospho-Ser32/Ser36),兔抗小鼠IκB-a抗体、NF-κB激活-核转运检测试剂盒、BAY11-7082(NF-κB抑制剂)(碧云天公司)。
1.2 方法
1.2.1 小鼠c-kit+CSCs的获取 无菌下处死4~6周龄小鼠,分离小鼠双侧心耳,剪碎成大小为1mm3的组织块后置于15ml离心管中,加入0.1% Ⅱ型胶原酶,于37℃恒温水浴锅中边摇晃边消化约1h;1200r/min离心5min,弃上清。Ham's/F-12完全培养基重悬并分装于细胞培养瓶内,37℃、5%CO2孵箱中孵育。待细胞铺满瓶底至80%~90%时,弃培养基,加入0.05%胰蛋白酶消化分离贴壁细胞,1200r/min离心5min,弃上清。1%BSA封闭,含1%FBS的Ham's/F-12培养基5ml(不含双抗)重悬细胞,加入兔抗小鼠c-kit抗体(1:250),垂直混合仪上4℃旋转孵育1h;1200r/min离心5min,弃上清,Ham's/F-12培养基3ml重悬细胞,加入羊抗兔二抗包被磁珠(1:150),再次置于垂直混合仪上,4℃孵育0.5h。孵育完后置于DYNAL磁力架上,移液枪轻轻吸除管中液体(不可触碰管壁一侧附着的棕褐色磁珠),培养基重悬细胞,于37℃、5%CO2孵箱中孵育,每隔2d全量换液一次。待c-kit+CSCs铺满瓶底至80%~90%时,流式细胞仪检测细胞表面抗原c-kit、CD34、CD45的表达。
1.2.2 体外CSCs缺血缺氧模型的建立 取c-kit+CSCs,并将培养基更换为无血清Ham's/F-12培养基后继续孵育24h,使细胞达到同步化状态。移至37℃三气孵箱中进行缺氧处理,孵箱内3种气体比例分别为N2 94%、CO25%、O21%,缺氧12h进行后继实验。
1.2.3 免疫荧光检测NF-κB信号通路核转位情况 实验分为5个组,分别是缺氧+CGRP组、缺氧+CGRP8-37(CGRP拮抗剂)组、缺氧+BAY11-7082(NF-κB抑制剂)组、细胞缺氧对照组、常氧细胞组。参考前期课题组方法[4],收集不同干预组细胞标本后,固定洗涤细胞,然后加入封闭液,室温封闭1h。吸除封闭液后加NF-κBP65抗体,4℃孵育过夜。洗涤后加抗兔Cy3,室温孵育1h,洗涤后加细胞核染色液(DAPI),室温染色5min左右。吸除核染色液,洗涤后滴加抗荧光淬灭封片液,封片后荧光显微镜下观察。
1.2.4 Western blotting检测NF-κB及相关信号蛋白表达 实验分为5个组,分别是缺氧+CGRP组、缺氧+CGRP8-37(CGRP拮抗剂)组、缺氧+BAY11-7082(NF-κB抑制剂)组、细胞缺氧对照组、常氧细胞组。参考前期课题组方法[4],分别收集各组蛋白样品进行SDS-PAGE凝胶电泳、转膜及封闭后,分别加入兔抗小鼠IκB-a抗体(1:200)、兔抗小鼠IκB-a(Phospho-Ser32/Ser36)抗体(1:500)、兔抗小鼠NF-κBP50抗体(1:200)、兔抗小鼠NF-κBP65抗体(1:200)、兔抗小鼠β-actin抗体(1:400)、兔抗小鼠GAPDH抗体(1:200)4℃孵育过夜,加入HRP标记山羊抗兔IgG二抗,室温孵育1h后显影。采用Biorad GelDoc XR成像系统对目的蛋白进行定性及定量分析。
1.2.5 流式细胞仪检测细胞凋亡 实验分为4个组,分别是缺氧+CGRP组、缺氧+CGRP8-37(CGRP拮抗剂)组、细胞缺氧对照组、常氧细胞组。收集各干预组细胞,加入Ham's/F-12完全培养基重悬细胞,取1×105个重悬细胞,1200r/min离心5min,弃上清,加入195μl Annexin V-FITC结合液+5μl Annexin V-FITC混匀并重悬细胞。室温(20~25℃)避光孵育10min,1200r/min离心5min,弃上清,加入190μl Annexin V-FITC结合液+10μ碘化丙啶(PI)染色液混匀并重悬细胞,冰浴避光放置。另设3管对照,分别为空白细胞管、仅加5μl Annexin V-FITC管及仅加10μl PI管。上机前向各管中再加入300μl Annexin V-FITC结合液,枪头轻轻吹打混匀,进行流式细胞仪检测。
1.3 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以表示,组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 c-kit+CSCs的分离、培养及鉴定 原代CSCs贴壁生长12d后,倒置显微镜下可见细胞形态一致,呈长梭状或多角形,分布不均匀(图1A)。待原代细胞基本铺满细胞瓶底时,行免疫磁珠分选法分选出c-kit+CSCs继续培养,细胞生长约6d时,高倍显微镜下可见细胞体积与未分选前相比稍有增大,周围附有数个半透明折光度强的圆形小磁珠(图1B)。行FACS鉴定示c-kit+CSCs表面抗原的表达为c-kit阳性,而CD34、CD45为阴性。
2.2 Western blotting检测c-kit+CSCs上CGRP受体表达情况 CGRP受体由受体活性修饰蛋白-1(receptor activity modifying protein-1,RAMP1)、降钙素受体样受体(calcitonin receptor-like receptor,CRLR)和受体组成蛋白(receptor component protein,RCP)组成。CGRP通过与细胞表面CGRP受体即RAMP1/CRLR复合物结合发挥作用。Western blotting结果显示,c-kit+CSCs上有RAMP1、CRLR及RCP受体的表达(图2)。

图1 大鼠c-kit+CSCs细胞培养(×200)Fig.1 Cultivation of rat c-kit+CSCs (×200) A. Primary generation of CSCs cultivated for 12d; B. c-kit+CSCs after magnetic beads separation
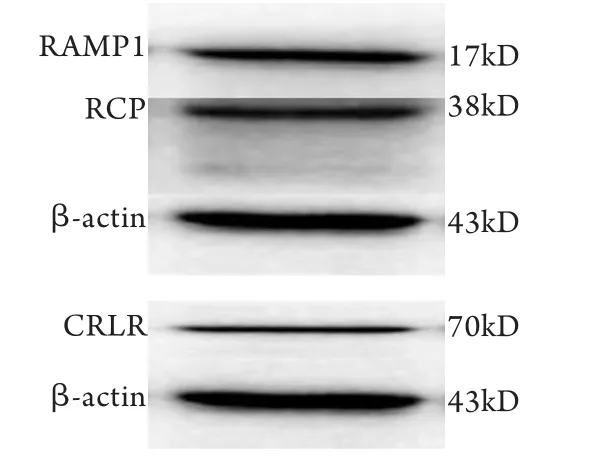
图2 Western blotting检测c-kit+CSCs上CGRP受体的表达Fig.2 Expression of CGRP receptor in c-kit+CSCs (Western blotting)RAMP1. Receptor activity modifying protein-1; RCP. Receptor component protein; CRLR. Calcitonin receptor-like receptor
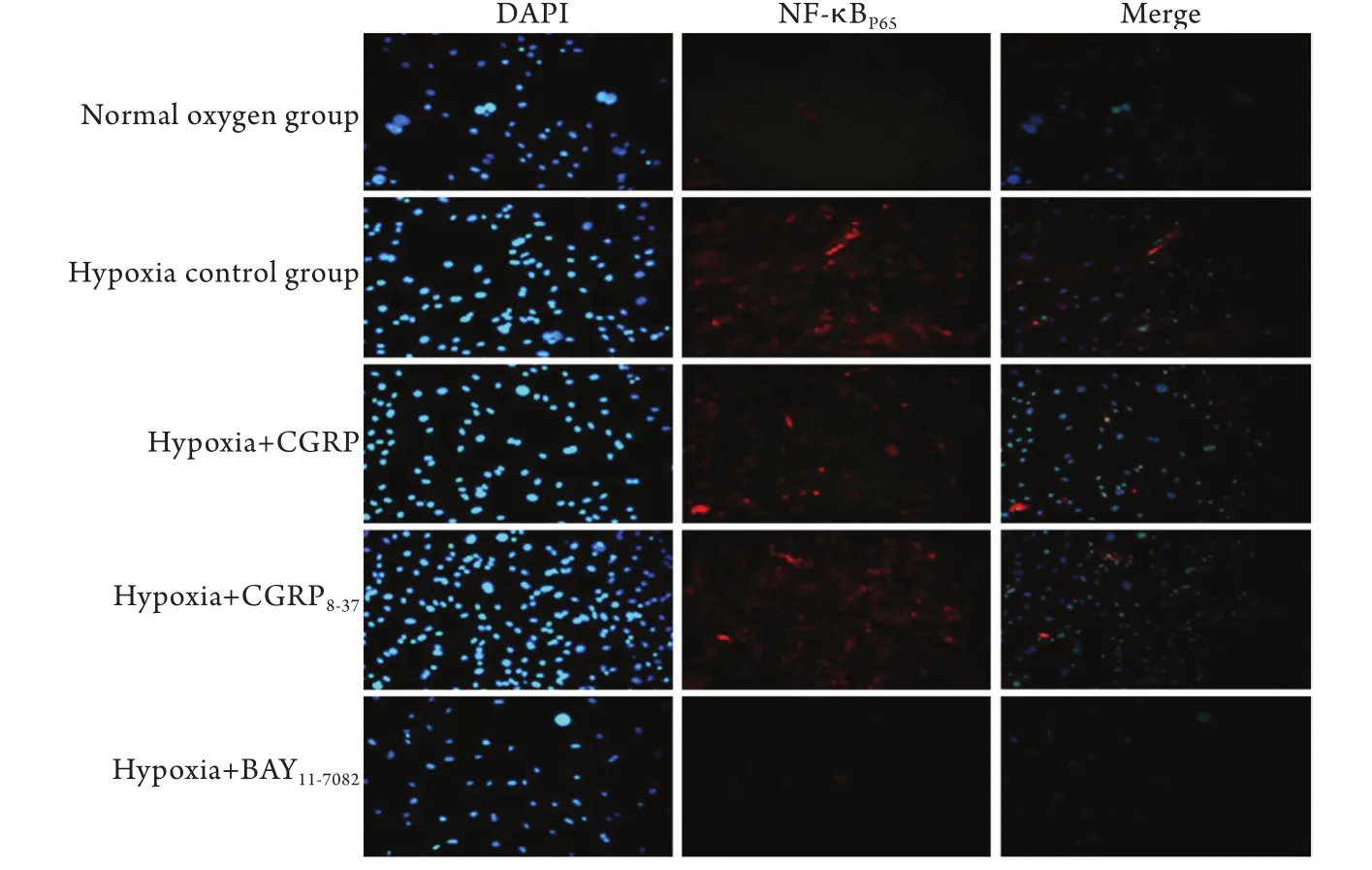
图3 免疫荧光检测CGRP对NF-κB信号通路核转位的影响(×200)Fig.3 Effect of CGRP on the nuclear translocation of NF-κB signal pathway (Immunofluorescence ×200)
2.3 CGRP调节缺氧c-kit+CSCs中NF-κB信号通路
2.3.1 CGRP对NF-κB信号通路核转位的影响 未被激活的NF-κB和IκB-α形成一个复合物,分布在细胞质内,当其被外界因素激活,IκB-α发生磷酸化后与NF-κB解离,NF-κB的亚基p65及p50进入至细胞核内。应用免疫荧光法检测细胞缺氧后NF-κB转录,转录后NF-κBP65呈红色荧光,细胞核呈蓝色荧光。免疫荧光法检测结果显示,常氧细胞组和缺氧+BAY11-7082组的细胞核内几乎无红色荧光,而细胞缺氧对照组与缺氧+CGRP8-37组见大量红色荧光表达,缺氧+CGRP组细胞内红色荧光较少(图3),表明缺氧下诱导NF-κB信号转录,CGRP对NF-κB信号通路有调控作用。
2.3.2 CGRP调节NF-κB信号通路蛋白的表达Western blotting检测结果(图4)显示,细胞缺氧后12h,与常氧细胞组比较,细胞缺氧对照组P-I-κB、NF-κBP65及NF-κBP50表达增加(P<0.05),进一步证实缺氧诱导NF-κB转录。与细胞缺氧对照组及缺氧+CGRP8-37组比较,缺氧+CGRP组P-I-κB、NF-κBP65及NF-κBP50表达降低(P<0.05),与细胞缺氧对照组比较,缺氧+CGRP8-37组上述NF-κB通道蛋白表达差异无统计学意义(P>0.05),然而,与缺氧+BAY11-7082组比较,缺氧+CGRP组中P-I-κB、NF-κBP65及NF-κBP50蛋白表达明显增加(P<0.05)。
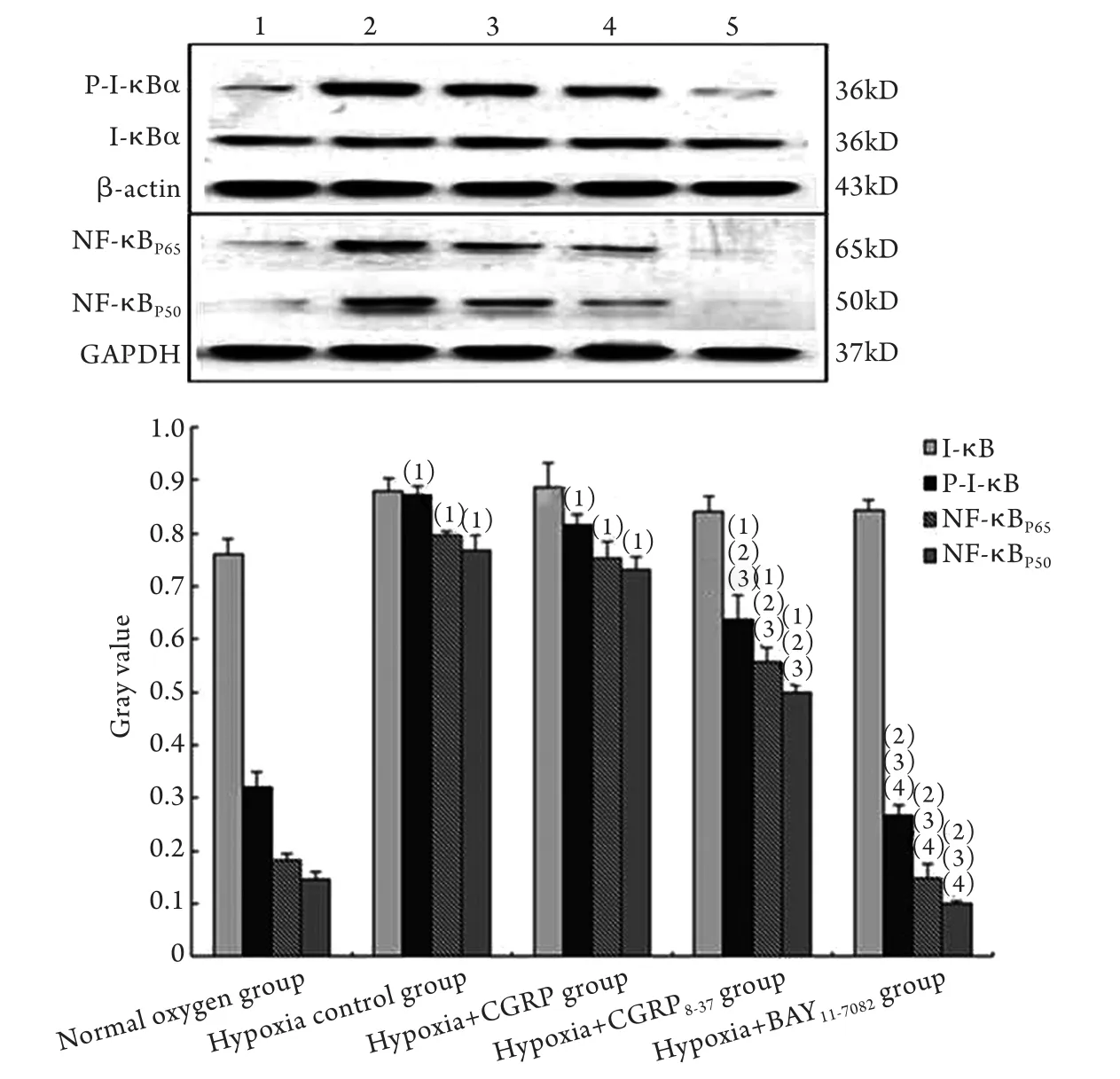
图4 Western blotting法检测CGRP对NF-κB信号通道蛋白的影响Fig.4 Effect of CGRP on NF-κB signal channel protein (Western blotting)(1)P<0.05 compared with normal oxygen group; (2)P<0.05 compared with hypoxia control group; (3)P<0.05 compared with hypoxia+CGRP group; (4)P<0.05 compared with hypoxia+CGRP8-37group

图5 流式细胞仪检测CGRP调节NF-κB信号通路后c-kit+CSCs存活的影响Fig.5 Influence of CGRP regulating NF-κB signal channel on c-kit+CSCs survival (Flow cytometry)Q1. Dead cells; Q2. Late apoptotic cells; Q3. Survived cell ; Q4. Early apoptotic cells. (1)P<0.05 compared with normal oxygen group; (2)P<0.05 compared with hypoxia control group; (3)P<0.05 compared with hypoxia+CGRP group
2.4 CGRP对c-kit+CSCs细胞凋亡的影响 流式细胞仪检测细胞凋亡结果(图5)显示,与常氧细胞组比较,细胞缺氧对照组心脏干细胞早、晚期凋亡率均明显增高(P<0.05),与细胞缺氧对照组比较,缺氧+CGRP组CSCs细胞早、晚期凋亡率明显降低(P<0.05),且细胞存活率升高;然而CSCs缺氧并加入CGRP受体拮抗剂(CGRP8-37)后,与缺氧+ CGRP组比较,缺氧+CGRP8-37组早期细胞凋亡增加(P<0.05),晚期细胞凋亡率差异无统计学意义(P>0.05)。
3 讨 论
在心脏干细胞移植治疗心肌梗死的过程中,最棘手的难题则是如何提高移植细胞的存活率及分化率,以减轻心肌梗死后微环境对移植细胞的损伤,并且最大限度的发挥细胞效应。Hong等[8]发现经冠脉内输注CSCs至心肌梗死小鼠心脏后的5min,不足40%的CSCs存在于心脏中,而接下来的24h内,心脏中大于85%的移植CSCs丢失,细胞移植后第7天,仅有3.56%±2.03%的细胞存活,而在移植后的35d,细胞存活率下降至2.46%±0.46%。以上结果表明心肌梗死后局部缺氧、炎症等微环境的改变对移植细胞的存活起了关键性作用。
NF-κB是炎症信号激活通路,各种促炎因子和细菌产物均可激活NF-κB信号通路,导致促炎基因的转录调控,从而促进炎症进程[10]。静息状态下NF-κB亚基p65通常与I-κB结合,覆盖p50蛋白的核定位信号,以无活性的三聚体形式存在于细胞质中。当细胞受到炎症、应激及氧化剂等刺激时,I-κB磷酸化并水解,与NF-κB解离,活化的NF-κBp65和p50亚基转位至细胞核内,启动炎性因子及凋亡基因的转录[11]。其中,p65亚基主要发挥促炎、促纤维化及凋亡作用的。Gordon等[12]证实NF-κB的激活也可引起炎性因子(TNF-α、IL-6 及ICAM-1)表达增加、促凋亡基因(Fas-L、Fas、C-mys)表达上升和抑凋亡基因(Bcl-2、Bcl-XL)表达下降。Yang等[13]发现抑制NF-κB/I-κBα/IKK信号通路后,细胞黏附分子和组织因子的表达均减少,炎症反应亦减轻。由此本实验设想,如果抑制了NF-κB信号通路,可否明显改善移植细胞不利的炎症微环境,从而增加移植细胞的存活率。Guan等[14]亦发现CGRP连接至RAMP1/CLR受体二聚体上可增加细胞cAMP水平,激活PKA,活化的PKA通过干扰I-κBα磷酸化降解来抑制NF-κB的活性,进而促进DNA连接抑制剂p50/p50二聚体形成。因此,CGRP 对NF-κB炎症通路应该是发挥抑制作用的。为了验证CGRP能否通过直接抑制NF-κB炎症通路发挥抑制细胞凋亡的作用。
本实验用细胞免疫荧光法观察NF-κBp65亚基的核转位情况,结果显示细胞缺氧后12h,激活NF-κB转录入核,当抑制缺氧细胞中的CGRP受体后,缺氧+CGRP8-37组见大量红色荧光表达,NF-κBP65转录表达增加,缺氧+CGRP组细胞核红色荧光少,NF-κBP65表达减少。用Western blotting法检测各组中NF-κB通道蛋白P-I-κB、I-κB、NF-κBP65及NF-κBP50的表达水平,得到类似结果,即,缺氧组中,P-I-κB、NF-κBP65及NF-κBP50的表达明显增加(P<0.05),提示缺氧状态下,c-kit+CSCs中的NF-κB信号通路被激活。使用CGRP处理细胞后,上述蛋白的表达明显下降,但与NF-κB抑制剂(BAY11-7082)作用的缺氧细胞比较,CGRP处理细胞后其NF-κB相关信号蛋白表达仍增加,为了进一步证实CGRP 对NF-κB信号通路的作用,在缺氧细胞中加入CGRP受体拮抗剂后,观察到NF-κB相关信号蛋白的表达接近于细胞缺氧对照组,以上结果表明,虽然CGRP对NF-κB通道的抑制作用较NF-κB抑制剂低,但CGRP能明显抑制NF-κB信号转录。
结合以上实验结果,可以初步认为,在c-kit+CSCs中,CGRP能够抑制P-I-κB、NF-κBP65和NF-κBP50的表达,干扰NF-κB亚基发生核转位,对炎症通路NF-κB信号通路有着明确的抑制作用。那么,CGRP是否通过抑制NF-κB信号通路增加c-kit+CSCs的抗凋亡能力呢?流式细胞仪结果显示,与常氧CSCs比较,细胞缺氧对照组细胞早、晚期凋亡率均增高。在缺氧细胞中加入CGRP干预后,与细胞缺氧对照组比较,其细胞早期和晚期凋亡率均降低,但拮抗CGRP作用后,细胞凋亡率明显增高。本实验初步观察到了CGRP对细胞凋亡的作用,结合上述研究结果,CGRP能明显抑制NF-κB信号转录,由此推断CGRP可能通过调节NF-κB信号通路来调节c-kit+CSCs细胞凋亡。本课题组下一步将研究干扰NF-κB信号通道后CGRP对c-kit+CSCs细胞凋亡的影响,以期为CGRP通过调节NF-κB信号通路抑制细胞凋亡提供更有力的证据。
[1]Li ZQ, Zhang WW. Development and application of new stem cells[J]. Chin J Pract Intern Med, 2011, 31(10): 750-752. [李占全, 张薇薇. 新型干细胞的研发及应用进展[J]. 中国实用内科杂志, 2011, 31(10): 750-752.]
[2]Zhao Y, Li T, Wei X,et al. Mesenchymal stem cell transplantation improves regional cardiac remodeling following ovine infarction[J]. Stem Cells Transl Med, 2012, 1(9): 685-695.
[3]Go AS, Mozaffarian D, Roger VL,et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association[J]. Circulation, 2014, 129(3): 399-410.
[4]Shi B, Liu ZJ, Zhao RZ,et al. Effect of mesenchymal stem cells on heart function and restenosis of injured artery after myocardial infarction[J]. Natl Med J China, 2011, 91(32): 2269-2273. [石蓓, 刘志江, 赵然尊, 等. 骨髓间充质干细胞移植对心肌梗死后心脏功能及损伤血管再狭窄的影响[J]. 中华医学杂志, 2011, 91(32): 2269-2273.]
[5]Wang G, Liu YQ, Zhang XC,et al. Study on the preparation and multipotent differentiation of c-kit-positive cardiac stem cells[J]. J Logist Univ PAPF (Med Sci), 2013, 22(11): 972-975, 1054.[王刚, 刘燕青, 张新昌, 等. 大鼠c-kit阳性心脏干细胞制备及多能分化研究[J]. 武警后勤学院学报(医学版), 2013, 22(11): 972-975, 1054.]
[6]Li QH, Guo Y,Ou QH,et al. Intracoronary administration of cardiac stem cells in mice: a new, improved technique for cell therapy in murine models[J]. Basic Res Cardiol, 2011, 106(5): 849-864.
[7]Shintani Y, Fukushima S, Varela-Carver A,et al. Donor celltype specific paracrine effects of cell transplantation for postinfarction heart failure[J]. J Mol Cell Cardiol, 2009, 47(2): 288-295.
[8]Hong KU, Guo Y, Li QH,et al. c-kit+cardiac stem cells alleviate post-myocardial infarction left ventricular dysfunction despite poor engrafment and negligible retention in the recipient heart[J]. PLoS One, 2014, 9(5): e96725.
[9]Long XP, Wang S, Zhao RZ,et al. Lentivirus-mediated calcitonin gene-related peptide transfection enhances endothelial differentiation of rat bone marrow mesenchymal stem cell[J]. Chin J Pathophysiol, 2013, 29(8): 1515-1519. [龙仙萍, 汪松,赵然尊, 等. 慢病毒介导的降钙素基因相关肽转染对大鼠骨髓间充质干细胞内皮分化的影响[J]. 中国病理生理杂志, 2013, 29(8): 1515-1519.]
[10] Yan ST, Li CL, Lu JM,et al. Expressions of NF-κB and downstream inflammatory factors in the kidney of insulin resistance rat[J]. Med J Chin PLA, 2014, 39(10): 782-786. [闫双通, 李春霖, 陆菊明, 等. NF-κB及下游炎症因子在胰岛素抵抗大鼠肾脏中的表达[J]. 解放军医学杂志, 2014, 39(10): 782-786.]
[11] Hayden MS, Ghosh S. Shared principles in NF-κB signaling[J]. Cell, 2008, 132(3): 344-362.
[12] Gordon JW, Shaw JA, Kirshenbaum LA. Multiple facets of NF-kappaB in the heart: to be or not to NF-kappa B[J]. Circ Res, 2011, 108(9): 1122-1132.
[13] Yang RC, Chang CC, Sheen JM,et al. Davallia bilabiata inhibits TNF-ɑ-induced adhesion endothelial cells[J]. Am J Chin Med, 2014, 42(6): 1411-1429.
[14] Guan H, Hou S, Ricciardi R P,et al. DNA binding of repressor nuclear factor-kappa B p50/p50 depends on phosphorylation of Ser337 by the protein kinase catalytic subunit[J]. J Biol Chem, 2005, 280(11): 9957-9962.
Effect of calcitonin gene related peptide regulated nuclear factor kappa B signal transduction on c-kit+cardiac stem cells in hypoxia state
LONG Xian-ping, ZHENG Xiao-yu, WANG Dong-mei, XU Guan-xue, ZHAO Ran-zun, SHI Bei*
Department of Cardiology, Affiliated Hospital of Zunyi Medical College, Zunyi, Guizhou 563003, China
*< class="emphasis_italic">Corresponding author, E-mail: shibei2147@163.com
, E-mail: shibei2147@163.com
This work was supported by the National Natural Science Foundation of China (NSFC81360021), and the International Cooperative Project of Guizhou Province [Qiankehewai G (2013)7037]
ObjectiveTo investigate the effects of calcitonin gene-related peptide (CGRP) on the apoptosis of c-kit+cardiac stem cells in hypoxia.MethodsIschemia and hypoxia models of c-kit+cardiac stem cells were reproducedin vitro. The models were divided into hypoxia+CGRP group, hypoxia+CGRP8-37(antagonist of CGRP) group, hypoxia control group, normal oxygen group, and hypoxia+BAY11-7082[antagonist of nuclear factor kappa B (NF-κB)] group. NF-κB translocation after hypoxia was detected by immunofluorescence, and NF-κB channel proteins were determined with Western blotting. The NF-κB translocation and the expression of NF-κB channel proteins after CGRP intervention were detected, and the cell apoptosis rate after intervention was determined with flow cytometry in each group.ResultsUnder hypoxia the NF-κB signal pathway was activated, and nuclear translocation occurred in NF-κBP65(red fluorescence). Compared with hypoxia control group, the expressions of NF-κB related proteins such as P-I-κB, NF-κBP65and NF-κBP50decreased obviously (P<0.05). Compared with the hypoxia+CGRP group, the expressions of NF-κB related proteins increased significantly (P<0.05) as mentioned above in hypoxia+CGRP8-37group. Both the early and late apoptotic rates declined in hypoxia+CGRP group compared with that of hypoxia control group (P<0.05), however, the early apoptotic rate increased markedly in hypoxia+CGRP8-37group as compared with that of hypoxia+CGRP group (P<0.05).ConclusionUnder hypoxia, CGRP may regulate the NF-κB signal pathway, and at the same time suppress the apoptosis of c-kit+cardiac stem cells.
calcitonin gene-related peptide; nuclear factor kappa B; anoxia; c-kit+cardiac stem cells; apoptosis
R363
A
0577-7402(2015)10-0782-06
10.11855/j.issn.0577-7402.2015.10.03
2015-05-22;
2015-08-05)
(责任编辑:张小利)
国家自然科学基金(81360021);贵州省国际合作项目[黔科合外G字(2013)7037号]
龙仙萍,医学硕士,副主任医师。主要从事心肌梗死后心肌细胞再生修复的基础及临床研究
563003 贵州遵义 遵义医学院附属医院心内科(龙仙萍、郑小宇、王冬梅、许官学、赵然尊、石蓓)
石蓓,E-mail:shibei2147@163.com

