橄榄石型磷酸铁锂用于锂离子电池的研究进展
严 鹏,黄 昭,吴晓燕,杨 扬,何丹农,
(1.纳米技术及应用国家工程研究中心,上海200241;2.上海交通大学材料科学与工程学院,上海200240)
橄榄石型磷酸铁锂用于锂离子电池的研究进展
严 鹏1,黄 昭2,吴晓燕1,杨 扬1,何丹农1,2
(1.纳米技术及应用国家工程研究中心,上海200241;2.上海交通大学材料科学与工程学院,上海200240)
橄榄石结构磷酸铁锂由于比容量高、安全性好、对环境无污染、原料价格低等优点,被认为是最具应用前景的锂离子电池正极材料。但是由于材料本身较低的电子电导率和锂离子扩散速率,其实际应用受到限制。着重从制备方法、改进手段等方面介绍近年来磷酸铁锂的研究进展,并分析该材料目前存在的问题及应用前景。
锂离子电池;磷酸铁锂;改性研究
锂离子电池作为当今国际公认的理想化学能源,广泛应用于手机、笔记本电脑、平板电脑等便携式电子器件中。正极材料是锂离子电池最为关键的材料,它的性能直接决定了锂离子电池性能的高低,橄榄石结构磷酸铁锂(LiFePO4)由于理论放电比容量高(170 mAh/g)、放电电压平稳(~3.4 V)、结构稳定(P-O以极强共价键结合)、安全性能好、循环寿命长、原材料来源丰富、对环境无污染,成为国内外研究的热点。该材料结构是由P占据四面体位置,过渡金属M占据八面体位置,Li原子沿[010]轴一维方向形成迁移通道,其结构示意如图1所示[1],晶胞参数a=0.601 0 nm,b=1.033 4 nm,c=0.469 3 nm,晶胞体积为0.291 4 nm3。Li+脱嵌后生成结构相似的FePO4,晶胞参数a=0.579 2 nm,b=0.982 1 nm,c=0.478 8 nm,晶胞体积为0.272 1 nm3。但LiFePO4的本征电子电导率(10-9S/cm)和锂离子的扩散速率(10-12~10-14cm2·s-1)低[2-3],导致LiFePO4放电容量低以及循环性能差,实际应用受到限制。另外,其他橄榄石结构材料LiMnPO4、LiCoPO4与LiFePO4相比,拥有较高的放电平台,分别为4.1、4.8 V,但是放电容量相对较低,在同样实验条件下(微波-水热法)制备这3种样品,LiMnPO4、LiCoPO4的实际放电容量仅为LiFePO4的1/6、1/3,在充电过程中脱锂后,分别形成Mn2P4O7和Co2P4O7,导致循环寿命缩短,且分解产生的氧气容易带来安全隐患。LiFePO4的研究主要集中在制备方法和改性研究这两块,其中制备方法包括固相法和液相法,固相法主要有高温固相法等,液相法主要有溶胶凝胶法、水热法、共沉淀法等;改性研究主要包括复合导电材料、颗粒尺寸纳米化和掺杂金属离子。本文详细介绍了LiFePO4的制备方法和改性手段,并分析了该材料目前存在的问题及应用前景。

图1 LiFePO4和FePO4结构示意图
1 磷酸铁锂的制备方法
1.1 高温固相反应法
目前工业化合成磷酸铁锂的方法主要是高温固相反应法,该方法原理简单,易操作,但是反应过程中容易产生杂质,且产物粒径分布不均匀。高温固相合成磷酸铁锂要考虑的因素主要包括:原料的选择,球磨混料的方式(球料比、球磨转速、球磨时间等),煅烧温度与时间等[4]。Shao等[5]选择 FeC2O4·2 H2O、NH4H2PO4和Li2CO3为反应物原料,6.0%(质量分数)柠檬酸为碳源,球磨混合2 h,将混合后的前驱体在700℃下煅烧20 h,得到颗粒尺寸在200~300 nm的LiFePO4。综合热分析法分析发现CA在100~400℃之间分解为CO2、CO和CHx,当温度升高到大于500℃时,CHx会分解为碳包覆在颗粒表面,形成粒径在100~200 nm之间的LiFePO4/C纳米颗粒。通过电化学性能分析,在1C、20C下放电比容量分别为153、92 mAh/g。Xia等[6]以LiCH3COO·2 H2O、(NH4)2HPO4和FeC2O4·2 H2O为原料,考察煅烧温度和混料时间对LiFePO4物理性能和电化学性能的影响,发现LiFePO4的倍率性能主要是由颗粒的比表面积决定,可以通过提高LiFePO4的比表面积,增加Li+的迁移通道来提高材料的倍率性能。测试结果表明在球磨混料12 h,煅烧温度为570℃时,LiFePO4(比表面积为24.1 m2/g)的电化学性能最佳,5C下放电比容量达到115 mAh/g。
1.2 溶胶凝胶法
溶胶凝胶法(sol-gel)具有以下独特的优点:(1)有机物在sol-gel过程中不仅作为络合剂参与反应,而且作为碳源在热处理时碳化,均匀地对LiFePO4颗粒表面进行原位包覆,形成导电网络,提高材料的电导率[7];(2)容易均匀定量地掺入一些微量元素,实现分子水平上的均匀掺杂,掺杂产生电荷缺陷,从而提高材料电子电导率[8]。
Yang等[9]选择LiH2PO4、Fe(CH3COO)3作为原料,采用solgel方法,控制形成凝胶的温度为70℃,经过24 h陈化,将得到的凝胶与石墨烯分散液混合,干燥之后得到LiFePO4/G前驱体,将前驱体在700℃高温下,氩气气氛保护持续煅烧10 h,最终得到三维多孔状结构的LiFePO4/G复合材料。通过电化学性能测试,与石墨烯复合形成的多孔电极材料具有较高的充放电容量和良好的循环性能。Zhou等[10]同样选择有机盐为原料,采用sol-gel方法,制备出三维多孔状结构的LiFePO4/CNT复合材料。由于在热处理过程中有机盐分解产生CO2、CO等气体,致使材料本身出现多孔结构,该结构的材料由于具有比较大的比表面积,不仅为Li离子和电子的传输提供通道,提高电极反应动力学,而且在充放电过程中对材料体积的变化起到缓冲作用。
1.3 水热法
水热法的主要特点是合成粒子纯度高、分散性好,且无需烧结,可以避免在烧结过程中晶粒会长大而且杂质容易混入等特点。Lu等[11]选择(NH4)2Fe(SO4)2·6 H2O、(NH4)2HPO4、LiOH和柠檬酸作为原料,温度为180℃下反应15 h,最后得到灰白色的沉淀物,经X射线衍射(XRD)分析,产物为橄榄石结构的LiFePO4。水热法首先合成类似NH4FePO·4H2O结构的前驱体,进而转变成颗粒形貌呈类“eggs”的无定型态LiFePO4。随着反应时间增加到5 h,产物形貌转变为立方形和菱形的颗粒,且产物为结晶态。在整个水热过程中柠檬酸和NH4+对颗粒的形貌起着关键作用,但是合成出来的LiFePO4颗粒在0.1C拥有较低的比容量(~150 mAh/g),充放电电压曲线极化大。Qin等[12]选择FeSO4·7 H2O、H3PO4、LiOH和抗坏血酸为原料,温度加热到100~180℃,保温0~180 min,制备出片状的LiFePO4。通过分析样品的结构与形貌,结合溶解-沉淀理论,认为水热法合成LiFePO4通常包括三个过程:第一步前驱体溶解,随着水热体系内温度、压力的增加,前驱体溶解并开始水解;第二步成核过程,溶液中[Fe(H2O)n]2+、[Li(H2O)n]+和PO43-开始反应,在一些未溶解的前驱体表面或边缘处形成LiFePO4晶核,这一过程中前驱体充当成核剂的作用;第三步核生长过程,新生成的LiFePO4晶核逐渐长大,形成具有规则形貌的LiFePO4颗粒。虽然水热法具有低成本、低能耗等优点,但是通过该方法合成出来的LiFePO4晶体存在明显的离子混排现象(图2),还需要进一步的高温热处理[13]。研究发现,在120℃水热反应体系中合成出的LiFePO4,大约有7%的铁离子占据着锂离子的位置,而锂离子在LiFePO4中的嵌入脱出过程是沿着一维(b轴)方向迁移,离子混排现象将使锂离子的迁移受阻,从而影响电极材料的电化学性能。

图2 Fe离子占据Li离子二维结构图(绿色代表Li、红色代表Fe、黄色代表P、白色代表O)
1.4 共沉淀法
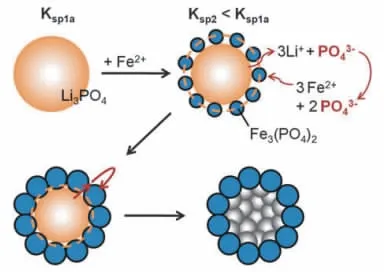
图3 添加Fe2+与PO43-(PO43-来自Li3PO4)反应生成FePO4沉淀示意图
共沉淀法的优点在于:通过溶液中的各种化学反应直接得到化学成分均一的纳米粉体材料,而且容易制备粒度小且分布均匀的纳米粉体材料。Lee等[14-15]根据沉淀物的溶解-沉淀原理(不同沉淀物具有不同的溶解平衡常数)合成LiFePO4前驱体(图3),选择H3PO4、LiOH为原料制备Li3PO4(2 Li++HPO42-→Li2HPO4,3 Li++PO43-→Li3PO4),在形成Li3PO4沉淀的溶液(含有少量Li+和PO43-)中加入FeSO4和CTAB,Fe2+与PO43-在Li3PO4颗粒表面反应形成Fe3(PO4)2。由于Li3PO4与Fe3(PO4)2之间存在明显的溶度积差(KspLi3PO4=3.2×10-9,KspFe3(PO4)2=1.0× 10-36),反应向有利于生成Fe3(PO4)2的方向进行,Li3PO4电离出的PO43-与Fe2+继续反应生成Fe3(PO4)2,当反应达到一定平衡,对混合物进行120℃水热处理,然后进一步高温热处理,得到中空的球形LiFePO4颗粒,粒径大约300 nm。中空球形纳米颗粒的独特结构缩短了Li+和e-的扩散时间,从而在大倍率充放电过程中,电极材料可以得到更高的比容量和能量密度。
2 磷酸铁锂的改性
2.1 颗粒尺寸纳米化
锂离子电池在充放电过程中伴随着锂离子的脱嵌和嵌入,LiFePO4颗粒尺寸越大,其扩散路程就越长,因此控制LiFePO4颗粒尺寸是改善锂离子电池倍率性能的关键。Gaberscek等[16]根据不同研究成果整理发现,电极材料的阻抗仅仅与电极材料的颗粒大小有关,电极的阻抗Rm跟颗粒大小d有如下关系:Rm~dn(n=1.994),且LiFePO4正极材料的放电容量损失与平均颗粒大小呈线性关系。Delacourt等[17]认为碳包覆不是保证高容量的唯一方法,纳米化的无碳包覆磷酸铁锂颗粒同样可以得到比较高的放电容量。通过直接共沉淀法合成出粒径为140 nm的磷酸铁锂颗粒,进一步在500℃进行热处理,既不会引起颗粒的生长与团聚,也不会改变颗粒表面形貌,电化学测试表明:在放电倍率为5C时放电比容量高达147 mAh/g,并且循环400次之后容量没有明显的衰减。
2.2 复合导电物质
磷酸铁锂被认为是半导体材料,颗粒与颗粒之间的电子传导受到材料本身缺陷的影响,导致性能低劣。添加导电物质,如乙炔黑、碳纳米管等,提高颗粒之间的导电性能,可逆容量能达到理论值的95%。Huang等[18]通过两种不同的实验方法制备LiFePO4/C,分别以CH3COOLi,(CH3COO)2Fe和NH4H2PO4为原料,间苯二酚-甲醛为碳源,合成LiFePO4/C复合材料,第二个实验方法是通过使用碳黑为碳源,同时作为成核剂,制备正极材料。实验结果表明碳的结构以及包覆均匀性对电子的传输起到关键的作用,有机碳源不仅在碳化之后能得到较高的电子电导率,而且容易均匀进行包覆。Wang等[19]以苯胺为碳源,在FePO4表面原位聚合一层导电聚合物聚苯胺,热处理后形成导电碳层,同时碳层限制颗粒在热处理过程中长大团聚,颗粒的尺寸保持在30 nm左右,为锂离子脱嵌/嵌入和电子的传输提供便利,电化学性能测试表明:在0.6C下放电比容量达到168 mAh/g,60C下保持在90 mAh/g。
2.3 离子掺杂
Chung等[20]首次对LiFePO4掺杂进行讨论,高价阳离子掺杂可以将磷酸铁锂的电导率提高8个数量级,且高倍率性能突出。许多研究者对其可行性提出质疑,至今关于离子掺杂机理还存在争议。但随着研究的深入,目前普遍观点认为高价阳离子(2+到5+)进入晶格内部,通过锂离子空位进行电荷补偿;掺杂离子半径小于Li+和Fe2+时,优先占据Li位。Wang等[21]对LiFePO4的Fe位进行掺杂(M=Ni,Co,Mg),未掺杂的磷酸铁锂10C下放电比容量只有54 mAh/g,而掺杂之后达到90 mAh/g,锂离子电池在充放电过程中的动力学过程主要包括锂离子和电子在体相和界面的传输,磷酸铁锂相对较差的电子电导率使得动力学过程受阻,而掺杂后电子电导率从2.2×10-9提高到2.5×10-7S/cm,Li-O键长从0.205 nm增加到0.206 nm,键能减小,从而有利于锂离子的传输与扩散。
3 结论
全球能源危机与环境污染为化学电源的开发与应用带来了前所未有的机遇与挑战,锂离子电池正极材料的开发受到众多研究人员的重视,随着锂离子电池综合性能的不断提升,相信在电动汽车和储能领域的应用会更加广泛而深入。
[1]FERGUS J W.Recent developments in cathode materials for lithium ion batteries[J].Journal of Power Sources,2010,195(4): 939-954.
[2]WHITTINGHAM M S.Lithium batteries and cathode materials[J]. Chemical Reviews,2004,104(10):4271-4302.
[3]KANG B,CEDER G.Battery materials for ultrafast charging and discharging[J].Nature,2009,458:190-193.
[4]KANG H C,JUN D K,JIN B,et al.Optimized solid-state synthesis of LiFePO4cathode materials using ball-milling[J].Journal of Power Sources,2008,179(1):340-346.
[5]ZHANG D,YU X,WANG Y,et al.Ballmilling-assisted synthesis and electrochemical performance of LiFePO4/C for lithium-ion battery adopting citric acid as carbon precursor[J].Journal of the Electrochemical Society,2009,156(10):A802-A808.
[6]XIA Y,YOSHIO M,NOGUCHI H.Improved electrochemical performance of LiFePO4by increasing its specific surface area[J]. Electrochimica Acta,2006,52(1):240-245.
[7]DOEFF M M,HU Y,MCLARNON F,et al.Effect of surface carbon structure on the electrochemical performance of LiFePO4[J]. Electrochemical and Solid-state Letters,2003,6(10):A207-A209.
[8]MA J,LI B,KANG F.Improved electrochemical performances of nanocrystalline LiFePO4/C composite cathode via V-doping and VO2(B)coating[J].Journal of Physics and Chemistry of Solids, 2012,73(12):1463-1468.
[9]YANG J,WANG J,WANG D,et al.3D porous LiFePO4/graphene hybrid cathodes with enhanced performance for Li-ion batteries[J]. Journal of Power Sources,2012,208:340-344.
[10]ZHOU Y,WANG J,HU Y,et al.A porous LiFePO4and carbon nanotube composite[J].Chemical Communications,2010,46(38): 7151-7153.
[11]LU Z,CHEN H,ROBERT R,et al.Citric acid-and ammoniummediated morphological transformations of olivine LiFePO4particles[J].Chemistry of Materials,2011,23(11):2848-2859.
[12]QIN X,WANG X,XIANG H,et al.Mechanism for hydrothermal synthesis of LiFePO4platelets as cathode material for lithium-ion batteries[J].The Journal of Physical Chemistry C,2010,114(39): 16806-16812.
[13]CHEN J,GRAETZ J.Study of antisite defects in hydrothermally prepared LiFePO4by in situ X-ray diffraction[J].ACS Applied Materials&Interfaces,2011,3(5):1380-1384.
[14]LEE M H,KIM J Y,SONG H K.A hollow sphere secondary structure of LiFePO4nanoparticles[J].Chemical Communications, 2010,46(36):6795-6797.
[15]LEE M H,KIM T H,KIM Y S,et al.Optimized evolution of asecondary structure of LiFePO4:balancing between shape and impurities[J].Journal of Materials Chemistry,2012,22(17):8228-8234.
[16]GABERSCEK M,DOMINKO R,JAMNIK J.Is small particle size more important than carbon coating?An example study on LiFePO4cathodes[J].Electrochemistry Communications,2007,9 (12):2778-2783.
[17]DELACOURT C,POIZOT P,LEVASSEUR S,et al.Size effects on carbon-free LiFePO4powders the key to superior energy density[J].Electrochemical and Solid-State Letters,2006,9(7): A352-A355.
[18]HUANG H,YIN S C,NAZAR L F.Approaching theoretical capacity of LiFePO4at room temperature at high rates[J].Electrochemical and Solid-State Letters,2001,4(10):A170-A172.
[19]WANG Y,WANG Y,HOSONO E,et al.The design of a LiFe-PO4/carbon nanocomposite with a core-shell structure and its synthesis by an in situ polymerization restriction method[J].Angewandte Chemie International Edition,2008,47(39):7461-7465.
[20]CHUNG S Y,BLOKING J T,CHIANG Y M.Electronically conductive phospho-olivines as lithium storage electrodes[J].Nature Materials,2002,1(2):123-128.
[21]WANG D,LI H,SHI S,et al.Improving the rate performance of LiFePO4by Fe-site doping[J].Electrochimica Acta,2005,50(14): 2955-2958.
Research progress of olivine lithium ion phosphate for lithium-ion battery
YAN Peng1,HUANG Zhao2,WU Xiao-yan1,YANG Yang1,HE Dan-nong1,2
(1.National Engineering Research Center for Nanotechnology,Shanghai 200241,China;2.School of Material Science and Engineering, Shanghai Jiao Tong University,Shanghai 200240,China)
Olivine structure LiFePO4is considered as the most promising cathode material due to its high specific capacity,high safety,no environmental pollution and low cost.However,its low electronic conductivity and slow lithium ion diffusion rate restrict the practical applications in powering hybrid electric vehicles (HEV) and plug-in hybrid electric vehicles (PHEV).The research progress of LiFePO4from preparation and modification methods was introduced,and some existing problems as well as application prospect were discussed.
lithium ion battery;LiFePO4;modification research
TM 912
A
1002-087 X(2015)08-1764-04
2015-01-20
国家国际科技合作专项(2012DFG11660);国家自然科学基金(21171116)
严鹏(1987—),男,江苏省人,硕士,主要研究方向为锂离子电池。
何丹农,教授,E-mail:hdn_nercn@163.com

