PAK1基因3′-UTR区荧光素酶报告基因载体的构建及鉴定
刘 伟,寇 博,贺大林,郭 鹏
(西安交通大学医学部第一附属医院泌尿外科,陕西西安 710061)
·基础研究·
PAK1基因3′-UTR区荧光素酶报告基因载体的构建及鉴定
刘 伟,寇 博,贺大林,郭 鹏
(西安交通大学医学部第一附属医院泌尿外科,陕西西安 710061)
目的 针对人p21小GTP酶活化激酶1(p21-activated kinase-1, PAK1)基因的3′端非翻译区(3′-untranslated region, 3′-UTR)构建PAK1的荧光素酶报告基因载体,并对其进行鉴定和筛选,为后续PAK1与microRNA-145(miR-145)的功能和机制研究提供实验基础。方法 用PCR法扩增出PAK1基因3′-UTR片段,经连接、酶切插入到pGL3载体上,构建了PAK1 3′-UTR荧光素酶报告基因载体。通过生物信息学方法预测miR-145可能靶向作用于PAK1基因的3′-UTR,后将上述重组质粒以及miRNA mimics(miRNA模拟物)、miRNA-Con(miRNA control,miRNA 阴性对照)瞬转到膀胱癌T24和J82细胞系中,并检测其相对荧光素酶活性。另外,利用实时定量PCR法检测不同实验组中PAK1的表达情况。结果 成功构建了重组pGL3-PAK1 3′-UTR WT质粒,并通过双酶切以及测序的方法验证所得结果的正确性。且转染pGL3-PAK1 3′-UTR WT质粒后,T24/miR-145组和J82/miR-145的相对荧光素酶活性显著低于T24/miR-con 和J82/miR-con组,差异有统计学意义(P<0.05)。 另外,通过实时定量PCR法发现, miR-145 mimics组的PAK1表达水平显著低于miR-145 con组。结论 成功构建了PAK1基因3’-UTR区荧光素酶报告载体,且miR-145能够显著降低其荧光素酶活性,提示miR-145能靶向负调控 PAK1的表达。
p21小GTP酶活化激酶1;3′端非翻译区;荧光素酶报告基因;microRNA-145;膀胱癌
近年来蛋白激酶成为肿瘤研究的热点之一,因其可影响肿瘤细胞的生长和侵袭,而作为肿瘤发生发展的一个重要生物靶点。PAK1 (p21-activated kinase-1)即p21小GTP酶活化激酶1,只在脑、肌肉等正常组织中表达,在其他组织中的表达很少[1]。但近年来多项研究报道,多种人肿瘤细胞均高表达PAK1[2],尤其是在乳腺癌和卵巢癌细胞中PAK1的表达远高于其他肿瘤细胞,且PAK1的表达与乳腺癌、卵巢癌细胞的侵袭转移呈正相关。这说明PAK1与肿瘤的侵袭转移有着紧密联系,提示PAK1在肿瘤的进展中发挥一定的作用。
miRNAs(microRNAs)是一类内源性的单链小分子 RNA,大小约为 20~25 nt,研究表明 miRNA 在各种真核细胞中广泛存在,参与生物体的生长发育、信号转导、组织分化、疾病发生等过程,还决定其他很多生物体发育和行为的变化[3]。其可通过靶向mRNA的3′端非翻译区(3′-untranslated region, 3′-UTR)调控多个癌基因并抑制其表达,从而发挥抑癌基因的功能[4]。为了探究可能参与PAK1基因调控的miRNA,本研究构建了PAK1基因3′-UTR 荧光素酶报告载体,并通过双荧光素酶报告基因系统预测相关miRNA与PAK1基因3′-UTR的生物靶向性,为接下来研究PAK1与相关miRNA的功能与作用机制奠定了实验基础。
1 材料与方法
1.1 材料 人膀胱癌细胞株T24和J82均在西安交通大学泌尿外科研究所保存;双荧光素酶报告基因检测试剂盒购自Promega公司;荧光素酶报告基因载体pGL3购自深圳华安平康公司;miRNA-NC及miRNA-145 mimics由上海吉玛制药技术有限公司合成;限制性内切酶XhoI、HindⅢ、T4连接酶,Taq酶、T-Vector、DNA纯化试剂盒,胶回收试剂盒均购自TaKaRa 公司;DH5α感受态细菌,PrimeScript RT Reagent Kit、SYBR Premix Ex Taq II均购自TaKaRa公司;总RNA抽提试剂盒RNAfast200购自上海飞捷公司;DMEM培养基购自GIBCO 公司;胎牛血清购自Hyclone及杭州四季青公司;转染试剂Lipofectamine 2000 购自Invitrogen公司;质粒提取试剂盒购自北京天根公司。
1.2 方法
1.2.1 细胞培养 人膀胱癌细胞株T24和J82为加入10%四季青胎牛血清的DMEM培养基,放置于37℃、5% CO2培养箱培养。
1.2.2 扩增PAK1 mRNA 3′-UTR序列 在NCBI(National Center of Biotechnology Information,美国国家生物技术信息中心)基因库查找PAK1 3′-UTR序列(NM_001128620.1),利用引物设计软件辅助设计合成PCR引物,用于扩增PAK1 3′-UTR序列的上游引物为5′-CACAATCTAGAGCAAATGCTAGTGCCACCAC-3′,包含XhoI酶切位点;而下游引物为5′-AAGGATCCGGTTACTGTCACAAACTGC-3′,包含HindⅢ酶切位点。预计扩增片段长度为748 bp。选取PAK1表达水平较高的对数生长期膀胱癌细胞株T24和J82,DMEM培养基常规培养,收取细胞用RNAfast200提取RNA,之后用PrimeScript RT Reagent Kit将RNA反转录成cDNA。合成的该cDNA作为模板并使用设计的引物扩增PAK1 mRNA 3′-UTR序列,扩增后PCR产物行DNA定量,于-20℃储存。
1.2.3 荧光素酶报告载体构建 PCR产物行琼脂糖凝胶电泳,通过凝胶回收试剂盒提纯并获取胶回收片段,再将其连接于T-Vector载体上,之后以低温CaCl2(氯化钙)法转化DH5α大肠杆菌感受态细菌,使用氨苄霉素进行抗药筛选,摇菌过夜后挑选单克隆菌落,后提取连接质粒和pGL3空质粒并进行XhoI、HindⅢ双酶切分析鉴定,所得产物用DNA连接酶、反应缓冲液等按一定体系进行连接,16 ℃过夜。检测重组质粒的表达情况,最后获得重组的报告基因载体pGL3-PAK1 3′-UTR WT。
1.2.4 PAK1基因3′-UTR的靶miRNA预测 采用生物信息学预测软件Targetscan (http://www.targetscan.org) 和miRBase (http://microrna.sanger.ac.uk/) 等预测与PAK1基因3′-UTR相互作用的miRNA。
1.2.5 共转染膀胱癌细胞系 转染前1 d将T24和J82细胞以相同数目接种于24孔板(细胞密度占孔底的60%~70%),并设置3个复孔。将50 μL无血清培养基与1 μL Lipofectamine 2000(脂质体2000) 混合,配制成溶液1;将50 μL无血清培养基与1 μL质粒混合,配制成溶液2;溶液1与溶液2均静置5 min,后将溶液1与溶液2混合,并加入6 μL三种不同实验组,即空白对照组、miRNA-Con组(miRNA阴性对照)、miRNA-145 mimics组(miRNA-145 模拟物),静置15 min。后将上述约100 μL的混合液逐滴加入各孔中,置于37 ℃,5%CO2孵箱培养4 h,弃去废液,换成含10%胎牛血清的DMEM培养基。
1.2.6 检测报告基因 将5×细胞裂解液(5×lysis buffer)用双蒸水稀释至1×的工作液,吸除转染各孔内的培养基,于各孔(需预先用PBS缓冲液洗涤1~2次)中加入100 μL稀释好的1×细胞裂解液,置于摇床上震荡15 min,将各孔的细胞裂解液移至新的离心管内,12 000转,离心1 min沉淀杂质。取20 μL上述细胞裂解液于不透明96孔板各孔中,加入100 μL LARⅡ检测Firefly Luciferase(萤火虫荧光素酶)活性,后加入100 μL Stop&Glo试剂检测Renilla Luciferase(海肾荧光素酶)活性,并计算两者比值,同时以空载体pGL3作为对照, 从而判断荧光素酶活性。
1.2.7 miR-con或miR-145 mimics瞬时转染膀胱癌细胞系 将T24和J82细胞接种于24孔板中,待细胞密度长至孔底的60%左右,通过Lipofectamine 2000(脂质体2000)转染miR-con或miR-145 mimics至上述两种膀胱癌T24和J82细胞系中,分别获得T24/miR-con、T24/miR-145、J82/miR-con、J82/miR-145。
1.2.8 实时定量PCR检测PAK1的表达 通过实时定量PCR检测不同实验组(T24/miR-con、T24/miR-145、J82/miR-con、J82/miR-145)中PAK1的表达情况。利用Trizol(一种新型总RNA抽提试剂)提取不同实验组细胞的总mRNA,经过反转录合成cDNA,后通过SYBR Premix Ex Taq Ⅱ行PCR检测PAK1的表达水平。其中PAK1的上游引物为5′-CAGCCCCTCCGATGAGAAATA-3′;下游引物为5′- CAAAACCGACATGAATTGTGTGT-3′;用作内参的GAPDH,其上游引物为5′-GGAGCGAGATCCCTCCAAAAT-3′; 下游引物为5′- GGCTGTTGTCATACTTCTCATGG-3′。
1.3 统计学分析 采用SPSS 17.0 软件进行t检验,所得结果用均值±标准差来表示。当P值小于0.05,评定为有统计学意义。
2 结 果
2.1 与PAK1基因3′-UTR有靶向作用的miRNA 通过miRBase和Targetscan软件预测, miRNA-145 可与PAK1基因3′-UTR 互补配对(图1)。

图1 软件预测miRNA-145与PAK1 基因3′-UTR 互补配对
2.2 PAK1基因3′-UTR荧光素酶报告载体的构建 通过PCR扩增PAK1 3′-UTR(片段长度为748 bp),所得产物于1%琼脂糖凝胶上跑胶(图2)。 PCR产物经连接、转化、抗药筛选、双酶切等一系列过程,将酶切产物进行跑胶(图3)并送公司测序鉴定,最终获得所需的重组载体质粒(图4)。

图2 PAK1 基因3′-UTR PCR扩增产物
2.3 miR-145靶向负调控PAK1基因的3′-UTR 通过共转染膀胱癌细胞系T24和J82, 我们检测了不同实验组的双荧光素酶活性。转染pGL3-PAK1 3′-UTR WT质粒后,T24/miR-145组的相对荧光素酶活性较T24/miR-con组显著降低(图5A),差异有统计学意义(P<0.05),同样的结果见于J82细胞系中(图5B)。
2.4 实时定量PCR检测PAK1的表达 实时定量PCR检测发现,瞬转miR-145 mimics的T24和J82细胞系,其PAK1 mRNA的表达水平比瞬转miR-145 control组降低一倍以上(图6)。
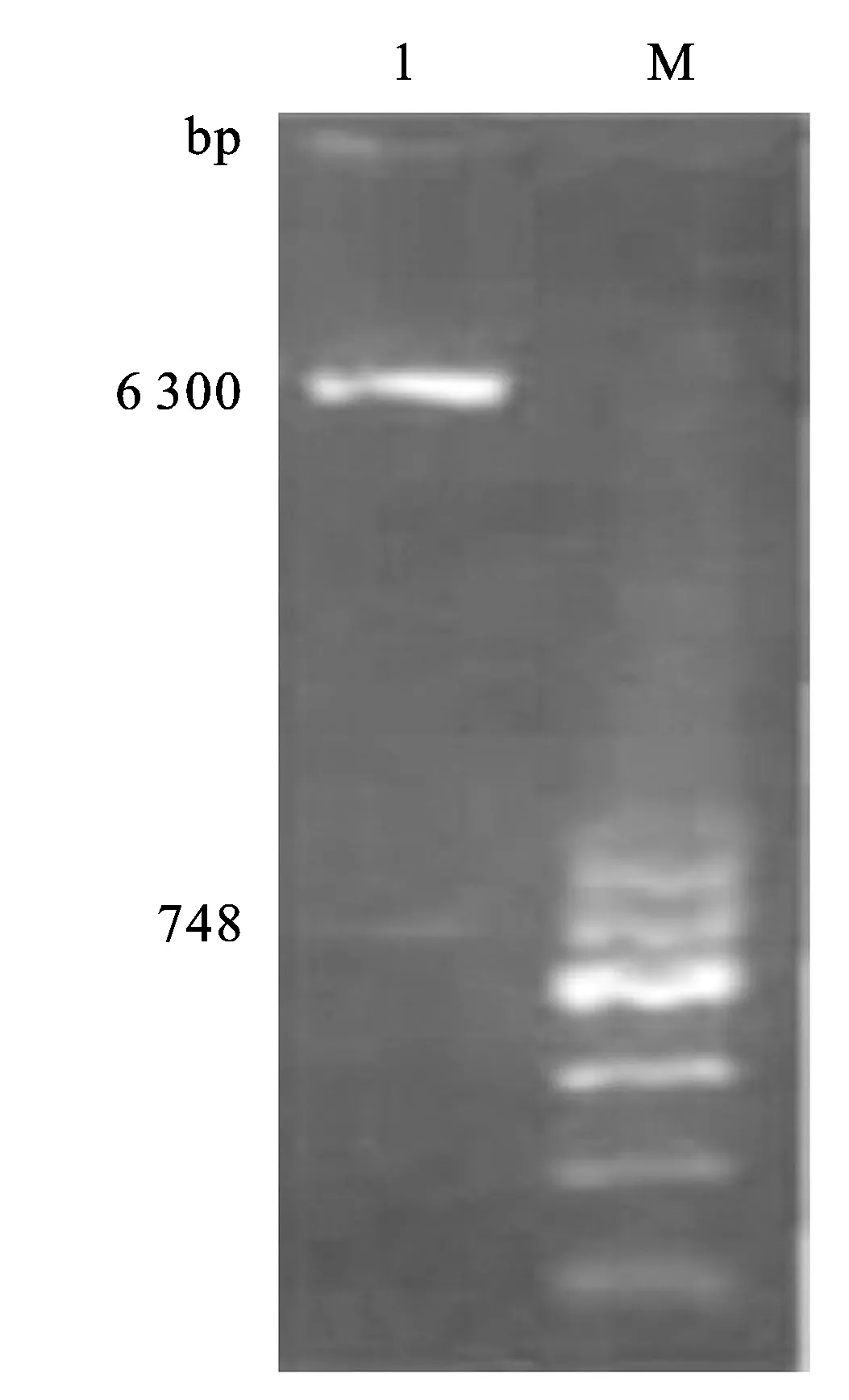
图3 pGL3-PAK1 3′-UTR WT重组质粒双酶切产物电泳图

图4 pGL3-PAK1 3′-UTR WT质粒测序图谱

图5 不同实验组的相对荧光素酶活性
A:为T24细胞系中不同实验处理组;B:为J82细胞系中不同实验处理组;Vehicle:空白对照组;miR-con:阴性对照组;miR-145:miR-145 mimics处理组。

图6 实时定量PCR检测转染miR-145 mimics后PAK1 mRNA水平
3 讨 论
p21-activated kinase-1(PAK1)即p21小GTP酶活化激酶1,是第一个被克隆和验证的的丝氨酸/苏氨酸蛋白质磷酸化激酶家族成员。PAK1作为PAK家族中的一员,其与肿瘤的关系较为密切,在修复细胞骨架、延长细胞的寿命以及调节部分正常的生理代谢等多个方面都有着重要的作用[5]。尽管PAK1仅在脑、肌肉、脾脏等少数组织中表达,然而其在多种人类肿瘤细胞内均有高表达,且PAK1的表达与乳腺癌、卵巢癌细胞的侵袭转移呈正相关。此外,PAK1还能调控BAD(Bcl-2家族同源蛋白中的一种,可以促进凋亡)的活性。在大肠癌的研究中,PAKs的两个亚群均可以促使细胞内肌动蛋白的重新形成。比如PAK1可以促进片状伪足的形成,且还能定位于成纤维细胞的膜皱褶上[6]。研究表明,经过免疫组化和多元分析表明,PAK1基因表达统计学与膀胱移行细胞癌复发的危险性具有相关性[7]。高PAK1蛋白表达的是一个独立的膀胱移行细胞癌复发相关因素[8]。
在正常情况下, 多种组织中存在miR-145的广泛表达[9]。2003年MICHEAL等[10]学者发现在结肠肿瘤中miR-145的表达呈下调趋势,认为miR-145可能与结肠肿瘤的发生存在密切关系。CHIYOMARU等[11]学者后来发现miR-145位于人类第5号染色体(5q32~33),而SACHDEVA等学者证实,miR-145对肿瘤细胞生长的抑制作用具有一定的细胞特异性:在具有一定转移能力的乳腺癌细胞中,miR-145对癌细胞生长的抑制作用显著减弱,但能显著地抑制此类细胞的侵袭转移能力。这些研究均提示miR-145可能在肿瘤的侵袭转移过程中发挥重要作用,但miR-145在膀胱癌中的具体作用和机制尚不清楚。通过双荧光素酶报告基因检测得出miR-145可靶向于PAK1的3′非翻译区,这有助于我们进一步探究miR-145在膀胱癌发生发展中所扮演的作用,同时这也为膀胱癌的临床治疗用药提供了一定的理论依据。
总而言之,本研究通过构建PAK1基因3′-UTR荧光素酶报告载体,初步证实了miR-145能够靶向作用于PAK1的3′-UTR,这为后续miR-145和PAK1的功能及机制研究打下了夯实的基础。
[1] MOLLI PR, LI DQ, MURRAY BW, et al. PAK signaling in oncogenesis [J]. Oncogene, 2009,28(28): 2545-2555.
[2] ESWARAN J, LI DQ, SHAN A, et al. Molecular pathways: targeting p21-activated kinase 1 signaling in cancer-opportunities, challenges, and limitations[J]. Clin Cancer Res, 2012, 18(14): 3743-3749.
[3] AMBROS V. The functions of animal microRNAs[J]. Nature, 2004,431(7006): 350-355.
[4] KASINSKI AL, SLACK FJ.Epigenetics and genetics. MicroRNAs en route to the clinic: progress in validating and targeting microRNAs for cancer therapy[J]. Nat Rev Cancer, 2011,11(12): 849-864.
[5] DUMMLER B, OHSHIRO K, KUMAR R,et al. Pak protein kinases and their role in cancer[J]. Cancer Metastasis Rev,2009, 28(1-2): 51-63.
[6] YANG Z, RAYALA S, NGUYEN D, et al. Pak1 phosphorylation of snail, a master regulator of epithelial-to-mesenchyme transition, modulates snail’s subcellular localization and functions[J]. Cancer Res,2005,65(8): 3179-3184.
[7] ITO M, NISHIYAMA H, KAWANISHI H, et al. P21-activated kinase 1: a new molecular marker for intravesical recurrence after transurethral resection of bladder cancer [J]. J Urol, 2007, 178(3): 1073-1079.
[8] KAMAI T, SHIRATAKI H, NAKANISHI K, et al. Increased Rac1 activity and Pak1 overexpression are associated with lymphovascular invasion and lymph node metastasis of upper urinary tract cancer [J]. BMC Cancer, 2010, 10:164.
[9] SACHDEVA M, MO YY. MiR-145-mediated suppresion of cell growth, invasion and metastasis [J]. Am J Transl Res, 2010, 2(2): 170-180.
[10] MICHEAL MZ, O’ CONNOR SM, VAN HOLST PEELLEKAAN NG, et al. Reduced accumulation of specific microRNAs in colorectal neoplasis[J].Mol Cancer Res,2003,12(1):882-891.
[11] CHIYOMARU T, ENOKIDA H, TATARANO S, et al. MiR-145 and miR-133a function as tumour suppressors and directly regulates FSCN1 expression in bladder cancer [J]. Br J Cancer, 2010,102(5): 883-891.
(编辑 王 玮)
Construction of PAK1 3′-UTR luciferase reporter vector and identification of its activity
LIU Wei, KOU Bo, HE Da-lin, GUO Peng
(Department of Urology,the First Affiliated Hospital of Xi’an Jiaotong University Health Science center, Xi’an 710061, China)
Objective To construct the luciferase reporter gene vector containing 3′-untranslated region (3′-UTR) of p21-activated kinase-1 (PAK1), which will provide basis for subsequent function and mechanism research on PAK1 and microRNA-145. Methods The 3′-UTR of PAK1 gene was amplified by PCR, and inserted into pGL3 control reporter vector after link and restriction enzyme digestion. It was predicted by bioinformation method that miR-145 could target the 3′-UTR of PAK1. The recombinant plasmid with microRNA mimics or microRNA control were transfected into T24 or J82 cells using Lipofectamine 2000 to detect the relative luciferase activity. In addition, the expression of PAK1 was analysed by real-time PCR. Results The recombinant plasmid was constructed and confirmed by enzyme digestion and sequence reaction. After transfection with the plasmid pGL3-PAK1 3′-UTR WT, we found that compared with T24 or J82 cells treated with miRNA con, the luciferase activity of T24 or J82 cells transfected with miRNA mimics was significantly decreased with statistic significance. Futhermore, the expression of PAK1 in miR-145 mimics group was remarkably lower than that in miR-145 control group. Conclusions The PAK1 3′-UTR luciferase reporter vector was constructed successfully, and the luciferase activity of the recombinant plasmid could be dramatically reduced by miR-145. It indicated that miR-145 could downregulates PAK1 expression by targeting its 3′-UTR.
p21-activated kinase-1; 3′-untranslated region; luciferase reporter gene; microRNA-145; bladder cancer
2014-12-29
2015-03-04
国家自然科学基金项目(No.81372279)
贺大林,教授.E-mail:hedl@mail.xjtu.edu.cn; 郭鹏,教授.E-mail:guopeng661@mail.xjtu.edu.cn
刘伟(1988-),男(汉族),在读博士研究生.E-mail:lizhang1988617@163.com。 寇博(1984-),女(汉族),博士.E-mail:492526094@qq.com.系共同第一作者。
R737.14
A
10.3969/j.issn.1009-8291.2015.06.015

