α1受体阻滞剂治疗男性神经原性膀胱逼尿肌尿道外括约肌功能失调的临床研究
陈 晖,蒋重和,汤 平,欧汝彪,曾健文,邓向荣 ,周理林,黄马平,李青青 ,刘秋玲,黄杰滨,谢克基
(1.广东省工伤康复中心泌尿外科, 广东广州 510440;2. 暨南大学附属广东省清远市人民医院泌尿外科,广东清远 511500;3.广州医科大学附属广州市第一人民医院泌尿外科, 广东广州 510180)
·临床研究·
α1受体阻滞剂治疗男性神经原性膀胱逼尿肌尿道外括约肌功能失调的临床研究
陈 晖1,蒋重和2,汤 平3,欧汝彪3,曾健文2,邓向荣3,周理林2,黄马平1,李青青1,刘秋玲1,黄杰滨1,谢克基3
(1.广东省工伤康复中心泌尿外科, 广东广州 510440;2. 暨南大学附属广东省清远市人民医院泌尿外科,广东清远 511500;3.广州医科大学附属广州市第一人民医院泌尿外科, 广东广州 510180)
目的 探讨α1受体阻滞剂治疗男性神经原性逼尿肌尿道外括约肌功能失调 (NDSD) 疗效和安全性。方法 采用前瞻性、多中心、单盲、随机对照的试验方法,2012年6月~2014年10月男性神经原性逼尿肌尿道外括约肌功能失调患者,分为实验组和对照组,实验组予患者口服盐酸坦索罗辛缓释胶囊0.2 mg/d,对照组予安慰剂治疗,观察服药后4周和12周的泌尿生殖系困扰调查的 6 项短表(UDI-6)、平均膀胱剩余尿量(PVR)、间歇导尿(IC)患者例数、平均每日IC次数,服药后12周平均最大尿流率(Qmax)、平均最大尿流率时膀胱逼尿肌压力(Pdet.Qmax)、平均最大尿道闭合压(MUCP),并记录相关不良事件。采用SPSS 13.0统计学软件。计量资料采用t检验,计数资料采用卡方检验。结果 入选患者94例,88例患者完成试验(实验组46例,对照组42例)。实验组和对照组的基线数据比较差异无统计学意义(P>0.05)。服药后4和12周实验组和对照组间UDI-6、PVR、IC患者例数、平均每日IC次、Qmax、Pdet.Qmax和MUCP比较差异均有统计学意义(P<0.05)。服药后4和12周实验组UDI-6、PVR、IC患者例数、平均每日IC次、Qmax、Pdet.Qmax和MUCP和基线值比较差异也均有统计学意义(P<0.05)。结论 α1受体阻滞剂能改善男性NDSD排尿,提高患者生命质量。
α1受体阻滞剂;神经原性逼尿肌尿道外括约肌功能失调;疗效;安全性
神经系统损伤如脊髓损伤和脑血管意外会导致膀胱和∕或尿道功能障碍(即储尿和∕或排尿功能障碍),继而引起一系列下尿路症状及并发症[1]。其中,膀胱逼尿肌尿道外括约肌功能失调(detrusor sphincter dyssynergia,DSD)指尿动力学检查示排尿期膀胱逼尿肌收缩时尿道外括约肌同时不自主收缩或痉挛,其易导致慢性尿潴留、膀胱输尿管返流、肾积液、上尿路感染、肾功能不全等病理生理变化,损害患者生活质量、社交和劳动能力,甚至威胁患者生命,并增加经济负担[2-3]。目前,研究证实α1肾上腺素能受体拮抗剂能降低膀胱颈和前列腺尿道阻力[4]。迄今已有研究采用α1受体阻断剂治疗神经源性膀胱排空患者,虽取得了初步结果,但例数少且为单中心研究[5]。α1受体阻断剂治疗治疗DSD的疗效和安全性仍需进一步的研究。
广东省工伤康复医院、广州市第一人民医院、广东省清远市人民医院3家医院泌尿外科于2012年6月至2014年10月联合进行前瞻性、多中心、单盲、临床随机对照试验,探讨采用α1受体阻滞剂治疗NDSD的疗效和安全性,现报道如下。
1 对象与方法
1.1 入选和排除标准 入选标准:①年龄>18岁;②有神经系统损伤病史;③尿动力学检查提示DSD;④愿意接受自家间歇导尿;⑤签署知情同意书;排除标准:①病程<3个月;②尿道狭窄,下尿路器质性梗阻,急性泌尿系感染;③服用α受体激动剂;④ 严重肝肾功能障碍的患者;⑤体位性低血压患者;⑥有全身系统性疾病;⑦拒绝签署知情同意书者。
1.2 患者分组 本研究设计为前瞻性、单盲、随机、安慰剂对照的多中心临床试验。研究方案经参与研究的三家医院伦理委员会批准。为了尽可能排除入选人群偏倚,本研究入选患者均为男性患者。按1∶1的比例将入选患者随机分为试验组和对照组。
1.3 治疗方法 试验组口服α1受体阻滞剂盐酸坦索罗辛缓释胶囊0.2 mg/d,对照组口服安慰剂,疗程3个月。
1.4 疗效评估 3个单位各自分别指派1位不参与病例筛选及治疗的泌尿外科医师单独进行研究结果评估。①疗效指标:治疗后4周、12周的泌尿生殖系困扰调查的 6 项短表(urogenital distress inventory 6-item short form,UDI-6)、平均膀胱剩余尿量(postvoid residual,PVR)、间歇导尿(intermittent catheter,IC)患者例数和平均每日IC次数,治疗后12周尿流动力学检查平均最大尿流率(maximal flow rate,Qmax)、平均最大尿流率时膀胱逼尿肌压力(detrusor pressure at maximal flow rate,Pdet.Qmax)、平均最大尿道闭合压力(maximal urethral close pressure,MUCP)。②安全性指标:不良事件发生率。本研究截点是为服药后12周,但12周后仍继续随访。
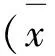
2 结 果
共入选患者94例,6例患者因联络方式改变失访。最终88例患者完成试验,其中试验组46例,对照组42例。入选两组患者的年龄、神经损伤病程、UDI-6、PVR、IC患者例数、平均每日IC次数、Qmax、Pdet.Qmax和MUCP等基线数据比较差异无统计学意义(P>0.05, 表1)。
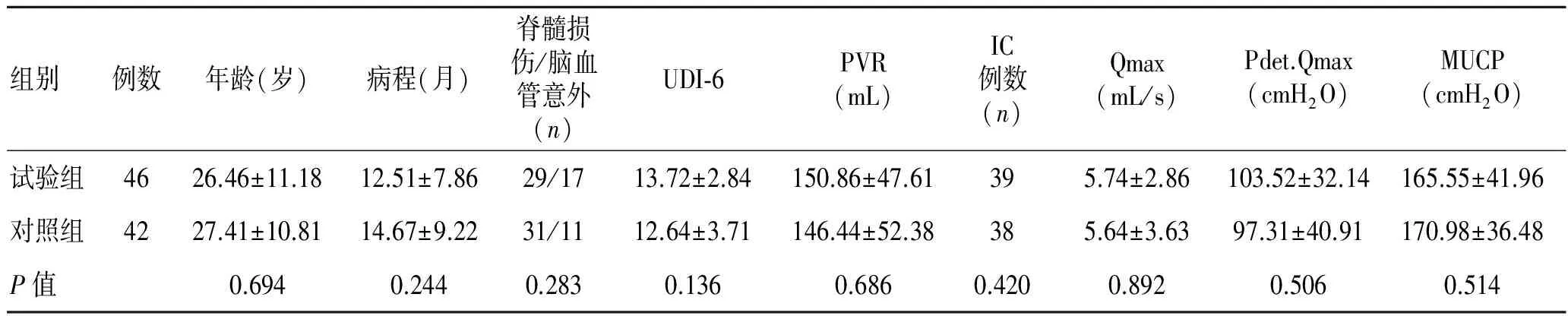
表1 两组间基线数据比较
UDI-6:泌尿生殖系困扰调查的 6 项短表;PVR:膀胱剩余尿量;IC:间歇导尿;Qmax:最大尿流率;Pdet.Qmax:最大尿流率时膀胱逼尿肌压;MUCP:最大尿道闭合压力。
服药后4、12周,两组症状指标UDI-6、PVR、IC患者例数 、平均每日IC次数相比较,差异均有统计学意义。服药后12周,试验组和对照组Qmax 、Pdet.Qmax、MUCP比较差异有统计学意义(表2)。与本组基线值比较,服药后12周,试验组和对照组UDI-6、PVR、IC患者例数、平均每日IC次数、Qmax、Pdet.Qmax和MUCP比较差异均有统计学意义(P<0.05,表2、表3)。

表2 服药后4、12周两组症状指标比较
UDI-6:泌尿生殖系困扰调查的 6 项短表;PVR:膀胱剩余尿量;IC:间歇导尿。与基线值比较,*P<0.05。
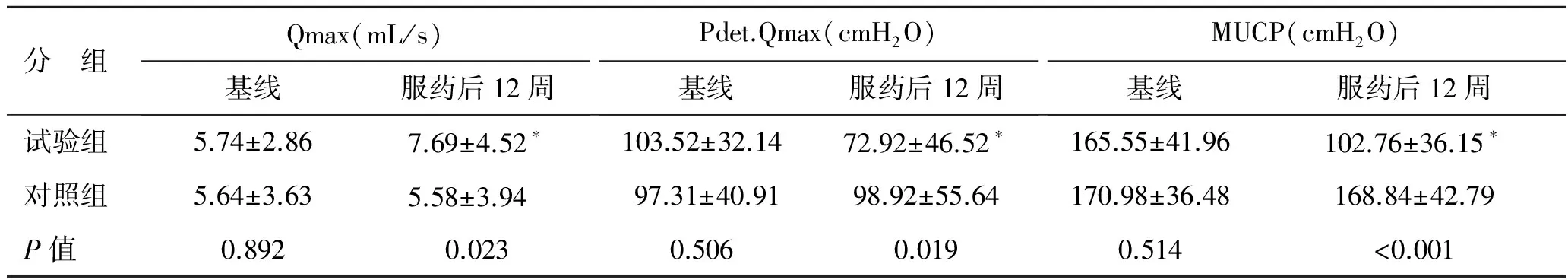
表3 服药后12周两组间尿动力学指标比较
Qmax:最大尿流率;Pdet.Qmax:最大尿流率时逼尿肌压力;MUCP:最大尿道闭合压。与基线值比较,*P<0.05。1 cmH2O=0.133 kPa
服药后第5周和第7周,3例患者(试验组1例,对照组2例)出现尿路感染,均表现为发热(体温>39℃)、血尿及尿培养(细菌菌落>105/mL),考虑与试验用药无关,依据尿培养结果选择敏感抗生素对症治疗后,症状缓解继续完成试验。
3 讨 论
神经原性下尿路功能障碍的首要治疗目标是确保储尿期和排尿期膀胱逼尿肌压力处于安全范围内从而最大程度保护患者肾脏功能[1,6]。
本研究示,服药后12周,试验组和对照组间Pdet.Qmax比较差异有统计学意义(P=0.019),且试验组较基线减少29.56%(P<0.05)。其原因在于,试验组MUCP较基线下降37.93%。基础研究已证实,α1肾上腺素能受体广泛的分布于人膀胱底、膀胱颈、后尿道,因此α1肾上腺素能受体拮抗剂可通过降低膀胱颈部及尿道前列腺的平滑肌张力,减小排尿期尿道不自主收缩引起的膀胱出口阻力,从而显著改善排尿期膀胱逼尿肌压力[4,7]。国内李东等[5]在101例神经源性膀胱排空障碍患者中应用α-1肾上腺素能受体阻滞剂,服药3月后,患者平均最大尿道压力从69.20 cmH2O(1 cmH2O=0.133 kPa) 下降到57.18 cmH2O,平均膀胱颈开放程度从6 mm 增加到7.67 mm。
神经原性下尿路功能障碍的次要治疗目标是尽可能提高患者生命质量[5]。本研究发现服药后12周试验组UDI-6由治疗前的13.72降低至9.37(P<0.05),其原因在于:①试验组患者Qmax较基线增加33.97%,而PVR减少34.10%;②试验组中13例(28.26%)已不需间歇导尿,而26例需要间歇导尿的患者平均每日导尿次数由4.68下降至3.43,减少26.71%。这些患者较治疗前明显减少担心排尿困难对其行为的限制、心理的影响以及社会障碍。
CARIGA等[8]报道高达57.1%的脊髓损伤患者慢性期出现体位性血压,且多见于胸6脊髓水平以上损伤为主,主要原因是高位脊髓损伤引起神经传导通路中断,导致血压调节机制紊乱。本研究中无患者出现体位性低血压,一方面可能与入组病例的特征有关系(仅4例胸6脊髓水平以上脊髓损伤患者);另一方面可能由于医嘱脊髓损伤患者在准备站立或起床时动作缓慢,并密切监测血压。服药后4~8周3例(试验组1例,对照组2例)出现尿路感染,均表现为发热(体温>39℃)、血尿及尿培养(+),故考虑与试验用药无关,依据尿培养结果选择敏感抗生素对症治疗后,症状缓解均完成试验。
综上所述,本研究显示,α1受体阻滞剂能降低NDSD的排尿期膀胱逼尿肌压力,改善排尿障碍,提高患者生命质量。
[1] 那彦群,叶章群,孙颖浩等. 中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2014.287-288.
[2] ABRAMS P, CARDOZO L, FALL M,et al. The standardization of terminology in lower urinary tract function: report from the standardisation sub-committee of the International Continence Society[J]. Urology, 2003,61(1):37-49.
[3] SCHAFER W, ABRAMS P, LIAO L, et al.Good urodynamic practices: uroflowmetry, filling cystometry,and pressure-flow studies. Neurourol Urodyn,2002,21(3):261.
[4] KAPLAN SA. Effects of intrathecal injection of tamsulosin and naftopidil,alpha-1A and 1D adrenergic receptor antagonists, on bladder activity in rats[J]. J Urol. 2003,169(4):1621-1622.
[5] 李东,廖利民,胡洋,等. 应用α受体阻断剂治疗神经源性膀胱排空患者的疗效和安全性[J]. 第三军医大学学报, 2009, 31(19):1839-1842.
[6] STÖHRER M, BLOK B, CASTRO-DIAZ D, et al.EAU guidelines on neurogenic lower urinary tract dysfunction[J]. Eur Urol, 2009, 56(1):81-88.
[7] NAGASE K, ITO H, AOKI Y, et al. Co-administration of an α(1) -blocker improves the efficacy and safety of antimuscarinic agents in rats with detrusor overactivity[J]. Int J Urol. 2011,18(12):836-843.
[8] CARIGA P,AHMED S,MATHIAS CJ. The prevalence and association of neck (coat-hanger) pain and orthostatic (postural) hypotension in human spinal cord injury[J]. Spinal cord, 2002,40(2): 77-82.
(编辑 王 玮)
Clinical effect of alpha-1 adrenoceptor blocker on neurologic detrusor sphincter dyssynergia
CHEN Hui1, JIANG Chong-he2, TANG Ping3,OU Ru-biao3, ZENG Jian-wen2, DENG Xiang-rong3, ZHOU Li-lin2, HUANG Ma-ping1, LI Qing-qing1, LIU Qiu-ling1, HUANG Jie-bin1, XIE Ke-ji3
(1.Department of Urology, Guangdong Provincial Work Injury Rehabilitation Hospital, Guangzhou 510440;2.Department of Urology, People's Hospital of Qingyan City, Jinan University, Qingyan 511500;3. Department of Urology, Guangzhou First Municipal People’s Hospital, Guangzhou 510180,China)
Objective To evaluate the efficacy and safety of alpha-1 adrenoceptor blocker for neurologic detrusor sphincter dyssynergia (NDSD). Methods A prospective, multicenter, single-blind and randomized controlled trial was conducted during Jun. 2012 and Oct. 2014. Patients with NDSD were recruited and randomly divided into experimental group and control group. The experimental group
tamsulosin 0.2 mg/d, while the control group took placebo. Indexes including UDI-6, PVR, IC cases, frequency of IC, Qmax, Pdet.Qmax and MUCP were tested. Related adverse events were recorded. Data collected were analyzed with SPSS 13.0 software,t-test and chi-squared method. Results A total of 94 patients were recruited and 86 of them completed the trail (46 cases in experimental group, 42 in control group). There were no significant differences in baseline evaluation items between the two groups (P>0.05). In week 4 and 12 during follow-up, there were significant differences in UDI-6, PVR, IC cases, frequency of IC, Qmax, Pdet.Qmax and MUCP between the two groups (P<0.05). In week 12, all outcomes improved significantly compared to baseline in the experimental group (P<0.05). Conclusions Alpha-1 adrenoceptor blocker is effective and safe for patients with NDSD. It can improve patients’ urination and quality of life.
Alpha-1 adrenoceptor blocker;neurologic detrusor sphincter dyssynergia; efficacy; safety
2015-02-14
2015-03-19
广东省科技计划项目(No.2012B031800007);广东省医学科研基金项目(No.A2013477)
谢克基,主任医师. E-mail: xiekeji@sina.com
陈晖(1977-),男(汉族),博士,副主任医师.研究方向:神经泌尿.E-mail: doc.chenhui@163.com
R69
A
10.3969/j.issn.1009-8291.2015.06.003

