TGF-β1促进食管癌上皮间质转化的发生发展
王 栋, 刘 清, 郑树涛, 刘 涛, 戴 芳, 杨晨晨, 卢晓梅, 买买提艾力·吾马尔
(1新疆医科大学, 乌鲁木齐 830011, 2新疆医科大学第一附属医院临床医学研究院;3新疆维吾尔自治区食管癌研究所, 乌鲁木齐 830054)
TGF-β1促进食管癌上皮间质转化的发生发展
王 栋1,2, 刘 清2, 郑树涛2, 刘 涛2, 戴 芳2, 杨晨晨1, 卢晓梅3, 买买提艾力·吾马尔1
(1新疆医科大学, 乌鲁木齐 830011,2新疆医科大学第一附属医院临床医学研究院;3新疆维吾尔自治区食管癌研究所, 乌鲁木齐 830054)
目的 探讨转化生长因子(TGF-β1)在促进食管癌Eca109细胞增殖、迁移、侵袭和上皮间质转化中的作用。方法 利用TGF-β1受体抑制剂和病毒转染TGF-β1 干扰RNA(siRNA)处理Eca109细胞,分为3组:实验组(病毒稳定TGF-β1 siRNA转染Eca109细胞)、阴性对照组(转染无关序列Eca109细胞)、空白对照组(正常未经任何处理的Eca109细胞),采用荧光定量PCR(qRT-PCR)技术检测TGF-β1及上皮间质转化(EMT)相关指标E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、锌指转录因子(Snail)]在mRNA水平表达情况;EMT相关指标蛋白(E-cadherin、Vimentin)的表达;细胞增殖实验(MTT)、细胞划痕实验及Transwell法分别检测细胞增殖、迁移、侵袭的变化情况。结果 通过TGF-β1受体抑制剂(0、0.1、1、10 μm/mL)处理Eca109细胞后,在mRNA水平TGF-β1表达逐渐降低, E-cadherin表达逐渐升高,Vimentin、Snail表达逐渐降低(P<0.05);在蛋白水平,E-cadherin表达逐渐升高,Vimentin表达逐渐降低,细胞增殖和迁移能力也逐渐降低(P<0.05)。实验组与空白对照组和阴性对照组相比,在mRNA水平实验组TGF-β1表达降低(P<0.05);在蛋白水平,实验组E-cadherin表达增高,Vimentin表达降低;实验组细胞增殖、迁移和侵袭能力均降低(P<0.05)。结论 在细胞水平,TGF-β1可促进食管癌细胞的增殖和上皮间质转化的进程。
转化生长因子(TGF-β1);食管鳞癌;RNA干扰(RNAi); 细胞增殖;上皮间质转化(EMT)
食管癌是我国最高发的恶性肿瘤之一,世界范围内食管鳞癌占所有食管癌的90%[1]。食管癌发病呈明显的地区差异,新疆是其高发区[2]。食管癌病程进展快,早期不易被发现,但较早发生邻近组织和远端组织的转移,以及对周围组织的侵袭,大部分病人就诊时病变已处于中晚期,造成其生存率普遍很低,其中75%的病人生存期少于1 a,癌的浸润转移是病人死亡的主要原因。上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞通过特定程序丧失上皮表型而转化为具有间质表型细胞的生物学过程,与肿瘤细胞的原位侵袭和远处转移有着密切的关系[3-4]。转化生子因子(TGF-β1)是调节肿瘤EMT的关键因子。本研究在细胞水平通过mRNA、蛋白、细胞功能学等实验探讨TGF-β1在促进食管癌Eca109细胞增殖、侵袭、迁移和上皮间质转化中的作用。
1 材料与方法
1.1 材料RPMI-1640培养基、胰蛋白酶、胎牛血清(美国Gibco公司),DMSO(美国Invitrogen公司),慢病毒TGF-β1及阴性对照病毒(上海吉凯公司),食管鳞癌细胞系Eca109(武汉大学细胞库)。TRizol试剂(invitrogen), 反转录试剂盒(thermo),SYBRⅡ荧光试剂盒(Takara),BCA蛋定量白试剂盒,Vimentin抗体(Santa Cruz),E-cadherin抗体及GAPDH抗体(Santa Cruz),transwell小室(Corning Costar, 8 μm)。
1.2 方法
1.2.1 细胞培养 食管鳞癌细胞系Eca109用含10%胎牛血清的RPMI1640培养液正常培养,用0.25%胰蛋白酶消化液消化处于对数生长期的细胞。细胞均在37℃、5%CO2、饱和湿度条件下孵育。
1.2.2 TGF-β1抑制剂处理Eca109细胞 将正常Eca109细胞消化收集细胞沉淀,用含有1%胎牛血清的RPMI-1640培养液重悬,6孔板每孔接种细胞3×105个细胞,分为4组,每组做3个复孔,分别用TGF-β1受体抑制剂0、0.1、1、10 μmol/mL处理Eca109细胞48 h,用含有1%胎牛血清的RPMI-1640培养液在37℃、5%CO2、饱和湿度条件下孵育。
1.2.3 TGF-β siRNA病毒转染Eca109细胞 将正常Eca109细胞消化收集细胞沉淀,用含有10%胎牛血清的RPMI-1640培养液重悬,分为3组:空白对照组(正常未经过任何处理的Eca109细胞)、阴性对照组(转染随机序列)和实验组(转染TFG-β1 siRNA),每组设3个复孔。转染48 h后细胞消化收集做流式分选,将分选收集的细胞重新种板培养。
1.2.4 实时荧光定量聚合酶联反应(qRT-PCR) 将收集的Eca109细胞同TRizol试剂处理提取总RNA,用反转录试剂盒中的Random Primer和Oligdt primer分别反转录总RNA为cDNA,SYBRⅡ荧光试剂盒对反转录的cDNA做RT-PCR,反应条件:初始变性,95℃反应10 min;变性,95℃反应15 s;退火,55℃(β-actin)、57℃(Vimentin)、59℃(TGF-β)、62℃(E-cadherin、Snail)反应30 s;延伸,72℃反应30 s,3个步骤共进行40个循环。β-actin作为mRNA的内参,结果用log10(2-ΔΔCt)法进行相对定量比较,每组实验重复3次,反转录及qRT-PCR所用引物序列见表1。

表1 反转录及qRT-PCR所用引物序列表
1.2.5 Western blot测定EMT相关蛋白的表达 测定蛋白浓度(BCA蛋定量白试剂盒)并调整蛋白上样量为50 μg/孔。电泳,转膜,封闭1 h,加入Vimentin抗体、E-cadherin抗体及GAPDH抗体。4℃摇床孵育过夜。加入二抗孵育2 h,化学试剂发光法(ECL)显色。
1.2.6 MTT细胞增殖实验 每孔接种3×103个对数生长期的Eca109细胞于96孔板中,每孔200 μL细胞悬液,每组设4个复孔,分别于孵育0、24、48、72、96 h后,加入5 mg/mL的MTT溶液20 μL,置于37℃、5%CO2、饱和湿度条件下孵育4 h,弃去上清液,加入150 μL的DMSO(二甲基亚砜),充分震荡混匀后,用酶标仪测490 nm处吸光度值。
1.2.7 细胞划痕实验 6孔板每孔接种5×105个细胞,过夜铺满6孔板,用10 μL无菌枪头在每孔底部轻划1条粗细均匀、力度和角度一致的直线。分别于0、24、48、72 h在倒置显微镜下的同一视野观察划痕宽度并拍照。
1.2.8 细胞侵袭实验 取24孔板,下室加入500 μL含10%胎牛血清的RPMI1640培养液,每组细胞按3×105个用无血清RPMI1640培养基混匀接种于transwell小室上室,置于37℃、体积分数5%CO2培养箱孵育48 h后,用棉签擦去上室内未迁移的细胞,4%多聚甲醛固定2 min,甲醇固定30 min,结晶紫染色30 min,PBS清洗,在200倍视野下观察,每一样本随机选取5个视野,计数每个视野下染色细胞数量,取平均值。

2 结果
2.1 用TGF-β1受体抑制剂抑制Eca109细胞后TGF-β1及EMT相关指标mRNA的表达随着TGF-β1受体抑制剂浓度的提高,TGF-β1表达量逐渐降低, EMT相关指标E-cadherin表达量逐渐升高,Vimentin、snail表达量逐渐降低,各组比较差异有统计学意义(P<0.05)(图1)。
2.2 用TGF-β1受体抑制剂抑制Eca109细胞后EMT相关指标蛋白的表达分别用TGF-β1受体抑制剂0、0.1、1、10 μm/mL处理Eca109细胞48 h后,用Western blot检测各组细胞Vimentin、E-cadherin、GAPDH蛋白的表达。抑制TGF-β1受体后能够降低间质标志物Vimentin的表达,增加上皮标志物E-cadherin的表达,从而延缓EMT的进程(图2)。
2.3 MTT检测TGF-β1受体抑制剂抑制Eca109细胞后细胞增殖能力变化随着TGF-β1抑制剂的浓度提高,Eca109细胞增殖能力减缓,与0 h相比,差异有统计学意义(P<0.05)(图3)。

与TGF-β1受体抑制剂0μm/mL比较,*P<0.05。
图1 用TGF-β1受体抑制剂0、0.1、1、10 μm/mL处理Eca109细胞TGF-β、E-caherin、Vimentin、Snail的mRNA相对表达量
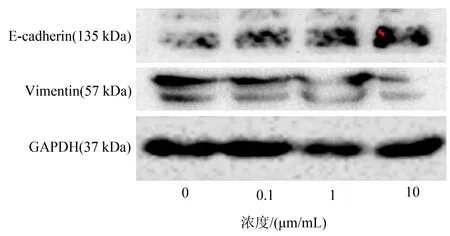
图2 Western blot检测TGF-β1受体抑制剂梯度抑制Eca109细胞后EMT相关蛋白的表达

图3 TGF-β1受体抑制剂0、0.1、1、10 μm/mL处理Eca109细胞的细胞增殖曲线
2.4 细胞划痕检测TGF-β1受体抑制剂抑制Eca109细胞后细胞迁移能力变化随着TGF-β1受体抑制剂浓度的提高,细胞迁移速度显著减慢,72 h后阴性对照组细胞划痕宽度明显减小(P<0.05) (图4)。
2.5 荧光检测Eca109细胞转染TGF-β1 siRNA效果荧光倒置显微镜下观察见绿色荧光在细胞内广泛表达,TGF-β1 siRNA转染效果良好(图5)。
2.6 稳定转染TGF-β1 siRNA后Eca109细胞中TGF-β1的mRNA表达实验TGF-β1 mRNA表达量明显降低,差异有统计学意义(P<0.05)。而阴性对照组和空白对照组比较差异无统计学意义(P>0.05)(图6)。
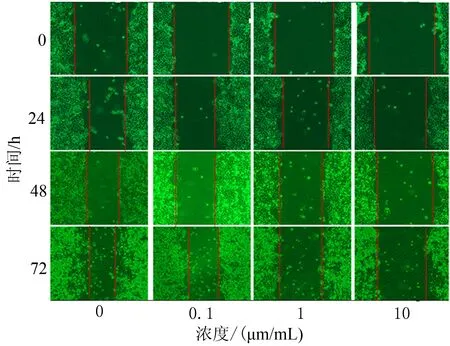
图4 TGF-β1受体抑制剂0、0.1、1、10 μm/mL处理Eca109细胞的细胞迁移能力比较(×100)

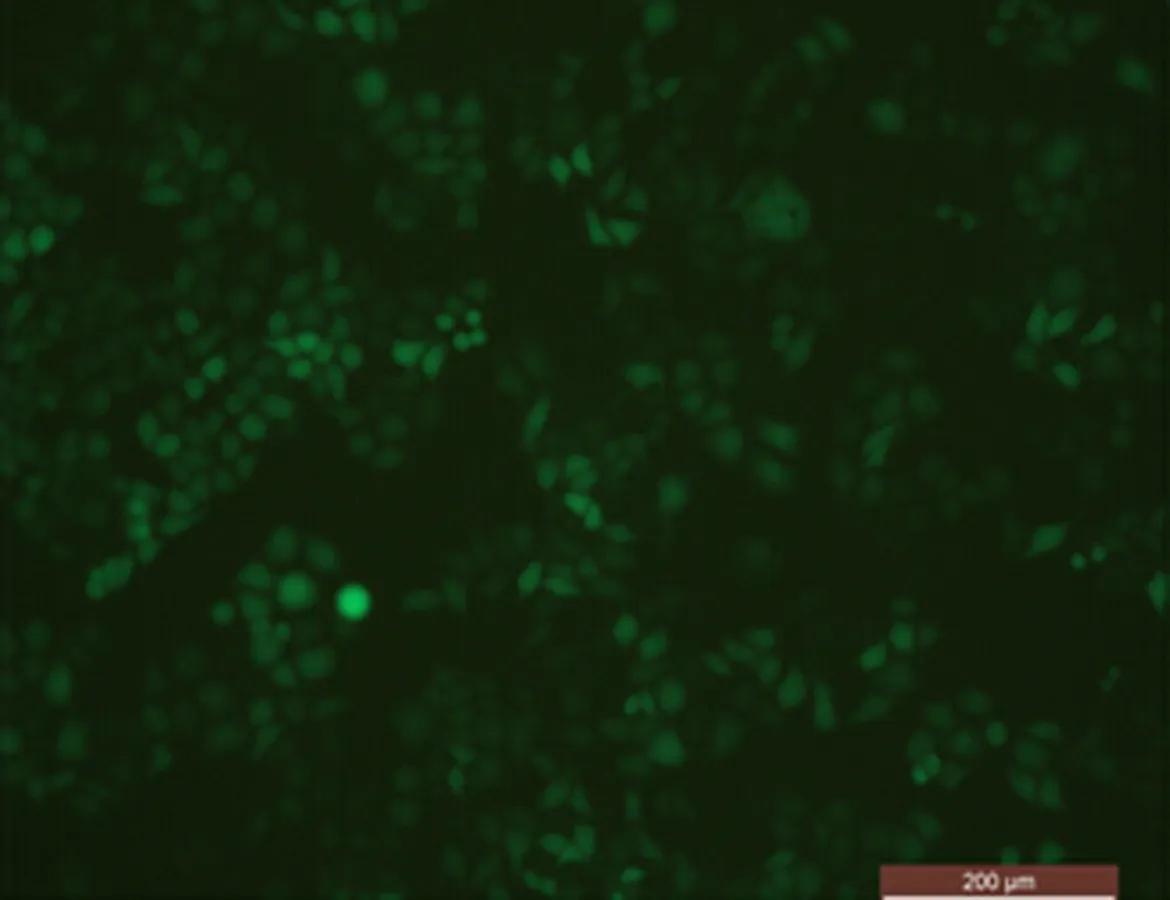
图5 TGF-β1 siRNA转染Eca109细胞

图6 稳定转染后Eca109细胞TGF-β1 mRNA相对表达量
2.7 稳定转染TGF-β1 siRNA后Eca109细胞中EMT相关蛋白的表达实验组E-cadherin蛋白表达量明显高于阴性对照组和空白对照组,而Vimentin表达量明显低于阴性对照组和空白对照组(图7)。

图7 Western blot检测稳转TGF-β1 siRNA后Eca109细胞的EMT相关蛋白的表达
2.8 MTT检测稳定转染TGF-β1 siRNA的Eca109的细胞增殖能力实验组增殖能力显著低于阴性对照组和空白对照组,72、96 h时间段组间比较,差异有统计学意义(P<0.05),而空白对照组和阴性对照组细胞增殖能力差异无统计学意义(P>0.05)(图8)。

图8 MTT实验检测稳转TGF-β1 siRNA的Eca109细胞增殖能力
2.9 细胞划痕实验检测TGF-β1 siRNA后Eca109的细胞迁移能力实验组细胞的划痕愈合能力明显低于空白对照组及阴性对照组,差异有统计学意义(P<0.05)。而空白对照组与阴性对照组差异无统计学意义(P>0.05) (图9)。

图9 稳转TGF-β1 siRNA实验组与空白对照组和阴性对照组的细胞迁移能力试验
2.10 Transwell侵袭实验检测稳转TGF-β1 siRNA的Eca109的细胞侵袭能力实验组细胞侵袭能力显著小于空白对照组及阴性对照组(P<0.05)。而空白对照组与阴性对照组比较差异无统计学意义(P>0.05)(图10)。
3 讨论
食管鳞癌是我国常见的恶性肿瘤之一。大部分病人在就诊时已处于食管癌晚期,出现了浸润和转移,因此从分子水平研究食管癌发生浸润、转移的生物学原理更为重要。EMT是多细胞生物胚胎发生、发展中的重要过程,以间质特征的获得及其上皮细胞极性的丧失为主要特征,在肿瘤的侵袭和远处转移过程中发挥了重要的作用。许多相关EMT相关因子如血管生成因子、细胞生长因子等在肿瘤早期促进了EMT的发展。许多研究证实TGF-β1作为生长因子的一种可通过多种途径促进EMT的进程。已有研究表明TGF-β通过经典的TGF-β/Smad途径诱导多种基因如HMGA2[5]、Ets1[6]等促进EMT的发展,除了Smads,TGF-β还可介导其他信号通路调节EMT,包括Erk、PI3K-Akt、RhoA、cofilin等[7-8]。

a:细胞侵袭实验图示结果(100×)

b: 100倍视野下细胞计数结果
本研究首先在细胞水平探讨了TGF-β1生长因子与食管鳞癌的EMT的相关性,进而利用慢病毒转染的方法干扰TGF-β1的表达后,分别从EMT相关蛋白表达变化以及细胞增殖、细胞迁移、细胞侵袭等方面,从分子水平和细胞功能方面探讨了TGF-β1与EMT的关系,以期为进一步深入研究食管癌浸润转移机制提供理论基础。
在癌症的浸润、转移过程中,TGF-β1具有两面性,在癌症早期可起到抑癌作用。Kang等[9]研究表明TGF-β可通过Smad通路抑制乳腺的骨转移; Padua等[10]研究表明TGF-β可通过诱导ANGPTL4的分泌促进乳腺癌细胞向肺部转移,Gao等[11]研究表明TGF-β可通过抑制BMP的表达促进乳腺癌往远处的定植转移,而起到促进EMT的致癌作用。本研究首先从TGF-β1受体方面证明了抑制TGF-β1受体后能够抑制食管癌的增殖和迁移,并且抑制EMT的发展进程。进而从细胞内干扰TGF-β1的表达后,再次从细胞内证明TGF-β1可以促进食管鳞癌细胞的增殖、迁移、侵袭,促进食管鳞癌发生EMT。
综上所述,在细胞水平,TGF-β1在食管癌的发生、发展中起到了重要的作用,促进食管鳞癌发生EMT,进一步促进食管癌细胞的增殖、迁移和侵袭。本研究有待在组织水平和动物水平实验进行进一步验证。深入研究EMT对食管癌发生、发展过程中的作用机制,对于寻找食管癌浸润、转移的阻断治疗靶点具有重要的意义。
[1] Rustgi AK, El-Serag HB. Esophageal carcinoma[J].N Engl J Med,2014,371(26):2499-2509.
[2] 周脉耕, 王晓风, 胡建平, 等. 2004-2005年中国主要恶性肿瘤死亡的地理分布特点[J]. 中华预防医学杂志,2010,44(4):303-308.
[3] Huber MA, Kraut N, Beug H. Molecular requirements for epithelial-mesenchymal transition during tumor progression[J]. Curr Opin Cell Biol,2005,17(5):548-558.
[4] Fernando RI, Litzinger M, Trono P,et al. The T-box transcription factor Brachyury promotes epithelial-mesenchymal transition in human tumor cells[J]. J Clin Invest, 2010,120(2):533-544.
[5] Thuault S, Valcourt U, Petersen M, et al. Transforming growth factor-beta employs HMGA2 to elicit epithelial-mesenchymal transition[J]. J Cell Biol, 2006,174(2):175-183.
[6] Shirakihara T, Saitoh M, Miyazono K. Differential regulation of epithelial and mesenchymal markers by deltaEF1 proteins in epithelial mesenchymal transition induced by TGF-beta[J]. Mol Biol Cell, 2007,18(9):3533-3544.
[7] Yang J, Weinberg RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008,14(6):818-829.
[8] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014,15(3):178-196.
[9] Kang Y, He W, Tulley S, et al. Breast cancer bone metastasis mediated by the Smad tumor suppressor pathway[J]. Proc Natl Acad Sci U S A, 2005,102(39):13909-13914.
[10] Padua D, Zhang XH, Wang Q, et al. TGFbeta primes breast tumors for lung metastasis seeding through angiopoietin-like 4[J]. Cell, 2008,133(1):66-77.
[11] Gao H, Chakraborty G, Lee-Lim AP, et al. The BMP inhibitor Coco reactivates breast cancer cells at lung metastatic sites[J]. Cell, 2012,150(4):764-779.
(本文编辑 杨晨晨)
TGF-β1 promotes esophageal cancer Epithelial-Mesenchymal-Transition process
WANG Dong1,2, LIU Qing2, ZHENG Shutao2, LIU Tao2, DAI Fang2, YANG Chenchen1,LU Xiaomei3, Maimaitiaili Wumaer1
(1XinjiangMedicalUniversity,Urumqi830011,China;2ClinicalMedicalResearchInstitute,theFirstAffiliatedHospitalofXinjiangMedicalUniversity;3EsophagealCancerResearchInstituteofXinjiangUygurAutonomousRegin,Urumqi830054,China)
Objective To investigate whether TGF-β1 could promote cell proliferation, migration, invasion and epithelial-mesenchymal-transition (EMT) process in Eca109. Methods With stimulation of TGF-β1 receptor inhibitor, the expression of TGF-β1 and EMT-associated mRNAs were detected by qRT-PCR; the expression of EMT-associated proteins were detected by western blot. Then TGF-β1 siRNA was transfected into Eca109 cells by lentiviral vector, the expression level of TGF-β1 was detected by qRT-PCR, EMT-associated proteins were measured by western blot after transfection. MTT, Wound-healing assay and transwell assay were performed to detect cell proliferation, migration and invasion ability. Results Treatment of TGF-β1 receptor inhibitor, TGF-β1 and Vimentin, Snail mRNA were significantly decreased, while the expression of E-cadherin mRNA was increased (P<0.05).EMT-associatedproteinscouldinducethedown-regulationofVimentinexpressionandup-regulatetheE-cadherinexpression.AftertransfectedwithTGF-β1siRNA,themRNAexpressionofTGF-β1andtheproteinexpressionofVimentinweredown-regulated(P<0.05),whiletheproteinexpressionofE-cadherinwasup-regulated.Furthermore,treatmentofTGF-β1receptorinhibitororTGF-β1siRNAinhibitedcellmigration,proliferationandinvasionability.ConclusionThesedatasuggestthatTGF-β1promotesesophagealcancerepithelial-mesenchymal-transitionprocess.
TGF-β1;ESCC;RNAi;cell proliferation; epithelial-mesenchymal-transition (EMT)
国家自然科学基金(81160303,81260359、U1303321); 新疆维吾尔自治区重大科技专项计划(201430123-1)
王 栋(1989-),男,在读硕士,研究方向:肿瘤分子病理学。
买买提艾力·吾马尔,男(维吾尔族),副教授,研究方向:消化道肿瘤的转化医学研究,E-mail: dashu_0@qq.com。 卢晓梅,女,博士,教授,研究员,博士生导师,研究方向:消化道肿瘤的转化医学研究,E-mail:luxiaomei88@163.com。
R34;R
A
1009-5551(2015)12-1471-05
10.3969/j.issn.1009-5551.2015.12.003
2015-08-30]

