异氟烷对创伤性脑损伤大鼠的神经保护作用及作用机制研究
张 睿,杨祖悌,张同寅,宋海军,王 斌
·论著·
异氟烷对创伤性脑损伤大鼠的神经保护作用及作用机制研究
张 睿,杨祖悌,张同寅,宋海军,王 斌
目的 探讨异氟烷对创伤性脑损伤大鼠的神经保护作用及作用机制。方法 选择成年健康雄性SD大鼠80只,采用随机数字表法分为假手术组、脑损伤组、异氟烷预处理组和异氟烷后处理组,每组20只。采用改良Feeney自由落体法制作大鼠创伤性脑损伤模型,假手术组大鼠仅做开窗手术处理,异氟烷预处理组大鼠在造模前给予异氟烷持续麻醉,脑损伤组和异氟烷后处理组大鼠造模成功后立即进行复苏,且异氟烷后处理组大鼠于复苏后给予异氟烷持续麻醉。采用神经功能缺损评分表(NSS)评定各组大鼠创伤性脑损伤后12 h、24 h神经功能缺损情况,免疫印迹法检测各组大鼠创伤性脑损伤后24 h损伤灶周围脑组织磷酸化Akt(P-Akt)、磷酸化糖原合酶激酶-3β(P-GSK3β)、Bcl-2、cleaved-caspase-3蛋白表达量,TUNEL法检测各组大鼠创伤性脑损伤后24 h损伤灶周围脑组织凋亡神经元数量。结果 脑损伤组大鼠创伤性脑损伤后12 h、24 h NSS评分高于假手术组、异氟烷预处理组及异氟烷后处理组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后12 h、24 h NSS评分高于假手术组(P<0.05)。脑损伤组、异氟烷预处理组及异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-Akt蛋白和P-GSK3β蛋白表达量高于假手术组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-AktA蛋白和P-GSK3β蛋白表达量高于脑损伤组(P<0.05)。脑损伤组大鼠创伤性脑损伤后24 h损伤灶周围脑组织Bcl-2蛋白表达量低于假手术组、异氟烷预处理组及异氟烷后处理组,cleaved-caspase-3蛋白表达量及凋亡神经元数量高于假手术组、异氟烷预处理组及异氟烷后处理组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织cleaved-caspase-3蛋白表达量、凋亡神经元数量高于假手术组(P<0.05)。结论 异氟烷对创伤性脑损伤大鼠具有神经保护作用,其可能通过激活Akt/GSK3β信号通路而发挥神经保护作用。
脑损伤;异氟烷;大鼠
创伤性脑损伤在世界范围内具有较高的发生率、致死率和致残率,会给社会和家庭带来沉重的经济负担,但目前临床上尚缺乏治疗创伤性脑损伤的有效药物[1]。创伤性脑损伤主要包括原发性脑损伤和继发性脑损伤,其中原发性脑损伤是指暴力作用于头部后立即发生的脑损伤;继发性脑损伤是原发性脑损伤发生后数小时至数天发生的脑损伤,目前有效治疗继发性脑损伤是创伤性脑损伤研究的热点[2]。大量研究发现,异氟烷在脑缺血再灌注损伤和蛛网膜下腔出血导致的脑损伤中具有明显的神经保护作用[3-4]。本研究通过探讨异氟烷对创伤性脑损伤大鼠的神经保护作用及作用机制,旨在为创伤性脑损伤的治疗提供实验依据。
1 材料与方法
1.1 实验动物与试剂 选择成年健康雄性SD大鼠80只,体质量230~260 g,周龄7~8周,由河南大学实验动物中心提供。主要试剂:异氟烷(由美国Baxter公司提供,产品批号GG522),磷酸化Akt(P-Akt)、磷酸化糖原合酶激酶-3β(P-GSK3β)、Bcl-2、cleaved-caspase-3、β-actin(1∶1 000)均购自美国cell signaling公司,TUNEL检测试剂盒购自美国罗氏生物公司,蛋白提取试剂盒购自南通碧云天生物公司。
1.2 分组及试验方法 采用随机数字表法将大鼠分为假手术组、脑损伤组、异氟烷预处理组和异氟烷后处理组,每组20只,实验过程中出现死亡大鼠应及时补齐。假手术组大鼠仅做开窗处理;异氟烷预处理组大鼠在造模前12 h给予2%异氟烷持续麻醉60 min;脑损伤组和异氟烷后处理组大鼠造模成功后立即进行复苏,异氟烷后处理组大鼠于造模后10 min通过气管插管使用2%异氟烷持续麻醉60 min。
1.3 模型制备 采用改良Feeney自由落体法[5]制备大鼠创伤性脑损伤模型:将大鼠用纯氧和2%异氟烷麻醉后固定于立体定向支架上,备皮消毒后于大鼠冠状缝中线右侧3 mm、矢状缝后3 mm处使用骨科钻做直径为5 mm的骨窗,保持硬脑膜的完整,40 g重物自15 cm高处自由落体垂直撞击于右侧硬脑膜垫上,致伤深度为3 mm,直径为4 mm。
1.4 观察指标 比较各组大鼠创伤性脑损伤后12 h、24 h神经功能评分,创伤性脑损伤后24 h损伤灶周围脑组织P-Akt、P-GSK3β、Bcl-2、cleaved-caspase-3蛋白表达量及凋亡神经元数量。
1.4.1 神经功能评分 采用神经功能缺损评分表(neurological severity scores,NSS)评定创伤性脑损伤大鼠神经功能[6],主要内容包括运动功能、感觉功能、平衡能力、生理反射缺陷和异常运动,最高分18分,不能执行任务或缺乏相应反应者计为1分,其中1~6分为轻度损伤、7~12分为中度损伤、13~18分为重度损伤。
1.4.2 免疫印迹法检测蛋白表达量 创伤性脑损伤后24 h,每组取10只SD大鼠使用2%异氟烷麻醉后,经心尖灌注0.9%氯化钠溶液100 ml,取损伤灶周围脑组织放入-80 ℃冰箱中保存备用。取损伤灶周围脑组织100 mg加入蛋白裂解液,比例为每20 mg脑组织加150~250 μl裂解液,用玻璃匀浆器充分匀浆至完全裂解后,4 ℃恒温离心机14 000×g离心10 min,取上清液后,采用Bradford法进行蛋白定量检测,按1∶4的比例加入5×loading沸水中煮10 min进行蛋白变性,按每孔加入35 μg蛋白,电泳、转膜后封闭1 h,加入P-Akt、P-GSK3β、Bcl-2、cleaved-caspase-3、β-actin一抗稀释液,4 ℃摇床过夜,加入二抗后,洗膜,滴加ECL显影液,Image J软件进行灰度分析,记录P-Akt、P-GSK3β、Bcl-2、cleaved-caspase-3蛋白表达量。
1.4.3 TUNEL法检测细胞凋亡情况 创伤性脑损伤后24 h,每组取10只SD大鼠使用2%异氟烷麻醉后,经左心尖灌注0.9%氯化钠溶液100 ml和10%多聚甲醛,断头取脑后,采用石蜡常规包埋脑组织,使用切片机将石蜡包埋的脑组织切成4 μm切片,采用TUNEL法检测凋亡神经元数量,操作步骤按照TUNEL检测试剂盒说明书和以往文献进行[7]。计数方法:细胞核呈现棕黄色为TUNEL阳性细胞,在光学显微镜下观察损伤灶周围脑组织TUNEL阳性细胞个数,在400倍镜下随机选取10个视野,将TUNEL阳性细胞的平均数作为最终结果。
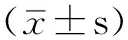
2 结果
2.1 4组大鼠创伤性脑损伤后神经功能评分比较 本研究共使用88只雄性SD大鼠,假手术组未出现死亡,模型组死亡3只,异氟烷预处理组死亡2只,异氟烷后处理组死亡3只。4组大鼠创伤性脑损伤后12 h、24 h NSS评分比较,差异有统计学意义(P<0.05)。脑损伤组大鼠创伤性脑损伤后12 h、24 h NSS评分高于假手术组、异氟烷预处理组及异氟烷后处理组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后12 h、24 h NSS评分高于假手术组,差异有统计学意义(P<0.05,见表1)。
Table 1 Comparison of NSS score after 12 hours and 24 hours of traumatic brain injury among the four groups of rats

组别只数创伤性脑损伤后12h创伤性脑损伤后24h假手术组201.20±0.021.20±0.02脑损伤组2015.03±3.98a15.12±4.01a异氟烷预处理组2012.58±3.41ab12.39±3.13ab异氟烷后处理组2012.67±3.07ab12.51±3.31abH值83.8083.47P值0.000.00
注:与假手术组比较,aP<0.05;与脑损伤组比较,bP<0.05
2.2 4组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-Akt蛋白和P-GSK3β蛋白表达量比较 4组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-Akt蛋白和P-GSK3β蛋白表达量比较,差异有统计学意义(P<0.05)。脑损伤组、异氟烷预处理组及异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-Akt蛋白和P-GSK3β蛋白表达量高于假手术组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织P-AktA蛋白和P-GSK3β蛋白表达量高于脑损伤组,差异有统计学意义(P<0.05,见表2、图1)。
2.3 4组大鼠创伤性脑损伤后24 h损伤灶周围脑组织Bcl-2、cleaved-caspase-3蛋白表达量及凋亡神经元数量比较 4组大鼠创伤性脑损伤后24 h损伤灶周围脑组织Bcl-2、cleaved-caspase-3蛋白表达量及凋亡神经元数量比较,差异有统计学意义(P<0.05)。脑损伤组大鼠创伤性脑损伤后24 h损伤灶周围脑组织Bcl-2蛋白表达量低于假手术组、异氟烷预处理组及异氟烷后处理组,cleaved-caspase-3蛋白表达量及凋亡神经元数量高于假手术组、异氟烷预处理组及异氟烷后处理组,异氟烷预处理组和异氟烷后处理组大鼠创伤性脑损伤后24 h损伤灶周围脑组织cleaved-caspase-3蛋白表达量、凋亡神经元数量高于假手术组,差异有统计学意义(P<0.05,见表3、图1、图2)。
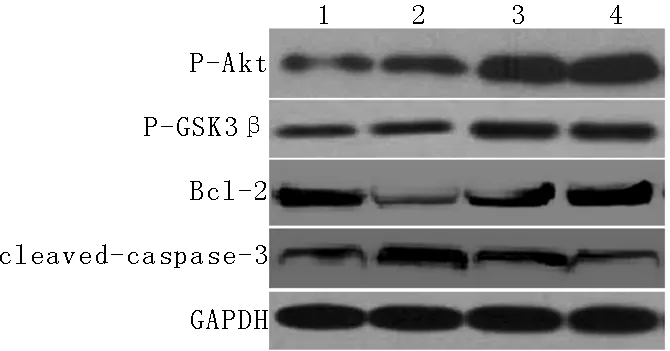
注:P-Akt=磷酸化Akt,P-GSK3β=磷酸化糖原合酶激酶-3β,GAPDH=3-磷酸甘油醛脱氢酶;1为假手术组,2为脑损伤组,3为异氟烷预处理组,4为异氟烷后处理组
图1 4组大鼠创伤性脑损伤后24 h损伤病灶周围脑组织P-Akt、P-GSK3β、Bcl-2和cleaved-caspase-3蛋白表达情况
Figure 1 Protein expression of P-Akt,P-GSK3β,Bcl-2 and cleaved-caspase-3 in brain tissues around nidus after 24 hours of traumatic brain injury among the four groups of rats

Table 2 Comparison of protein expression of P-Akt and P-GSK3β in brain tissues around nidus after 24 hours of traumatic brain injury among the four groups of rats

组别只数P-Akt蛋白表达量P-GSK3β蛋白表达量假手术组100.09±0.020.16±0.04脑损伤组100.11±0.07a0.18±0.06a异氟烷预处理组100.98±0.13ab0.56±0.19ab异氟烷后处理组101.01±0.17ab0.61±0.18abF值418.3662.84P值0.000.00
注:P-Akt=磷酸化Akt,P-GSK3β=磷酸化糖原合酶激酶-3β;与假手术组比较,aP<0.05;与脑损伤组比较,bP<0.05
3 讨论
异氟烷是临床上常用的卤族吸入性麻醉剂,其作用靶点广泛分布于大脑皮质、间脑、脑干和脊髓等中枢神经系统,近年研究发现异氟烷对多种中枢神经系统急性损伤(如脑缺血再灌注损伤、脑缺氧性损伤、蛛网膜下腔出血)有良好的神经保护作用,其神经保护作用机制主要通过抗凋亡、抗炎作用实现[8-10]。本研究结果表明,异氟烷可以明显减轻创伤性脑损伤大鼠神经功能损伤、抑制凋亡蛋白——cleavage-caspase-3蛋白的表达、减少创伤性脑损伤后凋亡神经元数量,提示异氟烷在创伤性脑损伤中具有良好的神经保护作用。以往研究发现,异氟烷的神经保护作用可能与激活Akt/GSK3β信号通路有关,因此,在证实异氟烷可以明显改善创伤性脑损伤程度后,本研究对其神经保护作用机制进行进一步探讨。

Table 3 Comparison of protein expression of Bcl-2 and cleaved-caspase-3 and apoptotic nerve cell amount in brain tissues around nidus after 24 hours of traumatic brain injury among the four groups of rats
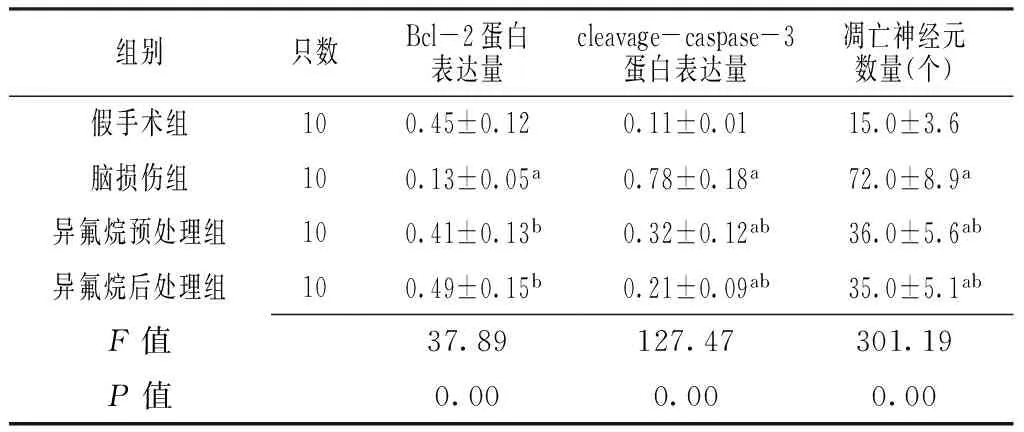
组别只数Bcl-2蛋白表达量cleavage-caspase-3蛋白表达量凋亡神经元数量(个)假手术组100.45±0.120.11±0.0115.0±3.6脑损伤组100.13±0.05a0.78±0.18a72.0±8.9a异氟烷预处理组100.41±0.13b0.32±0.12ab36.0±5.6ab异氟烷后处理组100.49±0.15b0.21±0.09ab35.0±5.1abF值37.89127.47301.19P值0.000.000.00
注:与假手术组比较,aP<0.05;与脑损伤组比较,bP<0.05

图2 4组大鼠创伤性脑损伤后24 h损伤灶周围脑组织细胞凋亡情况(TUNEL染色,×400倍)
Figure 2 Apoptosis of nerve cell in brain tissues around nidus after 24 hours of traumatic brain injury of the four groups of rats
Akt由三个不同的功能区域构成:氨基末端的pleckstrin同源性(PH)结构域、中间的一个催化结构域和C-末端的调节性结构域,该区域的丝/苏氨酸残基的磷酸化是Akt完全活化所必需的物质。有临床研究发现,静息状态下Akt主要位于细胞质,当细胞受到外界信号刺激时,磷脂酰肌醇-3激酶被激活后在质膜上生成第二信使磷脂酰肌醇-3,4,5-三磷酸(PIP3),PIP3与Akt蛋白中的PH结构域结合,结合后的Akt从细胞质转移到细胞膜上,从而导致Akt的Ser473位点同时发生磷酸化而被激活,而活化后的Akt会转移到细胞质或细胞核内。研究发现,活化的Akt通过与GSK3β结合而使Bcl-2家族成员发生磷酸化,从而发挥抗凋亡作用,且抑制凋亡执行关键蛋白cleaved-caspase-3的表达;阻止线粒体释放凋亡因子细胞色素c从线粒体到细胞质,阻断或下调线粒体凋亡的发生[11]。以往研究已明确,Akt在创伤性脑损伤的病理损伤机制中发挥着重要作用,使用Akt特异性激活剂可以明显加重创伤性脑损伤的病理损伤程度,加重脑损伤后神经功能缺损[12];相反,使用Akt失活剂可以明显减轻脑损伤的病理损伤程度,减轻神经功能缺损[13-15],以上研究结果提示Akt可能成为创伤性脑损伤的治疗靶点。本研究结果表明,异氟烷可以明显上调Akt/GSK3β信号通路的活性,增加抗凋亡蛋白Bcl-2蛋白的表达,减少cleaved-caspas-3蛋白的表达和凋亡神经元数量,提示这可能是异氟烷在创伤性脑损伤中发挥神经保护作用的机制之一。
综上所述,异氟烷对创伤性脑损伤大鼠有良好的神经保护作用,其机制可能与激活Akt/GSK3β信号通路有关。但未来还需要深入研究异氟烷发挥神经保护作用的详细机制及异氟烷治疗的理想剂量和时间窗,以期为异氟烷治疗脑损伤打下坚实的理论基础。
[1]Gyoneva S,Ransohoff RM.Inflammatory reaction after traumatic brain injury:therapeutic potential of targeting cell-cell communication by chemokines[J].Trends Pharmacol Sci,2015,36(7):471-480.
[2]Michinaga S,Koyama Y.Pathogenesis of brain edema and investigation into anti-edema drugs[J].Int J Mol Sci,2015,16(5):9949-9975.
[3]Sosunov SA,Ameer X,Niatsetskaya ZV,et al.Isoflurane anesthesia initiated at the onset of reperfusion attenuates oxidative and hypoxic-ischemic brain injury[J].PLoS One,2015,10(3):e0120456.
[4]Altay O,Suzuki H,Hasegawa Y,et al.Isoflurane on brain inflammation[J].Neurobiol Dis,2014,62:365-371.
[5]Wang JW,Wang HD,Cong ZX,et al.Puerarin ameliorates oxidative stress in a rodent model of traumatic brain injury[J].J Surg Res,2014,186(1):328-337.
[6]Si D,Li J,Liu J,et al.Progesterone protects blood-brain barrier function and improves neurological outcome following traumatic brain injury in rats[J].Exp Ther Med,2014,8(3):1010-1014.
[7]Zhai X,Chen X,Shi J,et al.Lactulose ameliorates cerebral ischemia-reperfusion injury in rats by inducing Hydrogen by activating Nrf2 expression[J].Free Radic Biol Med,2013,65:731-741.
[8]Xiang HF,Cao DH,Yang YQ,et al.Isoflurane protects against injury caused by deprivation of Oxygen and glucose in microglia through regulation of the Toll-like receptor 4 pathway[J].J Mol Neurosci,2014,54(4):664-670.
[9]Yin J,Li H,Feng C,et al.Inhibition of brain ischemia-caused notch activation in microglia May contribute to isoflurane postconditioning-induced neuroprotection in male rats[J].CNS Neurol Disord Drug Targets,2014,13(4):718-732.
[10]Zhao P,Ji G,Xue H,et al.Isoflurane postconditioning improved long-term neurological outcome possibly via inhibiting the mitochondrial permeability transition pore in neonatal rats after brain hypoxia-ischemia[J].Neuroscience,2014,280:193-203.
[11]Chen W,Qi J,Feng F,et al.Neuroprotective effect of allicin against traumatic brain injury via Akt/endothelial nitric oxide synthase pathway-mediated anti-inflammatory and anti-oxidative activities[J].Neurochem Int,2014,68:28-37.
[12]Kitagishi Y,Matsuda S.Diets involved in PPAR and PI3K/AKT/PTEN pathway May contribute to neuroprotection in a traumatic brain injury[J].Alzheimers Res Ther,2013,5(5):42.
[13]Wang G,Shi Y,Jiang X,et al.HDAC inhibition prevents white matter injury by modulating microglia/macrophage polarization through the GSK3β/PTEN/Akt axis[J].Proc Natl Acad Sci U S A,2015,112(9):2853-2858.
[14]Zhang C,Zhu J,Zhang J,et al.Neuroprotective and anti-apoptotic effects of valproic acid on adult rat cerebral cortex through ERK and Akt signaling pathway at acute phase of traumatic brain injury[J].Brain Res,2014,1555:1-9.
[15]Ishihara Y,Fujitani N,Kawami T,et al.Suppressive effects of 17β-estradiol on tributyltin-induced neuronal injury via Akt activation and subsequent attenuation of oxidative stress[J].Life Sci,2014,99(1/2):24-30.
(本文编辑:谢武英)
Neuroprotective Effect of Isoflurane in Rats with Traumatic Brain Injury and Its Mechanism
ZHANGRui,YANGZu-ti,ZHANGTong-yin,etal.
DepartmentofAnesthesiology,NanshiHospitalAffiliatedtoHe′nanUniversity,Nanyang473000,China
Objective To investigate the neuroprotective effect of isoflurane in rats with traumatic brain injury and its mechanism.Methods A total of 80 healthy male adult S-D rats were selected and divided into groups A,B,C,D,each of 20 rats.Modified Feeney freely falling body method was used to prepare rat model of traumatic brain injury,rats of A group were given open-window operation,rats of B group were given continue anesthesia of isoflurane before prepartion,rats of C group and D group were given CPR after preparation,and rats of D group were given extra continue anesthesia of isoflurane after CPR.NSS was used to evaluate the neurologic deficits after 12 hours and 24 hours of traumatic brain injury,immunoblotting was used to detect the protein expression of P-Akt,P-GSK3β,Bcl-2 and cleaved-caspase-3 in brain tissues around nidus after 24 hours of traumatic brain injury,and TUNEL was used to detect the apoptotic nerve cell amount in brain tissues around nidus after 24 hours of traumatic brain injury.Results NSS score after 12 hours and 24 hours of traumatic brain injury of C group was statistically significantly higher than that of A group,B group and D group,respectively,and that of B group and D group was statistically significantly higher than that of A group(P<0.05).Protein expression of P-Akt and P-GSK3β in brain tissues around nidus after 24 hours of traumatic brain injury of B group,C group and D group were statistically significantly higher than those of A group,those of B group and D group were statistically significantly higher than those of C group(P<0.05).Protein expression of Bcl-2 in brain tissues around nidus after 24 hours of traumatic brain injury of C group was statistically significantly lower than that of A group,B group and D group,respectively,while protein expression of cleaved-caspase-3 and apoptotic nerve cell amount of C group were statistically significantly higher than those of A group,B group and D group,protein expression of cleaved-caspase-3 and apoptotic nerve cell amount of B group and D group were statistically significantly higher than those of A group(P<0.05).Conclusion Isoflurane has certain neuroprotective effect in rats with traumatic brain injury,it may play a role of neuroprotection by activating the Akt/GSK3β signal pathway.
Brain injuries;Isoflurane;Rats
国家自然科学基金资助项目(81172415);河南省科技厅资助项目(0624410104)
473000河南省南阳市,河南大学附属南石医院麻醉科(张睿);南阳医学高等专科学校药理教研室(杨祖悌,张同寅,宋海军,王斌)
张睿,杨祖悌,张同寅,等.异氟烷对创伤性脑损伤大鼠的神经保护作用及作用机制研究[J].实用心脑肺血管病杂志,2015,23(8):38-42.[www.syxnf.net]
R 651.15
A
10.3969/j.issn.1008-5971.2015.08.012
2015-06-02;
2015-08-15)
Zhang R,Yang ZT,Zhang TY,et al.Neuroprotective effect of isoflurane in rats with traumatic brain injury and its mechanism[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(8):38-42.

