油污土壤降解细菌的分离鉴定及其生物强化研究
曲丽娜 贾洪柏 王秋玉
摘 要:从大庆油田长期石油污染的土壤中分离出高效降解石油烃的菌株5种,通过生理生化分析和16SrDNA全序列分析,初步确定为Pseudomonas sp.(假单胞菌属)、Pseudomonas aeruginosa(铜绿假单胞菌属)、Acinetobacter junii(琼氏不动杆菌属)、Microbacterium oxydans(微杆菌属)、Pseudomonas aeruginosa(铜绿假单胞菌属)。在摇瓶培养和土壤固体培养条件下的石油烃降解率都远远高出了对照组。同时通过改变初始盐浓度、N源和P源,初步探测了各菌株的最适生长和降解条件,为本土微生物强化的生物修复方法提供了新的菌种资源和信息,对进一步有效实现本土微生物强化具有重要意义。
关键词:生物强化;石油污染土壤;细菌;降解率
中图分类号 X172 文献标识码 A 文章编号 1007-7731(2015)11-17-05
Abstract:5 bacterial strains were isolated from the long-term petroleum-contaminated soil in the Daqing oilfield which can efficiently degrade petroleum hydrocarbons. Using physiological and biochemical assays,as well as 16S rRNA sequencing analysis,we identified these strains as Pseudomonas sp.,Pseudomonas aeruginosa,Acinetobacter junii,Microbacterium oxydans,and Pseudomonas aeruginosa.Under both liquid and solid(i.e.soil)culture conditions,these bacterial strains showed much higher petroleum hydrocarbon degrading rates than the control strain. By modulating the concentration of initial salt,N and P in the medium,we explored the optimal growth and degradation conditions of the bacterial strains. This study provides new bacterial resources and information for the autochthonous bioaugmentation of crude oil contaminated soil.
Key words:Bioaugmentation;Oil-contaminated soil;Bacteria;Degradation rate
“Autochthonous bioaugmentation”(本土生物强化)技术是由日本科学家Ueno Akio等于2007年首次提出的,主要指从石油污染的土壤中分离出具有石油降解能力的本土微生物,将其富集后重新投入到石油污染土壤中进行生物强化试验的技术[1]。Ueno从生物刺激试验土壤中分离出有高效降解能力的菌株J,将其富集后重新投放到污染土壤中进行生物强化试验,得到了较好的结果,TPH降解率达50%左右,比同等条件下用外源菌株WatG的强化处理效率高[1]。Das等的研究进一步体现了本土微生物在强化处理时的优越性,他们用从石油污染土壤中分离出的3种细菌进行生物强化试验时发现,三者均可以显著降低土壤中TPH的含量;而且在加入这些细菌后,土壤中细菌的生长和生物表面活性剂的产量都有所提高[2]。这些结果均说明在应用本土微生物进行生物强化试验时比用外源微生物强化时有较明显的优势。为此,笔者从原位石油污染的土壤中分离能够有效利用石油烃的细菌,并对其降解规律进行研究,同时改变不同形式的N源、P源、盐浓度、pH值,以期获得进行微生物生物强化的最佳方案。
1 材料与方法
1.1 材料
1.1.1 石油污染土壤 石油污染土壤样品采自大庆油田20世纪60年代开采的油井附近的石油污染土壤,分别采集地表、10cm和20cm处的土壤,装入无菌袋中密闭,分别置于4℃和-20℃下保存备用。
1.1.2 原油 原油取自黑龙江大庆油田,室温下为黑色粘稠固体。以石油醚为溶剂(沸程60~90℃)溶解,制成10%(100g/L)的石油原液,装入深棕色的试剂瓶中,置于凉爽阴暗处密封保存备用。
1.1.3 实验所需培养基 (1)富集液体培养基(g/L):NaCl1.0,K2HPO4·3H2O1.0,KH2PO41.0,MgSO4·7H2O0.5,NH4NO31.0,
CaCl20.02,FeCl3 痕量,牛肉膏0.3%,蛋白胨1%,pH7.0;(2)分离培养基(g/L):牛肉膏3,蛋白胨10,NaCl5,pH7.0~7.2,固体培养基加琼脂20g/L;(3)无机盐培养基(g/L):NaCl1.0,K2HPO4·3H2O1.0,KH2PO41.0,MgSO4·7H2O0.5,NH4NO31.0,CaCl20.02,FeCl3痕量,pH7.0。(4)土壤榨取液培养基:将400g的对照土样悬浮于1 000mL蒸馏水中,4 000r/min离心10min去除土壤颗粒,滤纸过滤,重复上述操作,直至滤液澄清,pH7.0,121℃灭菌20min后备用。
1.2 方法
1.2.1 石油降解细菌的分离与鉴定 将5g石油污染土壤样品加入45mL含油1%的富集液体培养基中,30℃、160r/min震荡培养3d。吸取5mL培养液重新转接入45mL新鲜的不含牛肉膏的富集液体培养基中,加入终浓度为1%的石油,在与上述相同的培养条件下连续转接5次[3]。采用稀释平板法进行分离,得到单菌株。在牛肉膏蛋白胨液体培养基中将菌株培养至对数生长期,离心收集菌体,用无菌水充分洗涤3次,以除去残留培养基,以无菌水为空白对照,用分光光度计在800nm和250nm之间进行波长扫描,以确认各菌株的特征吸收波长[4]。再进行生理生化实验,并对其16SrDNA进行测序,回收的PCR产物由上海生工进行序列测定,将测得的序列于NCBI上比对,判断细菌的种属。
1.2.2 液体培养条件下石油降解细菌降解性能测定 将摇瓶过夜培养的菌液接入含油1%的无机盐培养液和土壤榨取液中,接种量为1%(v/v),30℃,160r/min培养,分别在第1、3、6、10、15天取3瓶进行萃取[5],计算石油降解率。降解率计算公式为:
降解率(%)=[1-(W1-W2)W0×100]
式中:W0为初始石油质量(g);W1为锥形瓶+样品中残油的质量(g);W2为锥形瓶的质量(g)。
1.2.3 固体培养条件下石油降解细菌降解性能测定 将过夜培养的菌液接入灭菌的含油1%的油污土壤中,接种量为3%,与土壤充分混匀后,30℃静置培养,于第5、10、15天各取3瓶进行萃取,降解后的土壤分别用正己烷、二氯甲烷和三氯甲烷冲洗,将3次的上清液合并,在60℃左右的温度下于通风橱中使有机溶剂挥发至恒重,干燥器中冷却恒重后称量,计算石油降解率。
1.2.4 石油降解细菌原位修复的生物强化试验 分别研究初始盐浓度、不同氮源和不同磷源对石油降解细菌生长及石油降解率的影响。在无机盐培养基中,改变盐浓度为1%、3%、5%和7%;用氮元素质量相当的NaNO3、(NH4)2SO4、NH4Cl代替NH4NO3作为N源;用磷元素质量相当的KH2PO4、K2HPO4、NaH2PO4代替KH2PO4/K2HPO4作为P源,分别接入过夜培养的细菌,接种量均为1%,30℃、160r/min培养7d,测定培养液中菌的OD值和石油降解率。
2 结果与讨论
2.1 石油降解细菌的分离与鉴定 分离出5株高效石油降解细菌,分别编号为X3、X5、X9、X11和X12。经紫外分光光度计测定,5株细菌的最大吸收波长均在320cm左右,在测定X3、X5和X9的OD值时选用320nm,测定X11和X12的OD值时则选用300nm。
2.1.1 各菌株的生理生化实验 经过革兰氏染色等8项生理生化鉴定实验,结果见表1。
2.1.2 耐盐性试验 将各菌株分别接种于盐浓度为1%、2%、5%、10%、15%和20%的培养基中培养,3d后X3和X5菌株在10%的盐浓度下仍略有生长,耐盐性最好;X9在盐浓度为5%时略有生长,10%以上不生长,耐盐性相对较差;X11和X12在5%的盐浓度下生长良好,但在10%及以上的盐浓度下不生长,耐盐能力居中。
2.1.3 耐酸碱性试验 5个菌株在pH4.0~9.0的pH区间内均可生长,在pH4.0时,仅有X3菌株表现出较好的耐酸性,其余4种菌株均在碱性条件下生长状态高于酸性条件下,并pH8.0和9.0时生长达到最大,表现出较好的耐碱性。这些菌株生长在盐碱性较高的大庆土壤,在逐步适应环境的过程中形成了较好的耐碱性,有效的对土壤中石油烃进行生物降解。
2.1.4 细菌16SrDNA鉴定 将获得的菌株序列经Blast比对,取同源性最高的20条序列,用DNAStar软件的MegAlign程序,选用ClustalW法进行多序列比对分析,然后构建系统进化树,结合生理生化实验的鉴定结果确定各菌株的种属。表2中描述了5种菌株比对的结果。从图2中可看出,X3号菌株单聚一类,其余4种亲缘关系较近,与耐酸碱性的特征划分相符。
2.2 不同培养条件下细菌的降解性能
2.2.1 无机盐培养液条件下细菌的降解性能 无机盐培养基中仅有石油作为唯一碳源,能够充分体现石油降解细菌对石油的利用程度。X3和X5菌株在培养的初期就表现出较高的降解率(40%左右),并且在15d内一直保持领先,最终达到了近60%的降解率;X9降解率最低,1d时与空白相当,15d时只有X5降解率的50%左右,但也明显高于空白样品中石油烃的自然降解率。5种细菌都能够较好的利用石油烃作为碳源。
2.2.2 土壤固体培养条件下的降解性能 在土壤固体培养基中最接近自然环境下石油降解细菌生长的环境,X3和X5在15d时降解率仍然最高,分别达75%和72%;其次是X9和X11,15d的降解率分别达68%、64.34%;最后是X12,15d的降解率达59%。由此可见,虽然各菌株之间的降解效率略有不同,但均处于较高水平,远远高于对照组,所以各菌株在固体培养条件下对石油也表现出较好的降解能力,因此以上5个菌株可被称为高效的石油降解菌株,为其应用于土壤的原位及异位生物修复奠定了基础。
2.3 石油降解细菌原位修复的生物强化试验
2.3.1 盐浓度对细菌生长及石油降解率的影响 由表3可以看出,除X9菌株在7%的盐浓度下不生长外,其它菌株在这4种盐浓度下均可生长。X3菌株在5%盐浓度下生长最差,其余4种菌株均在7%盐浓度下生长最差,相对的石油降解率也最低;X3和X11菌株的最适生长盐浓度为1%,X5、X9和X12菌株的最适盐浓度为3%,石油降解率均在最适盐浓度下最高。
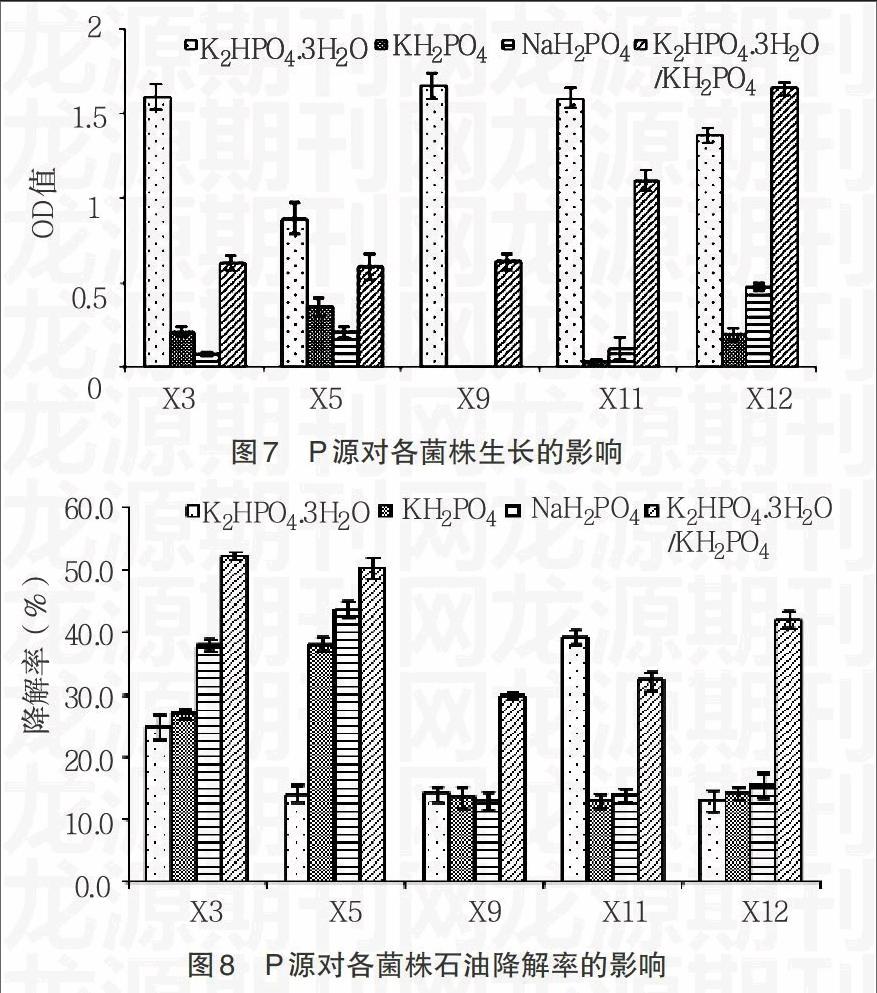
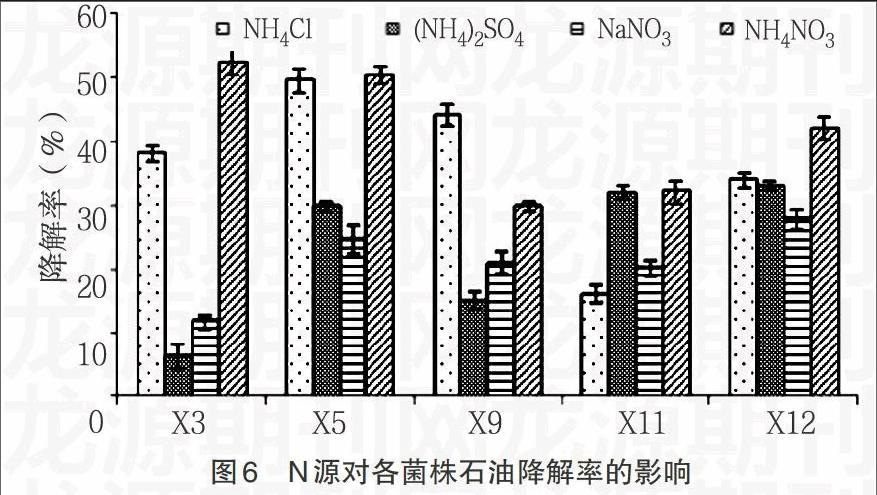
2.3.2 氮源对细菌生长及石油降解率的影响 由图5,6显示,5株原油降解细菌几乎都在以NaNO3为N源时生长的最好,但相对其石油降解率却都是最低的;而在生长状况一般的以(NH4)2SO4为氮源条件下,石油降解率却都处于较高的水平。总体看来,N源对石油降解率的影响出现了反相关的趋势,这可能是代谢石油烃有关的酶等活性物质,在不同N源生长条件下活性差别较大。因此,要达到强化细菌石油降解率的条件,需选择降解率较高的NH4NO3作为N源。
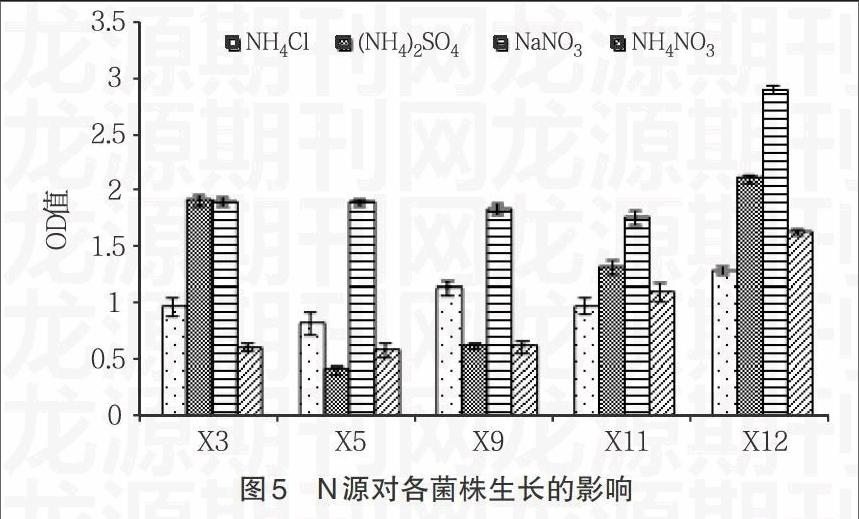
2.3.3 磷源对细菌生长及石油降解率的影响 如图7所示,各菌株在以K2HPO4·3H2O和K2HPO4·3H2O/KH2PO41∶1为P源时生长较好,而在以KH2PO4和NaH2PO4的生长较差,尤其是对于X9来说,在这2种P源条件下几乎不生长。图8表示磷源对各菌株石油降解率的影响,除X11外,其它菌株在以K2HPO4·3H2O为P源时的降解率几乎与生长成反比,而在以K2HPO4·3H2O/KH2PO41∶1为P源的降解率几乎与生长成正比,每个菌株基本都达到较好的降解效率;对X3和X5来说,虽然在以KH2PO4和NaH2PO4为P源时的生长较差,但降解率却较高,而对于其它菌株来说,由于在以KH2PO4和NaH2PO4为P源时的生长很差,X9几乎不生长,所以降解率都较低。因此,从总体来看,各菌株在以K2HPO4·3H2O/KH2PO41∶1为P源时的生长和降解率都较好,所以最适的P源应为K2HPO4·3H2O/KH2PO41∶1。
2.4 讨论
2.4.1 石油污染时间影响细菌的石油降解能力 由于大庆地区土壤盐碱性较强,从中分离出的5种细菌也都表现出了较好的耐盐碱性。同时5种细菌分离自不同的污染时间和不同深度的土层,其中X3、X5和X11菌株是在近期污染的地表土中分离得到的,它们在培养的初期就表现出较好的降解效率(40%左右)。可能由于该土样当中的细菌在采集前经过石油污染物的刺激,降解石油相关的机制已经开启,所以能较好的适应高浓度的石油污染条件,并对石油表现出较高的降解效率。在长期污染(5a以上)的土样中分离得到了X12和X9菌株,其中X12来自地表5cm土层样品,X9菌株来自20cm土层样品。X12的石油降解能力较好,地表污染较重,细菌的石油降解机制可能一直处于被激活的状态;而由于石油污染在土壤中扩散速率很慢,处于深层土壤的X9菌株的石油降解能力表现不如其他几种菌株突出。
2.4.2 N、P源影响细菌石油降解效率 在改变不同形式的N源和P源时发现,在生长状态好的N、P源条件下,菌株的石油降解率相对较低,而在生长状态较低的N、P源条件下,菌株的石油降解率反而相对较高。这可能是由于与细菌降解石油所需的酶等活性物质的表达受不同N、P源的调控,而这种调控与细菌细胞生长繁殖有关的基因表达调控呈现负相关,能够激活石油降解有关基因却会抑制细菌的生长。Audrew等[6]研究原油在土壤中泄漏后的生物降解能力时,发现当添加肥料的C∶N∶P=100∶5∶1.7并为缓慢释放形式时,效果最佳;其中N源主要利用NH4+,P源主要利用PO43-,与本研究的结果一致。因此,在利用微生物生物强化进行生物修复时,应当首先确定能够激活降解相关基因的N、P源种类,然后确定各物质所需的最适浓度,以保证石油降解细菌达到最佳的降解效果。
3 展望
利用微生物降解土壤中的石油污染物已经成为土壤生物修复技术的研究热点,已分离筛选出许多高效石油降解微生物,但是微生物降解石油污染物受许多复杂因素影响,如营养物质、氧气、温度、石油烃的种类等[7]。作为土壤生物修复技术的核心,为了更有效的利用已分离出的石油降解微生物,最大限度的提高降解效率,还需要从以下几个方面进行进一步的研究和探讨:
(1)已筛选出的高效石油降解微生物通常来自污染地区的本土微生物,其生长条件和对营养的需求都有较强的环境针对性,因此需要针对不同地域特点,结合地理、气候、土壤特性、污染强度、地下水埋深等影响因素,深入探讨微生物修复过程中营养物质的种类、基质投加量、混合菌剂对污染物降解的影响,建立适合本土微生物的最佳生物强化方案,最大限度的发挥其生物修复的功效。
(2)石油污染物成分复杂,包括多种烷烃和芳烃,尤其是其中的多环芳烃,种类多,结构复杂,毒性强,一直是困扰环境治理的难题。对微生物利用石油烃的机理研究是目前微生物修复工作的重中之重,研究烷烃代谢模型、影响烷烃降解酶合成的阻遏物和激活物、芳香烃代谢过程等,才能更有针对性的设计和完善微生物修复技术,使其具有更强的适用性和有效性。
(3)结合分子生物学技术,探讨微生物降解石油烃污染物的分子机理,寻找与降解代谢相关的酶基因。Beilen[8-9]发现Pseudomonas putida GPO1编码降解烷烃酶的操纵子主要位于OCT质粒,Marin[10]报道Burkholderia cepacia中控制烷烃降解的alkB操纵子比P.putida GPO1中的操纵子更容易被代谢产物中的阻遏物负调控。掌握石油烃降解酶的种类、活性、序列、调控机理,有助于开发和构建高效的石油烃降解工程菌,达到快速高效的修复效果。
参考文献
[1]A Ueno,Y Ito,I Yamamoto,et al.Isolation and Characterization of Bacteria from Soil Contaminated with Diesel Oil and the Possible Use of these in Autochthonous Bioaugmentation[J].World J Microbiol Biotechnol,2007,23:1739-1745.
[2]K Das,AK Mukherjee.Crude Petroleum-oil Biodegradation Efficiency of Bacillus Subtilis and Pseudomonas aeruginosa strains Isolated from a Petroleum-oil Contaminated Soil from North-East India[J].Bioresource Technology,2007,98:1339-1345.
[3]崔爱玲.石油降解菌对石油烃的降解作用及应用研究[D].青岛:中国海洋大学,2006:18-19.
[4]阮志勇.石油降解菌株的筛选、鉴定及其石油降解特性的初步研究[D].北京:中国农业科学院,2006:55-77.
[5]李宝明.石油污染土壤微生物修复的研究[D].北京:中国农业科学院,2007:28-56.
[6]AUDREW R,AUTRY.Bioremediation:An effective semedial alternative for petroleum hydrocarbon-contamition so[J].Environment Progress,1992:318-322.
[7]王红旗,陈延君,孙宁宁.土壤石油污染物微生物降解机理与修复技术研究[J].地学前缘,2006,1(13):134-139.
[8]BEILEN J B.Analysis of Pseudomonas putida alkane degradation gene clusters and flanking insertion sequences:Evolution and regulation of the alk genes[J].Microbiology,2001,147:1621-1630.
[9]BEILEN J B,WUBBOLTS M G.Genetics of alkane oxidation by Pseudomonas oleovorans[J].Biodegradation,1994,5:161-174.
[10]MARIN M M,SMITS T H M.The alkane hydroxylase gene of Burkholderia cepacia RR10 is under catabolite repression control[J].J Bacteriol,2001,18(3):4202-4209.
(责编:张宏民)

