酵母脂肪酶酶促合成虾青素琥珀酸酯及优化
尹春华,韩烨,吕乐,许倩倩,闫海
(北京科技大学化学与生物工程学院生物科学与工程系,北京100083)
引 言
虾青素 (3,3′-二羟基-4,4′-二酮基-β-胡萝卜素),是最早从河螯虾外壳、牡蛎和鲑鱼中发现的一种红色类胡萝卜素。虾青素是自然界抗氧化性最强的物质,其抗氧化能力是维生素E的1000倍,有 “超级维生素E”之称[1],可有效清除细胞内的氧自由基[2],具有增强细胞再生能力、保护细胞和DNA的健康[3],维持机体平衡等功能[4]。并且虾青素是唯一能通过血脑屏障的抗氧化剂[5],可抑制脑血栓的形成。目前虾青素已广泛应用于食品生产、水产养殖、医疗保健和化妆品等领域。但是,虾青素化学性质极不稳定,对热、氧、自然光和紫外线敏感,容易发生氧化而降解,这给虾青素的储存、使用等带来很多不便[6]。虾青素酯化可弥补虾青素在这一方面的不足,许多研究表明虾青素酯不仅具有虾青素的生理活性,而且随着修饰基团的加入,赋予了虾青素酯一些新的功能性质[7-8],如虾青素脂肪酸酯更易被小肠吸收,虾青素辛酸单酯和二酯在肝组织中具有更高的累积速率[8]。
目前,虾青素酯主要由化学法合成[9],采用碱金属烷醇盐等有机碱为催化剂,酰氯为酰化试剂,反应过程复杂,污染大,反应温度高 (80~120℃),反应过程中虾青素易受热异构化或降解降低反应产率,产物的分离纯化复杂且产品的生物活性不高。与化学合成法相比,酶法合成具有反应条件温和、催化效率高、催化专一性强等优点[8,10-12]。Sumida等[8]研究了酶法催化虾青素中链脂肪酸酯的合成。反应以辛酸和虾青素为底物,2 mg虾青素在80mg脂肪酶催化下,反应进行3d后单酯的生成率不到10%。他们也尝试了将辛酸换成月桂酸和癸酸,但反应产率均不高,没有实际应用价值。本文以虾青素和琥珀酸酐为底物,尝试酶法合成虾青素短链酯——虾青素琥珀酸酯,研究并优化了其合成条件。
1 实验材料与方法
1.1 实验材料
虾青素,纯度95.3%,购于Dr.Ehrenstorfer公司。假丝酵母脂肪酶 (Candidasp.lipase),北京化工大学赠送。色谱流动相甲醇、乙腈为色谱纯,分别购于Dikma technologies公司和Dima technology公司。其他试剂皆为分析纯,购于国药集团化学试剂北京公司。
1.2 分析测试仪器。
高效液相色谱仪,日本岛津公司LC-20A (配SPD-M20A二极管阵列检测器)。液相色谱质谱联用仪 (waters UPLC-MS Xevo G2QTOF),美国waters公司。
1.3 虾青素琥珀酸酯的合成
往25ml具塞锥形瓶中加入5ml DMSO (二甲基亚砜),适量的虾青素和琥珀酸酐,待两底物完全溶解后,加入适量脂肪酶摇匀,盖好瓶塞,外用两层锡箔纸包好避光置于转速为200r·min-1的恒温摇床中反应,适时取样分析,检测虾青素转化率。文中虾青素转化率定义为酯化反应过程中虾青素减少量与反应前虾青素总量的百分比,每次实验重复3次,取平均值。为了排除虾青素降解率 (与温度有关,5%左右)对转化率的影响,每次实验均做相应空白对照,校正转化率。
1.4 脂肪酶酶活的定义和测定方法
采用橄榄油乳化液水解滴定法测定[13]。酶活定义:脂肪酶在37℃,pH8.0水解橄榄油乳化液每分钟产生1μmol的脂肪酸所耗用的酶量,即为1个脂肪酶活力单位。
1.5 虾青素琥珀酸酯的分析方法
虾青素琥珀酸酯定性分析采用液相色谱质谱联用法:色谱质谱仪为waters UPLC-MS Xevo G2 QTOF,质谱采用电喷雾电离 (ESI)。色谱柱为BEH C18 (100mm×2.1mm,1.7μm),流动相为色谱纯甲醇-乙腈 (体积比为9∶1),流速0.4 ml·min-1。
虾青素转化率的定量检测采用HPLC法。检测条件为[14]:色谱柱为Diamonsil C18柱 (250×4.6mm,5μm)。流动相为色谱纯甲醇-乙腈 (体积比为9∶1),检测器为岛津20A二极管阵列检测器,检测波长475nm,流速1.0ml·min-1,进样量20μl。定量计算为外标法。
2 实验结果与讨论
2.1 虾青素酯的检测与定性
虾青素分子结构两端各有一个羟基 (—OH),每一个羟基都可以与羧基脱水反应生成酯基。图1是Candidasp.脂肪酶催化虾青素和琥珀酸酐反应样品典型色谱图。相对于不加酶空白对照 (色谱图未列出),样品中多出现了两个色谱峰 (峰1,峰2),推测应该是酯化产物虾青素单琥珀酸酯和虾青素二琥珀酸酯。进一步采用色谱质谱联用仪检测分析,测得色谱峰1,峰2的负离子质谱的最大荷质比 (m/z)分别为795.4108,695.3957,而虾青素二琥珀酸酯和虾青素单琥珀酸酯负离子扫描最大质荷比理论计算值分别为795.4128和695.3948,误差均小于5×10-6。可见色谱峰1是虾青素二琥珀酸酯,而色谱峰2是虾青素单琥珀酸酯。实验结果表明酶法催化虾青素琥珀酰化,可生成单琥珀酸酯和二琥珀酸酯。

图1 虾青素酯化反应产物HPLC色谱图Fig.1 HPLC chromatogram of succinylation products from astaxanthin
2.2 酶的筛选
分别以足量的固定化酶Lipozyme TL IM,Lipozyme RM IM,Novozym 435和游离假丝酵母脂肪酶 (Candidasp.lipase)为催化剂,在各酶适宜的反应温度下以1mg虾青素 和100mg琥珀酸酐为底物,5ml二甲基亚砜 (DMSO)为反应溶剂,反应48h,取样测定虾青素转化率,用以评价各脂肪酶催化虾青素琥珀酰化的效果 (表1)。实验结果表明Lipozyme RM IM和Novozym 435脂肪酶催化本反应的活力极低,尤其是Lipozyme RM IM催化反应48h后检测不到产物生成。Lipozyme TL IM虽能催化反应发生,但反应产率不高。假丝酵母脂肪酶 (Candidasp.lipase)作为催化剂,在所测试脂肪酶中催化效率最高。而且由于假丝酵母脂肪酶 (Candidasp.lipase)是国产粗酶,来源方便、成本低廉,故本文选定Candidasp.脂肪酶为合成虾青素琥珀酸酯的催化剂进行下一步研究。
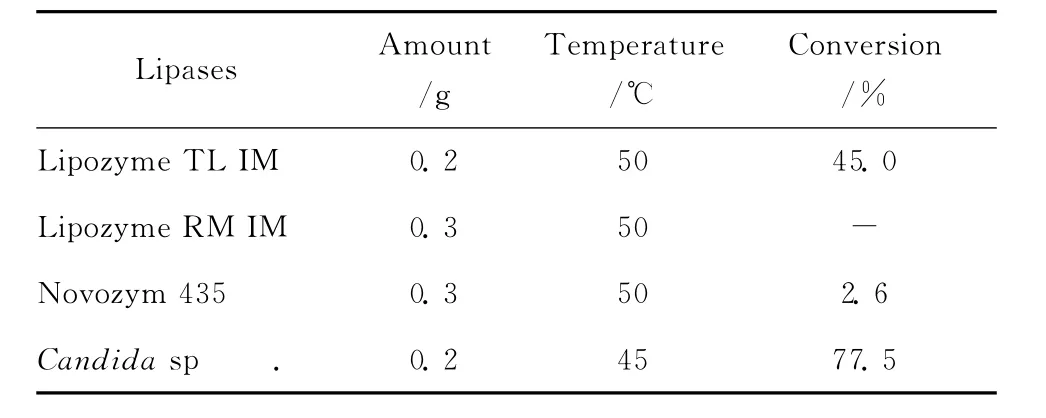
表1 不同脂肪酶合成虾青素琥珀酸酯Table 1 Enzymatic synthesis of astaxanthin succinates using different lipases
2.3 脂肪酶反应体系
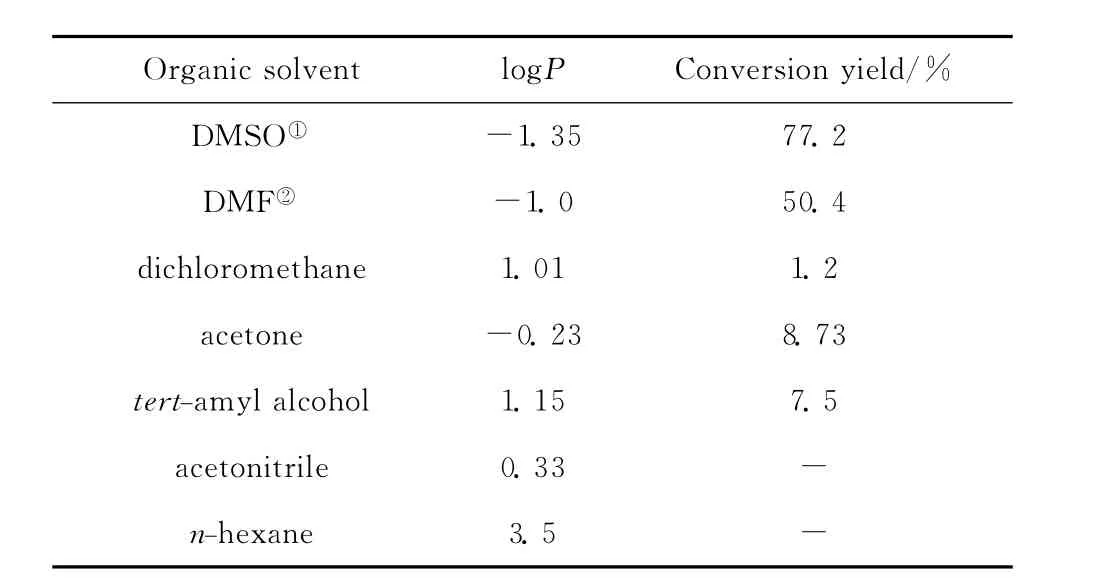
表2 有机溶剂对虾青素酯化的影响Table 2 Effect of organic solvents on astaxanthin esterification
有机相酶促反应中有机介质性质尤其是其亲疏水性是影响催化效果的关键因素。有机溶剂直接影响反应体系中底物浓度、传质速率,而且有机溶剂可夺走吸附在酶分子表面的必需水,打断氢键,破坏酶的活性构象从而影响酶的活性和稳定性[15]。大量研究表明有机溶剂对酶活的影响与溶剂极性密切有关[16-17],Laane等[18]认为极性参数logP (有机溶剂在正辛醇/水体系中分配系数的对数)可描述溶剂的极性与酶活的关系,认为logP<2的极性较强的有机溶剂不适合作脂肪酶催化反应的介质[18-19]。表2为常用代表性有机溶剂作为反应介质对虾青素琥珀酸酯合成的影响。结果表明logP值显然不能用来判断溶剂对Candidasp.酶催化合成虾青素琥珀酸酯的影响。在疏水性溶剂正己烷和石油醚反应体系中,检测不到酯的生成,主要原因应是琥珀酸酐在这些溶剂中几乎不能溶解,无法与另一底物虾青素充分接触。以N,N-二甲基甲酰胺(DMF)和二甲基亚砜 (DMSO)为反应介质,转化率较高。这可能与这两种有机溶剂特殊的物化性质有关,它们既可以溶解亲水性物质,又可以溶解疏水性物质,对虾青素和琥珀酸酐这两种底物都有很好的溶解度。但是丙酮同为非质子极性溶剂,对这两种底物的溶解度也很好,而且logP值比DMF,DMSO大,反应产率却不高,其中原因还需进一步研究。
2.4 温度
温度是影响酶催化作用的主要因素之一。随着温度的升高,化学反应速度加快;另一方面,过高的温度会引起酶的变性失活。而且本反应中底物虾青素化学性质极不稳定,过高的反应温度会导致其降解变性,影响反应最终转化率。在不同反应温度下,将1mg的虾青素和0.1g琥珀酸酐溶于5ml DMSO中,分别加入0.2gCandidasp.脂肪酶反应,并设置不加酶的空白对照以考察温度对虾青素降解的影响。反应结果见图2。在温度较低 (45℃以下)时,虾青素的转化率随温度的升高而升高。比较45℃和50℃下反应进程可见:虽然50℃反应初速度较快,达到平衡所需时间短,但其最终转化率和45℃却没有明显差异。究其原因,应该是该酶50℃开始明显失活导致。不加酶空白对照实验表明 (数据未列出),45℃下虾青素的降解率不到8%,而50℃度时虾青素的降解率升至15%。综合转化率和降解率两者考虑,该酶促反应温度45℃比较适宜。
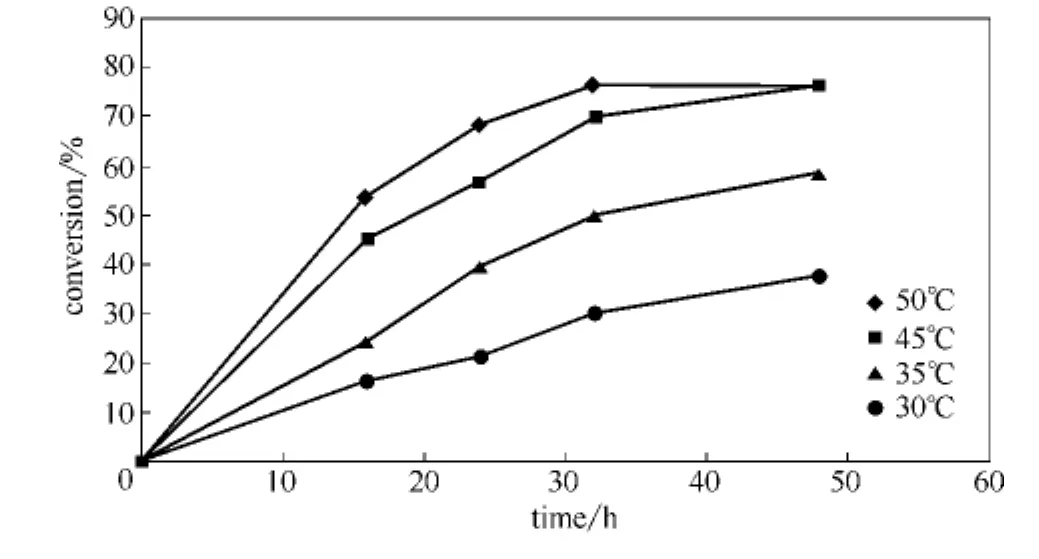
图2 反应温度对虾青素酯化的影响Fig.2 Effect of temperature on astaxanthin esterification(Reaction conditions:1mg astaxanthin,100mg succinic anhydride,5ml DMSO,0.2g Candidasp.lipase)
2.5 摩尔比
由于虾青素价格昂贵,酯化反应中应使虾青素转化相对完全,理论上这可加大琥珀酸酐与虾青素的摩尔比来实现。图3是底物摩尔比对虾青素的转化率的影响,结果表明摩尔比是此反应的关键因素。当琥珀酸酐与虾青素的摩尔比低于40时,检测不到酯化产物,说明酯化反应基本不能进行。底物摩尔比大于40,酯化反应才能发生而且虾青素的转化率随摩尔比的升高而升高,两者摩尔比为800时,转化率可达90%以上,摩尔比升至1200时,虾青素接近于反应完全 (99.1%)。这与文献报道虾青素中链酯的合成 (底物摩尔比在30以上酯化才能发生)相一致[8],可见对于酶催化,虾青素的羟基活泼性还不够高,需要在高摩尔比下酯化才能进行。底物摩尔比不仅影响转化率,也影响产物组成(表3)。在低摩尔比情况下,主要生成的是单酯,高摩尔比下才有较多的二酯生成。推测该反应机理,可能是串联反应,虾青素的一个羟基先酯化生成单酯,在高琥珀酸酐浓度下,单酯的另一个羟基再酯化生成二酯,其具体反应机理还需进一步研究。
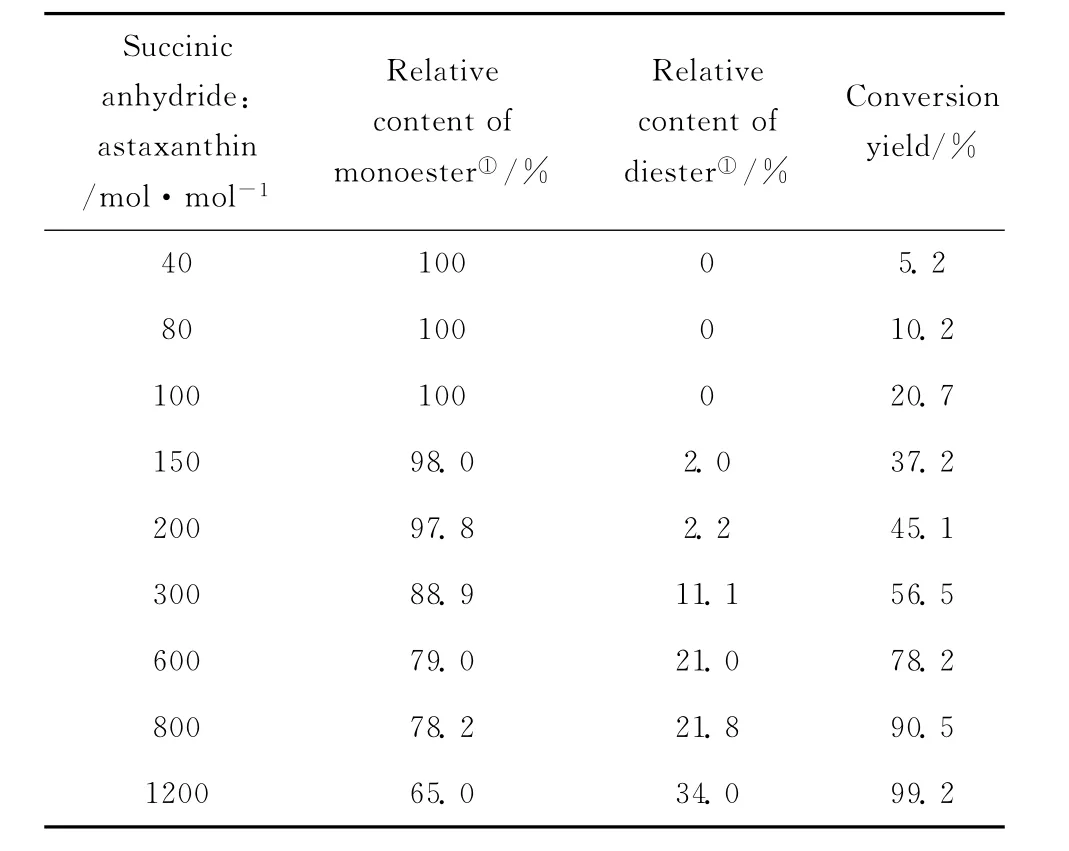
表3 底物摩尔比对虾青素酯化反应产物分布的影响Table 3 Effect of substrate molar ratios on esterification products from astaxanthin
2.6 含水量的影响
在有机相酶催化反应,微量水的存在对酶维持其活性构象至关重要,绝对无水的体系中酶表现不出活性,而且反应体系中的水还影响酯化反应的化学平衡,有时需要采取一些措施去除反应中产生的水[20]。催化中水对反应的影响不仅与酶有关,而且与反应体系有关[21]。Sumida等[8]在非极性溶剂正己烷中合成虾青素中链脂肪酸酯研究中发现,加入适量的水 (0.5%~20%)能极大地提高虾青素酯的生成率。为了考察虾青素琥珀酸酯酶促合成中体系含水量对反应的影响,先将DMSO脱水处理(加入无水Na2SO4静置过夜),然后以1mg虾青素和134mg琥珀酸酐 (即两者摩尔比为1∶800)为反应底物,脱水后DMSO作为酯化反应介质,分别加入不同的水量,0.2g脂肪酶,45℃条件下反应48h,检测虾青素的转化率。如图4所示,当反应体系中含水量达到0.5%时虾青素转化率最高,比文献报道虾青素中链酯合成所需水量偏低[8]。这主要可能是由于所用酶不同,而且本研究采用的酰化试剂是酸酐与文献中采用的羧酸不一样。
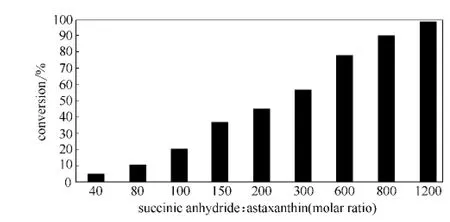
图3 底物摩尔比对虾青素酯化反应的影响Fig.3 Effect of substrate molar ratios on astaxanthin esterification
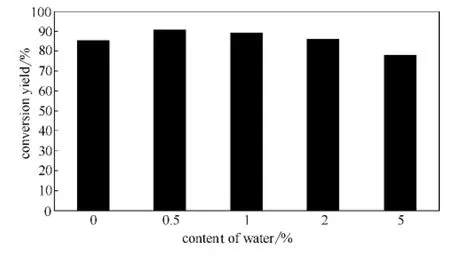
图4 体系含水量对虾青素酯化的影响Fig.4 Effect of water content in system on astaxanthin esterification
2.7 反应加酶量的影响
以1mg虾青素和134mg琥珀酸酐为底物(摩尔比为1∶800),以5ml DMSO为反应介质,加入不同量脂肪酶45℃下反应48h后检测虾青素的转化率,实验结果如图5所示。脂肪酶含量为0.2g时,虾青素转化率达到最高,加大脂肪酶用量,虾青素转化率不升高反而略有下降。究其原因主要是由于过多的脂肪酶在反应体系中分散不好,容易成团,这点在实验过程中可观察到。故0.2g脂肪酶为本合成条件下催化剂最佳用量。
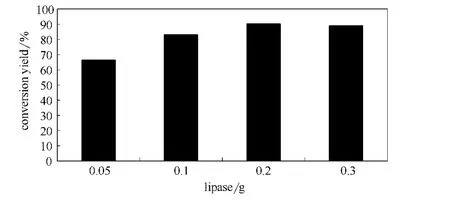
图5 酶量对虾青素酯化的影响Fig.5 Effect of lipase amount on astaxanthin esterification
3 结 论
采用假丝酵母脂肪酶 (Candidasp.lipase)成功地对虾青素琥珀酰化合成了虾青素琥珀酯。实验表明酶和反应介质、底物摩尔比是该酶促反应的关键因素:在所考察的几种酶源中,假丝酵母脂肪酶(Candidasp.lipase)的催化活性最高;DMSO为最合适的反应介质。底物摩尔比不仅决定了虾青素的转化率,而且决定了产物的组成,琥珀酸酐和虾青素摩尔比低于40,酯化反应不能发生,低摩尔比下产物中只有单酯,摩尔比大于150时产物中才出现二酯。同化学法相比,生物酶法合成维生素E酯具有反应条件温和、环境友好、产品色泽好等优点,符合绿色化学发展方向,具有很好的开发应用前景。本文反应产物为虾青素单酯和二酯的混合物,影响这两种产物的相对含量的因素,以及这两种酯的稳定性及生理功能还需要进一步研究。
[1] Miki W,Hosoda K,Kondo K.Astaxanthin-containing drink [P]:JP,10155459.1998-06-16.
[2] Lee S H,Min D B.Effects,quenching mechanisms and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soybean oil[J].JournalofAgriculturalandFoodChemistry,1990,38 (8):1630-1634.
[3] Tripathi D N,Jena G B.Intervention of astaxanthin against cyclophosphamide-induced oxidative stress and DNA damage:a study in mice [J].Chemico-BiologicalInteractions,2009,180 (3):398-406.
[4] Otton R,Marin D P,Bolin A P,dos Santos R D M,Polotow T G,Sampaio S C,de Barros M P.Astaxanthin ameliorates the redox imbalance in lymphocytes of experimental diabetic rats [J].Chemico-Biological Interactions,2010,186 (3):306-315.
[5] Sasaki Y, Kobara N, Higashino S, Giddings J C,Yamamoto J.Astaxanthin inhibits thrombosis in cerebral vessels of stroke-prone spontaneously hypertensive rats [J].NutritionResearch,2011,31 (10):784-789.
[6] Ni Hui(倪辉),He Guoqing(何国庆),Wu Guangbin (吴光斌),Yang Yuanfan(杨远帆),Chen Shenru (陈申如),Cai Huinong(蔡慧农).Effects of disrupting conditions on extracting fromPhaffiarhodozymaby acid method [J].TransactionsoftheCSAE(农业工程学报),2005,21(3):176-180.
[7] Yukihista Tanaka,Hidehiko Hibino.Production method of astaxanthin fatty acid easters[P]:JN,11290094.1999-10-26.
[8] Motoo Sumida, Masahiro Nakao, Namino Tomimori,Koshi Namikawa,Harukazu Fukami.Astaxanthin mediumchain fatty acid eater,process for producing the same and composition containing the ester [P]:US,20050228188 A1.2005-10-13.
[9] Ernst Hansgeorg,Dobler Walter,Keller Andreas,Henrich Klaus.Method for producing astaxanthin dimethyldisuccinate [P]:US,8492579B2.2013-07-23.
[10] Meng X,Xu G,Zhou Q L,Wu J P,Yang L R.Highly efficient solvent-free synthesis of 1,3-diacylglycerols by lipase immobilised on nano-sized magnetite particles [J].FoodChemistry,2014,143:319-324.
[11] Yin Chunhua(尹春华),Liu Jiangfan(刘江帆),Gao Ming(高 明 ).Optimized enzymatic synthesis of vitamin E succinate in organic solvents[J].CIESCJournal(化工学报),2010,61 (4):935-941.
[12] Li He(李贺),Lin Rihui(林日辉),Su Jiating (粟佳婷),Wu Jia(巫佳),Wei Chunyu(韦春雨),Li Xunbi(李训碧).Properties and structure of rosin acid starch ester prepared by enzyme catalysis[J].CIESCJournal(化工学报),2014,65 (10):4123-4130.
[13] Gargouri M, Legoy M D. Bienzymatic reaction for hydroperoxide production in a multiphasic system [J].EnzymeMicrob.Tech.,1997,21 (2):79-84.
[14] Yin C H,Yang S Z,Liu X L,Yan H.Efficient extraction of astaxanthin from phaffia rhodozymas with polar and nonpolar solvents after acid washing [J].ChineseJournalof ChemicalEngineering,2013,21 (7):776-780.
[15] Lu J,Nie K L,Wang F,Tan T W.Immobilized lipaseCandidasp.99-125catalyzed methanolysis of glycerol trioleate:solvent effect [J].BioresourceTechnology,2008,99 (14):6070-6074.
[16] Li W,Shen H Q,Tao Y F,Chen B Q,Tan T W.Amino siliconesfinished fabrics for lipase immobilization:Fabrics finishing and catalytic performance of immobilized lipase[J].TanProcessBiochemistry,2014,49 (9):1488-1496.
[17] He W S,Jia C S,Ma Y A,Yang Y B,Zhang X M,Feng B A,Yue L.Lipase-catalyzed synthesis of phytostanyl esters in non-aqueous media [J].JournalofMolecular CatalysisB:Enzymatic,2010,67 (1/2):60-65.
[18] Laane C,Boeren S, Vos K, Veeger C. Rules for optimization of biocatalysis in organic solvent [J].Biotechnol.Bioeng.,1987,30 (1):81-87.
[19] Claon P A,Akoh C C,Enzymatic synthesis of geranyl acetate in hexane withCandidaantarcticalipase [J].J.Am.OilChem.Soc.,1994,71 (6):5752578
[20] Lee Da Eun,Park Kyung Min,Chol Seung Jun,Shim Jae Hoon,Chang Pahn Shick.Enhancing operational stability and exhibition of enzyme activity by removing water in the immobilized lipase-catalyzed production of erthorbyl laurate[J].BiotechnologyProgress,2013,29 (4):882-889.
[21] Nordblad M,Silva V T L,Nielsen P M,Woodley J M.Identificition of critical parameters in liquid enzymecatalyzed biodiesel production [J].Biotechnologyand Bioengineering,2014,111 (12):2446-2453.

