IBA浓度与培养基对黄芩不定根生物量和总黄酮含量的影响
田海丽+全雪丽+秦嘉泽+吴松权
摘要:为了筛选适宜黄芩不定根生长的培养基和IBA浓度,研究了2种培养基B5、MS以及不同浓度IBA对不定根生长和总黄酮积累的影响。结果表明,B5+1.0 mg/L IBA为最适培养基,此时黄芩不定根生长状态良好、健壮,生物量较多,并且总黄酮含量最高,达到2.49 mg/g,明显高于其他处理。
关键词:黄芩;不定根;IBA浓度;培养基;总黄酮
中图分类号:S567.23+9.043 文献标志码:A
文章编号:1002-1302(2015)04-0065-02
收稿日期:2014-05-23
基金项目:吉林省科技项目(编号:201115228)。
作者简介:田海丽(1990—),女,陕西宝鸡人,硕士研究生,主要从事植物生物技术研究。E-mail:tianhaili123@sina.com。
通信作者:吴松权,博士,副教授,硕士生导师,主要从事植物种质研究。Tel:(0433)2435633;E-mail:arswsq@ybu.edu.cn。
黄芩(Scutellaria baicalensis Georgi)为唇形科黄芩属多年生草本植物,别称山茶根、黄金茶,始载于《神农本草经》,被列为中品[1]。黄芩以根入药,其味苦性寒,有清热除湿、泻火解毒、止血安胎、镇静抗炎的功效[2-3]。黄酮类化合物是黄芩的有效成分,具有较强的抗肿瘤、抗病毒、抗氧化、抗HIV、清除自由基等作用,并且其毒性小,不易产生耐药性,生物安全性高[4-8]。这些特点使得黄芩的应用和开发越来越受到国内外医学界的关注,需求量随之急剧增加,致使野生黄芩被大量采挖,野生资源遭到了严重破坏,而黄芩在栽培过程中往往出现品质下降、农药残留等问题,市场供求矛盾日益尖锐。
不定根培养是一种植物器官培养方法,近年来正成为获取特定次生代谢产物的有效手段之一,具有生长周期短、可人为控制生长条件、重复性强等优点[9]。在目前的药用植物不定根研究中,研究得较为透彻的是人参,如韩国在研究人参不定根培养方面取得了重大成就,已达到了工业化生产程度;我国科研人员也相继对丹参、太子参、三七、红豆杉、甘草、柴胡、苍术、白术、东北刺人参、黄芪进行了研究[10]。但是目前还未发现利用黄芩不定根进行次生代谢的研究,因此本试验以黄芩为材料诱导不定根,研究B5、MS培养基与不同IBA浓度的组合对不定根增殖的影响,以期通过测定生物量、总黄酮含量,优化出最适宜的培养基与IBA激素浓度,为利用黄芩不定根规模化生产黄酮类化合物提供理论依据。
1 材料与方法
1.1 材料和仪器
黄芩种子采集于吉林省延边朝鲜族自治州安图县。标准品芸香苷购自上海融禾医药科技发展有限公司;试验中所用到的其他试剂均为分析纯。
主要仪器为UV-3100紫外-可见分光光度计。
1.2 试验方法
1.2.1 黄芩不定根诱导 选取籽粒饱满的黄芩种子播种,待苗长至6 cm时,选取根部,先用自来水冲洗2 h,再分别用75%乙醇漂洗45 s、无菌水漂洗3次、0.1%氯化汞消毒 6 min、无菌水漂洗6次后切成1 cm×1 cm的外植体,接种于B5+2.0 mg/L IBA+30 g/L蔗糖+8 g/L琼脂、pH值为5.8的培养基上,于(25±1) ℃暗培养,诱导不定根。
1.2.2 培养基及激素浓度组合的筛选 培养基为MS、B5,添加不同浓度的IBA(0、1、2、3、4、5 mg/L),培养基中其他成分同诱导培养基。在(25±1) ℃条件下暗培养7周,60 ℃烘干后称其干质量,即为生物量。
1.2.3 总黄酮测定 (1)对照品溶液的制备:精确称取1 mg芸香苷标准品,置于10 mL容量瓶中,先加30%乙醇溶解,再定容至10 mL,混匀后配制成标准溶液。(2)标准曲线的绘制:精确量取0、0.4、0.8、1.2、1.6、2.0 mL对照品溶液,分别置于10 mL容量瓶中,加30%乙醇至5 mL,再分别加入 0.3 mL 5%亚硝酸钠,混匀,静置6 min;加入0.3 mL 10%硝酸铝溶液,混匀,静置6 min;加入2.0 mL 1 mol/L的氢氧化钠溶液,再分别用30%乙醇定容至10 mL,静置15 min,在 510 nm 波长处测定其吸光度D510 nm。以吸光度D510 nm为纵坐标、标准溶液浓度为横坐标绘制标准曲线,y=11.892 9x+0077 6,r2=0998 2。(3)样品溶液制备:称取100 mg烘干至恒质量的黄芩不定根,在液氮中充分研磨,加入1 mL无水乙醇充分混匀,振荡暗提取24 h,12 000 r/min离心10 min,收集上清液置于1 mL容量瓶备用。(4)样品总黄酮的测定:精确量取 0.3 mL 样品,以取样0 mL为空白对照,按照标准曲线的制备步骤的“加入30%乙醇至5 mL”起,至“分别测其吸光度”,从标准曲线上读出样品溶液中总黄酮的含量。
1.2.4 统计分析 使用SPSS 19.0进行数据统计分析。
2 结果与分析
2.1 培养基与IBA浓度对不定根生长的影响
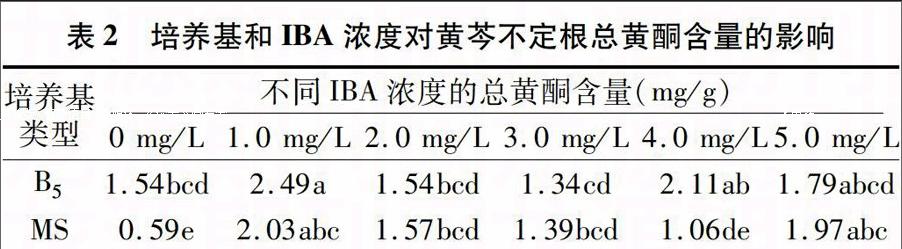
由表1可以看出,在B5、MS培养基中,不定根的生长能力不同,且2种培养基之间存在显著性差异,B5培养基显著优于MS培养基,不定根在B5培养基中生长旺盛、分化多、白嫩、生长状态良好、老化速度慢,而在MS培养基中不定根生长缓慢、分化少、易老化,且生物量少。从激素浓度看,IBA促进了黄芩不定根生长,B5培养基与IBA组合促进了黄芩不定根的生物量积累,显著高于MS培养基与IBA组合;并且随着IBA浓度的提高,不定根上的愈伤组织也随之增多,当IBA浓度为1.0 mg/L时,不定根生长旺盛、分化多、根长、基本无愈伤组织,生物量较大,达0.628 g;当IBA浓度为4.0 mg/L时,生物量积累最大达0.641 g,但是此时不定根分化较少,且根长度较短,愈伤组织较多;当IBA浓度为5.0 mg/L时,生物量有所减少,这可能与激素浓度过高有关。
表1 培养基与IBA浓度对黄芩不定根生物量的影响
培养基
类型
不同IBA浓度的不定根生物量(g)
0 mg/L 1.0 mg/L 2.0 mg/L 3.0 mg/L 4.0 mg/L 5.0 mg/L
B5 0.168j 0.628b 0.526d 0.612c 0.641a 0.436e
MS 0.128k 0.284g 0.242h 0.176i 0.304f 0.244h
注:表中数据后标有不同小写字母代表在0.05水平下差异显著。表2同。
2.2 培养基与IBA浓度对黄芩培养基不定根总黄酮含量的影响
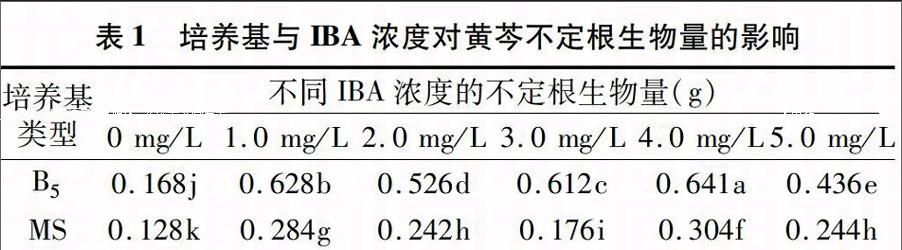
由表2可以看出,IBA对黄芩不定根总黄酮的累积有促进作用,添加IBA后不定根的总黄酮量明显高于对照组,虽然MS培养基与IBA组合对总黄酮含量促进作用明显高于B5培养基与IBA组合,但是B5培养基中不定根的生物量显著高于MS培养基(表1),因此认为B5培养基更利于总黄酮的累积。IBA浓度为1.0 mg/L时,总黄酮含量最高,且与其他处理之间存在显著性差异;当IBA浓度为3.0 mg/L时,B5培养基总黄酮含量与对照无显著性差异,而MS培养基与对照之间存在显著性差异。因此可以认为,选择适当的IBA浓度才能增加黄芩不定根总黄酮的含量;万贵香等研究也表明,适宜的外源激素才能促进黄芩愈伤组织中黄芩苷的积累[11]。
表2 培养基和IBA浓度对黄芩不定根总黄酮含量的影响
培养基
类型
不同IBA浓度的总黄酮含量(mg/g)
0 mg/L 1.0 mg/L 2.0 mg/L 3.0 mg/L 4.0 mg/L 5.0 mg/L
B5 1.54bcd 2.49a 1.54bcd 1.34cd 2.11ab 1.79abcd
MS 0.59e 2.03abc 1.57bcd 1.39bcd 1.06de 1.97abc
注同表1。
3 结论
由研究结果可以看出,无论是B5还是MS培养基,在供试IBA浓度范围内黄芩不定根生物量与总黄酮的累积都存在2个高峰。第1个高峰期为1.0 mg/L IBA,这可能是低浓度的IBA促进了不定根的生长与黄酮类物质的积累;随着IBA浓度增加,对其促进作用减小并逐渐形成激素胁迫使生物量与总黄酮减少;之后随着IBA浓度进一步增加,不定根响应激素胁迫而逐渐适应了较高的IBA浓度,出现了第2个高峰期,在B5培养基生物量和总黄酮最高时期为4.0 mg/L处理,而MS培养基中生物量最高时期为4.0 mg/L处理,总黄酮最高时期为5.0 mg/L处理。可见黄芩不定根在不同培养基中应对高浓度外源激素胁迫的能力是有不同的,总体可见,B5培养基中IBA浓度为1.0 mg/L时,总黄酮含量最高,达2.49 mg/g。
B5培养基和MS培养基主要区别在于培养基的铵态氮与硝态氮比值的差异,B5培养基铵态氮与硝态氮比值是MS培养基的1/6,铵态氮含量远低于MS培养基,从而使硝态氮更利于不定根生长及总黄酮积累,这也可能是B5培养基优于MS培养基的原因。Cui等研究发现,氮源类型影响不定根生长及次生代谢产物积累,硝态氮更利于不定根的生长[12]。本试验表明,黄芩不定根在B5培养基中生长状态良好,而且B5培养基生物量显著高于MS培养基,使B5培养基总黄酮积累显著高于MS培养基,推测是由于氮源类型的差异引起的,这还需要进一步的试验鉴定。
参考文献:
[1]周锡钦,张庆英,梁 鸿,等. 黄芩中主要黄酮类成分的含量分析[J]. 中国中药杂志,2009,34(22):2910-2915.
[2]张 瑜,武 斌. 黄芩药理作用的研究进展[J]. 医学综述,2013,19(6):1091-1093.
[3]王 玮,白 月,王俊平. 黄芩茎叶总黄酮对大鼠气囊滑膜炎抗炎作用机制的研究[J]. 沈阳医学院学报,2008,10(1):24-25.
[4]赵 梅,周淑琴. 黄芩中黄酮类化合物抗肿瘤作用的研究进展[J]. 中国药房,2013,24(11):1050-1052.
[5]Li-Weber M. New therapeutic aspects of flavones:the anticancer properties of Scutellaria and its main active constituents Wogonin,Baicalein and Baicalin[J]. Cancer Treatment Reviews,2009,35(1):57-68.
[6]Zhang D Y,Wu J,Ye F,et al. Inhibition of cancer cell proliferation and prostaglandin E-2 synthesis by Scutellaria baicalensis[J]. Cancer Research,2003,63(14):4037-4043.
[7]郭少英,程发峰,钟相根,等. 黄芩苷的体外抗氧化研究[J]. 时珍国医国药,2011,22(1):9-11.
[8]李晨睿,牛银波,潘亚磊,等. 黄芩药动学研究进展[J]. 中国药理学通报,2013,19(8):1048-1053.
[9]Wu S Q,Lian M L,Gao R,et al. Bioreactor application on adventitious root culture of Astragalus membranaceus[J]. In Vitro Cellular & Developmental Biology-Plant,2011,47(6):719-724.
[10]尹双双,高文远,王 娟,等. 药用植物不定根培养的影响因素[J]. 中国中药杂志,2012,37(24):3691-3694.
[11]万贵香,马 琳,张 坚. 不同浓度的外源激素对黄芩愈伤组织的生物量和黄芩苷含量的影响[J]. 中国中药杂志,2012,37(24):3799-3802.
[12]Cui X H,Murthy H N,Wu C H,et al. Adventitious root suspension cultures of Hypericum perforatum:effect of nitrogen source on production of biomass and secondary metabolites[J]. In Vitro Cellular & Developmental Biology-Plant,2010,46(5):437-444.

