不同沉淀方法对外源表达凝乳酶活性的影响
邓培渊+郭红玲+袁伟+李玉华

摘要:从粗提重组凝乳酶的得率、保存活性2个方面比较了乙醇沉淀法和硫酸铵沉淀法的差别。结果表明,相对于硫酸铵沉淀法,乙醇沉淀法获得蛋白的量相差不是很大,但是乙醇沉淀法所获得蛋白的单位效价是硫酸铵沉淀法的1.27倍,且乙醇沉淀法所得产物的比活性提高了16.78%。综合考虑重组凝乳酶的得率与活性,用乙醇沉淀的效果较好。
关键词:重组凝乳酶;活性;乙醇沉淀法;硫酸铵;盐析
中图分类号: Q814.1 文献标志码: A
文章编号:1002-1302(2015)04-0050-03
收稿日期:2014-05-08
基金项目:河南省基础与前沿技术研究计划(编号:102300410146)。
作者简介:邓培渊(1981—),男,河南登封人,博士,讲师,主要从事动物分子生物学研究。E-mail:zhzd201@hotmail.com。
凝乳酶原一般存在于反刍动物的第4胃中,在酸性条件下经自我剪切形成有活性的凝乳酶。凝乳酶属于酸性蛋白酶,主要功能是水解Κ-酪蛋白的Phe 105-Met 106键,在室温以上并有Ca2+存在时,可使蛋白质凝聚成乳块,因而在奶酪生产和改良中有重要的应用价值[1]。目前,凝乳酶的替代品主要来源于动物凝乳酶、植物凝乳酶、微生物凝乳酶以及重组凝乳酶。常见的动物胃蛋白酶主要存在于幼猪[2]、小鸡、金枪鱼以及鲨鱼中[3-5],但是这些动物的胃蛋白酶与小牛凝乳酶仍有所不同。在多种植物的不同部位中可以分离到使乳凝固的蛋白酶,即植物凝乳酶[6]。在合欢树、无花果、新鲜木瓜中提取出的蛋白酶以及姜汁、柠檬汁等植物非蛋白酶均有较好的凝乳作用,因此具有广阔的商业价值[7-10]。
微生物凝乳酶主要来源于细菌、放线菌和真菌,由于微生物凝乳酶具有耐热性强、不易失活的特点,在实际生产中需要进一步调整工艺促使凝乳酶失活。研究发现,基因工程凝乳酶同天然凝乳酶的性质基本相同,利用基因工程生产的凝乳酶不仅纯度高、产出的奶酪品质好,而且易于工业化生产,因此重组凝乳酶具有重要的实际应用价值[11]。
要对外源表达的凝乳酶进行分离纯化,获取有活性的目的产物,纯化的第1步就是对发酵液进行浓缩,在去除杂质的同时,可以获取高活性的凝乳酶。目前粗提外源表达凝乳酶常用硫酸铵沉淀法或乙醇沉淀法,不同的粗提方法直接影响凝乳酶的活性和纯化效果。本研究对外源表达重组凝乳酶的初步浓缩方法进行比较分析,以期为工业化生产提供一定的理论基础。
1 材料与方法
1.1 试验材料
试验材料为重组菌株km2,由笔者所在实验室构建并保存。
1.2 培养基
100 mL YEPD培养基配方:1 g 酵母提取物,2 g 葡萄糖,2 g 蛋白胨,加去离子水至100 mL,于120 ℃灭菌30 min(固体培养基在此基础上添加1.5%~2.0% 琼脂)。
1.3 试验方法
1.3.1 粗酶液制备 挑取单菌落转接于YEPD固体培养基上,于28 ℃培养28 h后,挑取单菌落接种于50mL种子培养基中,于28 ℃、250 r/min条件下培养20 h,以5%的接种量接种于95 mL发酵培养基中,再于28 ℃、180 r/min条件下培养约96 h,冷冻离心(4 ℃、8 000 r/min、15 min)后取上清,4 ℃冰箱保存备用。
1.3.2 硫酸铵沉淀法 取6组500 mL粗酶液,分别加入硫酸铵至饱和度分别为10%、20%、40%、60%、80%、100%,混匀后于4 ℃过夜,4 ℃、8 000 r/min离心15 min,弃上清,将沉淀溶于0.05 mol/L、pH值为6.2的磷酸盐缓冲液中,即得粗酶液。测定重组凝乳酶活力及蛋白含量,计算回收率。
1.3.3 乙醇沉淀法 取500 mL粗酶液,按不同体积比分别缓慢加入预冷乙醇中,4 ℃沉淀过夜,8 000 r/min离心 15 min,弃上清,将沉淀溶于0.05 mol/L、pH值为6.2的磷酸盐缓冲液中,得到粗酶液;4 ℃沉淀2 h,8 000 r/min离心 15 min,弃上清,将沉淀溶于0.05 mol/L、pH值为6.2的磷酸盐缓冲液中,得到粗酶液。测定重组凝乳酶活力及蛋白含量,计算回收率。
1.3.4 重组凝乳酶原十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分析表达产物 以发酵培养基作为参照物,将硫酸铵沉淀、乙醇沉淀所得的粗酶液通过SDS-PAGE(12%)电泳检测表达产物[12]。
1.3.5 凝乳酶活性测定方法 用1 mol/L H2SO4将粗酶液的pH值调整至2.0,室温条件下放置2 h,然后用2 mol/L三羟甲基氨基甲烷(Tris)调上清液的pH值至6.0。采用Arima等的方法[12]进行凝乳酶活力的测定,用0.01 mol/L CaCl2液配制10%脱脂乳,该溶液配制后在室温放置40 min后使用,取2 mL 10%脱脂奶粉液于35 ℃保温10 min。加1 mL稀释的酶液(酶液于35 ℃保温),摇匀并计时,观察到管壁上开始出现凝乳颗粒为终点,记录凝乳时间。在上述条件下,40 min凝结1 mL 10%脱脂奶粉的酶量定义为1个Soxhlet单位(SU)。
酶活力=供试乳数量÷凝乳酶量×D×2 400÷T。
式中:D为酶液稀释倍数;T为反应时间,s。
凝乳酶回收率=沉淀液凝乳酶活性/粗酶液凝乳酶活性×100%。
1.3.6 凝乳酶蛋白含量测定方法 运用BCA蛋白浓度测定试剂盒测定目的蛋白质浓度。在碱性条件下,蛋白质将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的络合物,测定其在562 nm处的吸光度值D562 nm,并与标准曲线对比,即可计算待测蛋白的浓度。具体操作按照TaKaRa BCA Protein Assay Kit说明书进行。
2 结果与分析
确定合适的沉淀方法是提高外源表达凝乳酶得率的关键步骤,为此本研究比较了乙醇和硫酸铵沉淀法对重组菌株外源表达凝乳酶的粗提效果。
2.1 硫酸铵沉淀和乙醇沉淀所得粗产物的比较
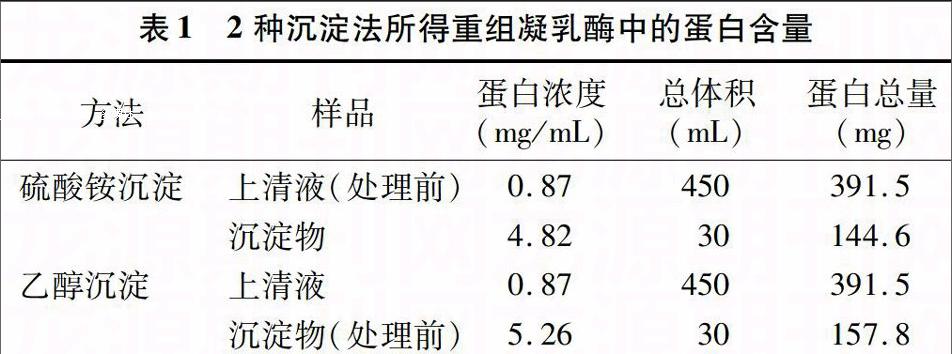
由表1可以看出,乙醇沉淀法与硫酸铵沉淀法相比,获得的蛋白总量相差不是很大,乙醇沉淀法的得率为40.31%,高于硫酸铵沉淀法的得率36.93%,是1种更加有效的沉淀方法。
表1 2种沉淀法所得重组凝乳酶中的蛋白含量
方法 样品 蛋白浓度
(mg/mL) 总体积
(mL) 蛋白总量
(mg)
硫酸铵沉淀 上清液(处理前) 0.87 450 391.5
沉淀物 4.82 30 144.6
乙醇沉淀 上清液 0.87 450 391.5
沉淀物(处理前) 5.26 30 157.8
注:蛋白得率=沉淀物中蛋白总量/上清液蛋白总量×100%。
2.2 硫酸铵沉淀法和乙醇沉淀法粗产物活性的比较
活性评价是纯化方法的1个重要评价指标。采用Arima等的方法进行凝乳酶活的测定,重复3次并取3次重复的平均值,结果如表2所示。
表2 2种沉淀方法的重组凝乳酶活性比较
样品 蛋白浓度
(mg/mL) 蛋白总量
(mg) 酶活性
(AU) 比活性
(AU/mg) 效价
(AU/mL)
硫酸铵沉淀物 4.82 144.6 523.6 108.630 705 4 523.6
乙醇沉淀物 5.26 157.8 667.3 126.863 117 9 667.3
表2结果表明,乙醇沉淀法所得粗产物的单位效价是硫酸铵沉淀法的1.27倍,且乙醇沉淀法所得产物的比活性提高了16.78%。可以看出,利用乙醇沉淀法可以避免硫酸铵沉淀法所带来的盐离子浓度高的影响,减少后续的纯化工艺,是1种针对外源表达凝乳酶较理想的沉淀方法。
2.3 不同饱和度硫酸铵及乙醇对重组凝乳酶分离效果的影响
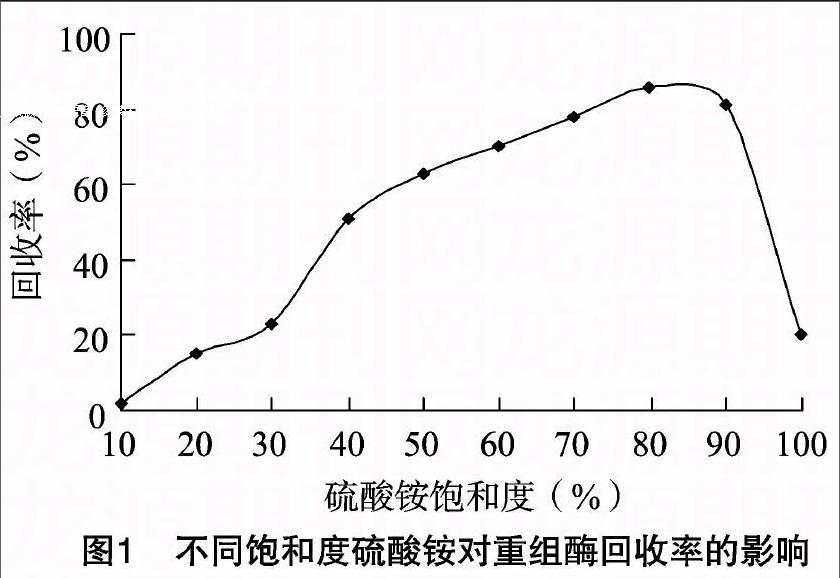
重组凝乳酶在胞外分泌表达中有许多蛋白分泌到胞外。去除杂蛋白是确定酶活性稳定的要素。选用不同饱和度硫酸铵盐析或乙醇沉淀发酵液,考察它们对重组凝乳酶回收率的影响,结果如图1 所示。
图1表明,不同饱和度硫酸铵对重组凝乳酶回收率影响较大。硫酸铵饱和度在20%~30%范围内时,回收率变化不大;随着硫酸铵饱和度增加,酶活回收率呈增大趋势, 在80%
时重组凝乳酶活性回收率最高,达到86%;饱和度大于80%时,酶活回收率迅速降低。
由图2可知,在发酵液中乙醇含量在20%以内时,回收率变化不大;在20%~50%范围内,随着乙醇含量增加,回收率逐渐提高;在50%时,回收率约为84%;超过50%时,酶活回收率下降。
2.4 SDS-PAGE电泳分析比较硫酸铵和乙醇沉淀法
将重组菌株km2在发酵培养基中培养96 h后所得上清液用硫酸铵和乙醇沉淀并稀释后,得到蛋白质溶液,用pH值为2.0的HCl进行酸化处理,通过SDS-PAGE电泳检测,结果如图3所示。
图3表明,经过酸化处理后,重组凝乳酶的蛋白分子量约36 ku。与发酵上清液相比,乙醇法沉淀物和硫酸铵法沉淀物均得到一定的浓缩,乙醇法沉淀后所得的蛋白含量略高于硫酸铵法沉淀。
3 结论
硫酸铵沉淀法是利用在高离子强度的溶液中,通过增加蛋白质的疏水作用,使得蛋白质趋于聚集,达到溶解极限使蛋白沉淀析出的目的。硫酸铵的性质比较温和,不容易引起蛋白的失活,能够较大程度地保持蛋白的活性,是运用最广泛的沉淀方法[13]。利用基因重组法获得总蛋白沉淀后需要经纯化才能得到目的蛋白,硫酸铵法沉淀过程中引入盐离子,盐析次数多[14],导致后续蛋白纯化时增加了去盐步骤,从而加大了目的蛋白的损失率,因此,乙醇沉淀法更适合基因工程产物的沉淀。
本研究利用乙醇沉淀法提取重组凝乳酶胞外表达产物,相对于硫酸铵沉淀法能够更加有效地从发酵液中沉淀蛋白。以500 mL发酵液为例,利用乙醇沉淀法比硫酸铵沉淀法的得率提高了3.38百分点,得到的重组凝乳酶粗产物的比活性提高了16.78%。可见乙醇沉淀法简便高效,是1种针对重组凝乳酶粗提的合适、有效的沉淀方法。
参考文献:
[1]Visser S. Proteolytic enzymes and their relation to cheese ripening and flavor: an overview[J]. Journal of Dairy Science,1993,76(1):329-350.
[2]刘文宗,蒋 敏,何晓霞,等. 干酪凝乳酶代用品研究[J]. 四川畜牧兽医学院学报,2001,15(2):23-27.
[3]Tavares J F,Baptista J A,Marcone M F. Milk-coagulating enzymes of tuna fish waste as a rennet substitute[J]. International Journal of Food Sciences and Nutrition,1997,48(3):169-176.
[4]苑艳辉. 水产品下脚料综合利用研究之进展[J]. 水产科技情报,2004,31(1):44-48.
[5]Haard N F. A review of proteotlytic enzymes from marine organisms and their application in the food industry[J]. Journal of Aquatic Food Product Technology,1992,1(1):17-35.
[6]顾瑞霞,申 戈. 凝乳酶及其代用品[J]. 中国乳品工业,1991(1):20-23.
[7]薛彦斌. 树木凝乳酶的研究与应用[J]. 中国乳品工业,1990(3):130-132.
[8]张富新,杨宝进. 植物凝乳酶凝乳特性的研究[J]. 黄牛杂志,1997(1):27-29.
[9]宋 云,李立钊,崔雅洁,等. 不同因素对凝乳酸活力的影响[J]. 中国乳品工业,1995,23(3):124-128.
[10]张富新,田呈瑞. 木瓜蛋白酶凝乳特性的研究[J]. 西北农业大学学报,1997,25(2):111-114.
[11]高维东,甘伯中,丁福军,等. 微生物凝乳酶的研究进展[J]. 中国乳品工业,2009,37(5):34-36,47.
[12]Arima K,Yu J,Iwasaki S. Methods in enzymology[M]. New York and London:Academic Press,1970:446-459.
[13]Saavedra L,Castellano P, Sesma F. Purification of bacteriocins produced by lactic acid bacteria[J]. Methods Mol Biol, 2004,268:331-336.
[14]Siegelman H W, Kycia J H. Algal biliproteins: handbook of phycological method[M]. Cambridge: Cambridge University Press,1978:71-79.

