土壤中痕量氨基甲酸酯和三唑类农药的样品提取方法研究
张 晶, 饶 竹, 刘 艳, 李晓洁, 黄 毅
(1.中国地质大学(武汉)材料与化学学院, 湖北 武汉 430074; 2.国家地质实验测试中心, 北京 100037; 3.北京莱伯泰科仪器有限公司, 北京 101312)
土壤中痕量氨基甲酸酯和三唑类农药的样品提取方法研究
张 晶1,2, 饶 竹2*, 刘 艳3, 李晓洁2, 黄 毅2
(1.中国地质大学(武汉)材料与化学学院, 湖北 武汉 430074; 2.国家地质实验测试中心, 北京 100037; 3.北京莱伯泰科仪器有限公司, 北京 101312)
本文对比研究了QuEChERS、加速溶剂萃取和超声提取三种方法,结合液相色谱-串联质谱法解决了土壤中18种极性强、热稳定性差的痕量氨基甲酸酯和三唑类农药提取难题。研究表明,QuEChERS法的基体加标回收率为76.3%~121.0%(除涕灭威为27.5%外),超声提取法为71.0%~100.0%(除涕灭威为4.7%,涕灭威亚砜为137.8%外),加速溶剂萃取法大多低于70%(甲硫威、涕灭威、三唑醇几乎没有回收),可见QuEChERS法比另两种提取方法结果更优,最终确定为检测氨基甲酸酯类和三唑类农药的样品提取方法。涕灭威回收率偏低、涕灭威亚砜回收率偏高与提取方法的热效应有关;仲丁威、甲萘威等组分的回收状况与土壤类型相关。
土壤; 氨基甲酸酯; 三唑类农药; QuEChERS提取; 液相色谱-串联质谱法
氨基甲酸酯和三唑类农药极性较强、热稳定性差,是目前广泛使用的广谱除草剂和高效杀菌剂、植物调节剂。然而,有证据表明氨基甲酸酯和三唑类杀菌剂农药对人体的内分泌、脊椎动物健康存在潜在毒性风险,特别是部分氨基甲酸酯农药的降解产物比原药具有更大毒性和持久性[1-2]。土壤是农药残留的储存库,加速溶剂萃取(ASE)和超声提取(UE)是土壤样品中农药提取的主要方法[3-4]。QuEChERS方法是2003年Anastassiades等[5]提出的一种针对蔬菜、水果样品中农药多残留检测的一种快速分析方法,它主要采用极性乙腈缓冲溶液匀浆提取样品,样品提取液经离心分离、分散固相萃取净化,离心后直接测定[6-9]。迄今QuEChERS方法已在生物、植物样品中应用较为广泛[10-11],但在土壤样品中应用很少,这是因为土壤对一般污染物有强烈吸附力,造成待测污染物回收率偏低。本文采用ASE、UE尝试提取土壤样品中的痕量氨基甲酸酯和三唑类农药,但其回收率偏低,这与ASE、UE属于热抽提方法、不适用于热稳定性差的目标物分析有关。在此基础上利用QuEChERS方法常温提取的特点,对提取溶剂和提取器皿进行了优化和改进,结合液相色谱-电喷雾串联质谱(LC-MS/MS)进行检测,基体加标回收率有所提高,此方法适用于土壤中一些极性较强、热稳定较差的有机污染物的分析。
1 实验部分
1.1 仪器
美国Agilent公司1200系列高效液相色谱仪;美国AB公司API 4000三重四极杆串联质谱仪配电喷雾离子源;Dionex ASE 200型加速溶剂萃取仪(美国戴安公司);40 mL棕色玻璃瓶,带内衬有聚四氟乙烯膜的螺旋盖。
1.2 空白土壤样品、标准物质和主要试剂
空白土壤样品:采自北京郊区,不含待测目标物,阴干,混匀过40目筛。
土壤标准物质:ASA-1a(辽宁棕壤)、ASA-3a(四川紫色土)、ASA-5a(江西红壤)、ASA-6a(广东水稻土)、ASA-9(陕西黄绵土),均购自中国地质科学院地球物理地球化学勘查研究所。
18种氨基甲酸酯及其降解产物、三唑类农药单体标准品(100 mg/L,均购自中国计量科学研究院)。
内标物:甲萘威-D3、涕灭威-D3、戊唑醇-D6(100 mg/L,均购自德国Dr.E公司)。
替代物:氟康唑-D4(100 mg/L,德国Dr.E公司),4-溴-3,5-二甲苯基-N-甲基氨基甲酸酯(BDMC,100 mg/L,百灵威化学有限公司)。
乙腈、甲醇、丙酮、二氯甲烷(HPLC级,百灵威化学有限公司)。
1.3 实验方法
1.3.1 加速溶剂萃取实验方法
准确称取5.00 g空白土壤样品和3.00 g硅藻土置于50 mL小烧杯中,搅拌均匀后装入22 mL ASE不锈钢萃取池(萃取池底部加纤维滤膜),加入目标化合物和替代物标准氟康唑-D4和BDMC,将萃取池置于加速溶剂萃取仪上用乙腈进行样品的提取,提取温度为70℃,静态提取时间5 min,循环次数3次,冲洗体积60%,氮气吹扫时间60 s。提取液经旋转蒸发浓缩和氮气吹干后,以甲醇-水(V∶V=1∶1)定容至1mL,0.22μm滤膜过滤,待LC-MS/MS测定,内标法定量。
1.3.2 超声提取实验方法
准确称取5.00g空白土壤样品于40mL棕色玻璃瓶中,加入目标化合物和替代物标准氟康唑-D4和BDMC,涡旋混匀后加入20mL提取溶剂乙腈。将玻璃瓶盖旋紧后置于超声波机中在室温下提取15min后涡旋1min,重复上述过程两次后离心15min(转速3000r/min),取上清液4mL氮气吹干,以甲醇-水(V∶V=1∶1)定容至1mL,0.22μm滤膜过滤,待LC-MS/MS测定,内标法定量。
1.3.3QuEChERS提取实验方法
准确称取5.00g空白土壤样品于40mL棕色玻璃瓶中,加入目标化合物和替代物标准氟康唑-D4、BDMC和20mL提取溶剂丙酮-二氯甲烷(V∶V=1∶1)涡旋混匀。旋紧玻璃瓶盖后置于振荡器上以230r/min振荡60min后离心20min(转速3000r/min)。取上清液4mL氮气吹干,以甲醇-水(V∶V=1∶1)定容至1mL,0.22μm滤膜过滤,待LC-MS/MS测定,内标法定量[12]。
1.3.4 净化方法
分散固相萃取(d-SPE)净化:称取150mg的N-丙基乙二胺(PSA)、200mg石墨化碳黑(GCB)和500mg无水硫酸镁于15mL聚丙烯离心管中,取离心后的提取液上清液8mL加入含上述吸附剂的离心管中涡旋振荡1min后离心20min(流速3000r/min),取上清液4mL,氮气吹干,以1mL甲醇-水(V∶V=1∶1)定容,待LC-MS/MS测定。
氨基SPE净化:将目标物的混合标准溶液加入2mL甲醇-二氯甲烷(V∶V=1∶99)中制成模拟加标提取液,将其加到氨基固相萃取柱(使用前先用4mL上述甲醇-二氯甲烷活化)中重力过柱;用2mL甲醇-二氯甲烷(V∶V=1∶99)洗涤盛放模拟提取液的离心管,并将洗涤液加入固相萃取柱,重复操作两次;收集各段洗脱液后氮吹,浓缩至干,以甲醇-水(V∶V=1∶1)定容至1mL,0.22μm滤膜过滤,待LC-MS/MS测定。
1.3.5 液相色谱-质谱分析条件
色谱条件:Waterscarbamate专用分析柱(4.6mm×150mm;5μm),柱温30℃。流动相:A为水相,B为甲醇相;流速0.3mL/min;进样量40μL。
质谱条件:离子源为ESI(电喷雾);电离模式为正离子;电喷雾电压IS5000V;离子源温度400℃;碰撞气压力68.9kPa;气帘气压力68.9kPa;雾化气压力137.9kPa;扫描方式为多反应选择离子监测方式,各监测离子对及其质谱参数见文献[12]。
2 结果与讨论
2.1ASE提取方法对检测结果的优化
温度、提取溶剂是ASE提取的重要分析条件,其中温度对热稳定性差的目标物有着更关键的影响。本文重点对ASE提取温度进行了优化,设定ASE提取温度为60~130℃,考察温度对基体加标样品回收率的影响。实验结果显示,三唑类杀菌剂基体加标回收率随温度升高而降低;氨基甲酸酯杀虫剂在70~100℃范围内萃取效率相对较高(43.8%~87.4%,甲硫威几乎没有回收),在温度超过100℃后绝大多数目标物回收率快速降低(38.0%~65.7%,甲硫威几乎没有回收),可能与高温下目标物发生了热降解有关。实验选择70℃作为ASE提取温度可达到较好的回收效果。
2.2QuEChERS提取方法的优化
2.2.1 提取溶剂的优化
本文对提取溶剂进行优化,分别考察甲醇、乙腈、乙腈-甲醇(V∶V=2∶1)、丙酮、丙酮-二氯甲烷(V∶V=3∶1)等多种提取溶剂对土壤中农药组分提取率的影响(图1)。实验结果表明丙酮对所有目标物的提取回收率普遍偏低;甲醇、乙腈-甲醇对氨基甲酸酯类农药的回收率偏低;使用乙腈的基体加标回收率变化比较大(48.1%~125.9%),如涕灭威亚砜为48.1%,三羟基克百威、涕灭威砜、丙环唑、戊唑醇和己唑醇等超过120%;而丙酮-二氯甲烷的基体加标回收率保持在65.2%~113.9%之间,满足分析要求。因此,实验选择丙酮-二氯甲烷(V∶V=3∶1)作为QuEChERS方法的提取溶剂。

图 1QuEChERS提取溶剂对目标物回收率的影响
Fig.1EffectofthesolventofQuEChERSextractiononrecoveriesoftargetcompounds
2.2.2 净化方法的优化
基质效应对液质联用的定量分析会产生较大的影响,在复杂基质的多农残检测中很有必要对其净化方法进行研究。将Anastassiades等[5]建立的d-SPE和目前应用广泛效果较好的氨基SPE小柱净化的回收率进行对比,对模拟的样品提取液进行d-SPE和SPE净化实验,考察净化效果。结果表明:d-SPE净化回收率在75.1%~108.7%之间,同SPE净化结果相当。d-SPE净化操作简单易于掌握,不需要额外消耗有机溶剂,其成本与SPE相比降低了数倍,样品通量大,因此实验选择d-SPE对样品提取液进行净化。
2.3 三种提取方法对比研究
2.3.1 三种提取方法的回收率对比
在上述优化的条件下分别采用ASE、UE和土壤QuEChERS方法对加标浓度为10μg/kg的18种氨基甲酸酯和三唑类农药土壤样品进行了提取和LC-MS/MS测定,测定结果见表1。总体来看,ASE提取目标物的回收率普遍较低,除甲萘威、涕灭威亚砜、三羟基克百威达到70%以上外,大多数目标物回收率不能满足分析要求,特别是甲硫威、涕灭威、三唑醇三种组分几乎没有回收。这可能与ASE属较高温压条件下萃取,造成热稳定性差的氨基甲酸酯、三唑类农药发生降解有关。UE的基体加标回收率除涕灭威为4.7%、涕灭威亚砜为137.8%之外,其他组分回收率为71.0%~100.0%。可见改进后的QuEChERS方法比另两种提取方法结果更优,除涕灭威回收率仍然偏低外(27.5%),其他组分回收率均为76.3%~121.0%,能够用于土壤中氨基甲酸酯类和三唑类农药的提取,推断与氨基甲酸酯类和三唑类农药既具有较强极性又具有一定脂溶性,易于从土壤转移到丙酮-二氯甲烷这种极性和亲酯较强的溶剂中有关。
表 1 三种提取方法加标回收率对比
Table1Comparisonofspikedrecoveriesfortargetsusingdifferentsampleextractionmethods
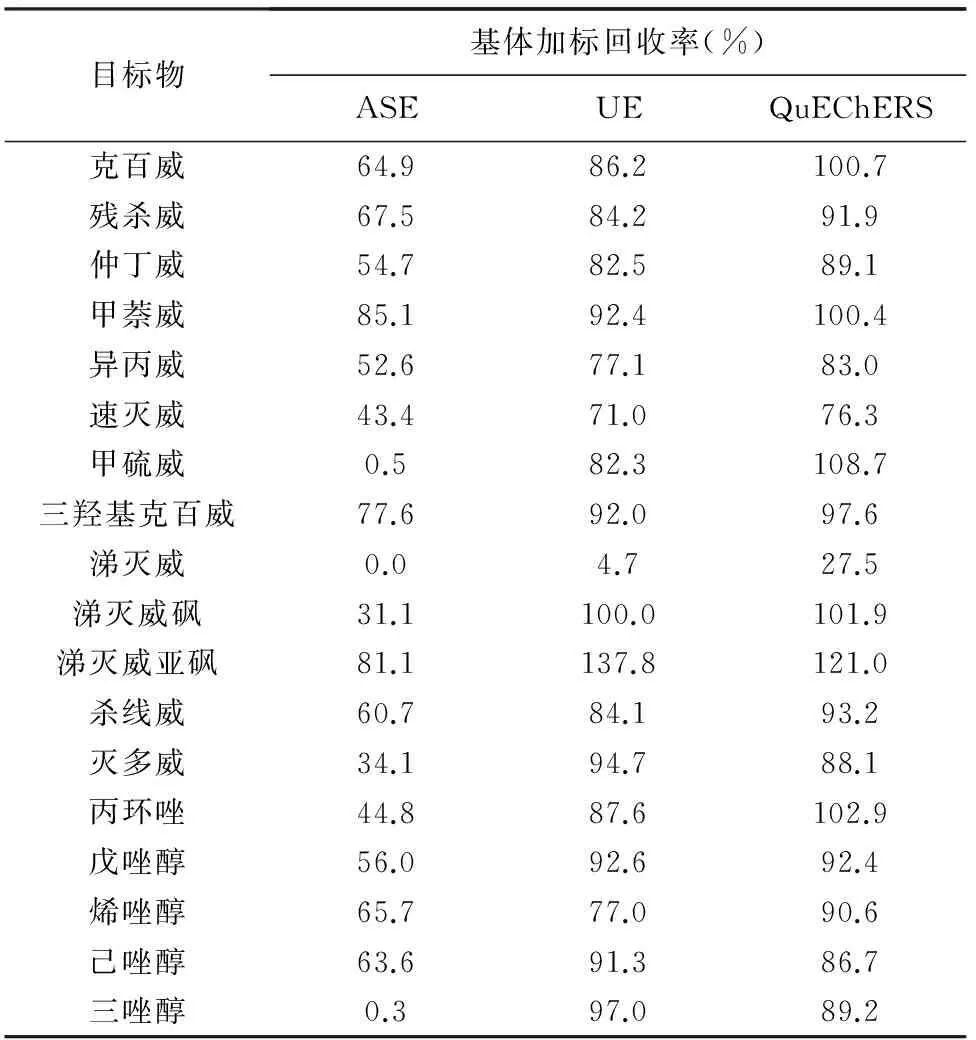
目标物基体加标回收率(%)ASEUEQuEChERS克百威64.986.2100.7残杀威67.584.291.9仲丁威54.782.589.1甲萘威85.192.4100.4异丙威52.677.183.0速灭威43.471.076.3甲硫威0.582.3108.7三羟基克百威77.692.097.6涕灭威0.04.727.5涕灭威砜31.1100.0101.9涕灭威亚砜81.1137.8121.0杀线威60.784.193.2灭多威34.194.788.1丙环唑44.887.6102.9戊唑醇56.092.692.4烯唑醇65.777.090.6己唑醇63.691.386.7三唑醇0.397.089.2
2.3.2 提取热效应对涕灭威、涕灭威亚砜回收率的影响
通过ASE、UE、QuEChERS三种提取方法对涕灭威、涕灭威亚砜对比研究发现,涕灭威稳定性非常差,极易受热转变成涕灭威亚砜。ASE属于加热提取,涕灭威受热分解并部分转化成涕灭威亚砜,而且涕灭威亚砜也存在部分热分解,回收率仅达到81.1%;UE虽然不加热,但它也存在一定的热效应,导致涕灭威回收率较低仅有4.7%,涕灭威亚砜则偏高达到137.8%;QuEChERS法采用振荡提取,热效应不显著,涕灭威回收率有较大提高(27.5%),但仍然存在降解,使得涕灭威亚砜回收率偏高至121.0%,也还在正常范围内(图2)。因此,可以用涕灭威、涕灭威砜和涕灭威亚砜三者总量来表征涕灭威总污染水平。
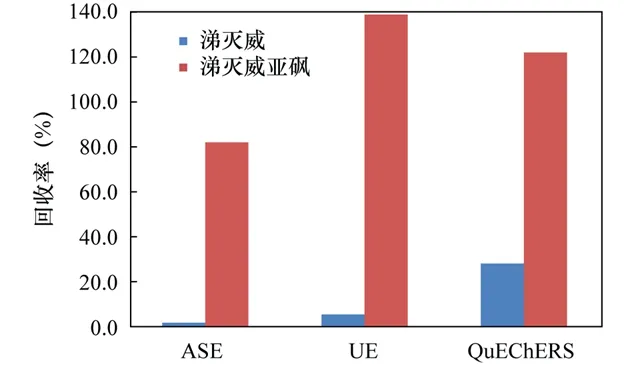
图 2 提取方法对涕灭威、涕灭威亚砜检测结果的影响Fig.2 Effect of different extraction methods on the spiked recoveries of aldicarb and aldicarb sulfoxide
表 2 目标物的线性范围、回归方程、相关系数、检出限及精密度
Table2Linearranges,regressionequation,correlationcoefficients,detectionlimitsandprecisionoftargetcompounds
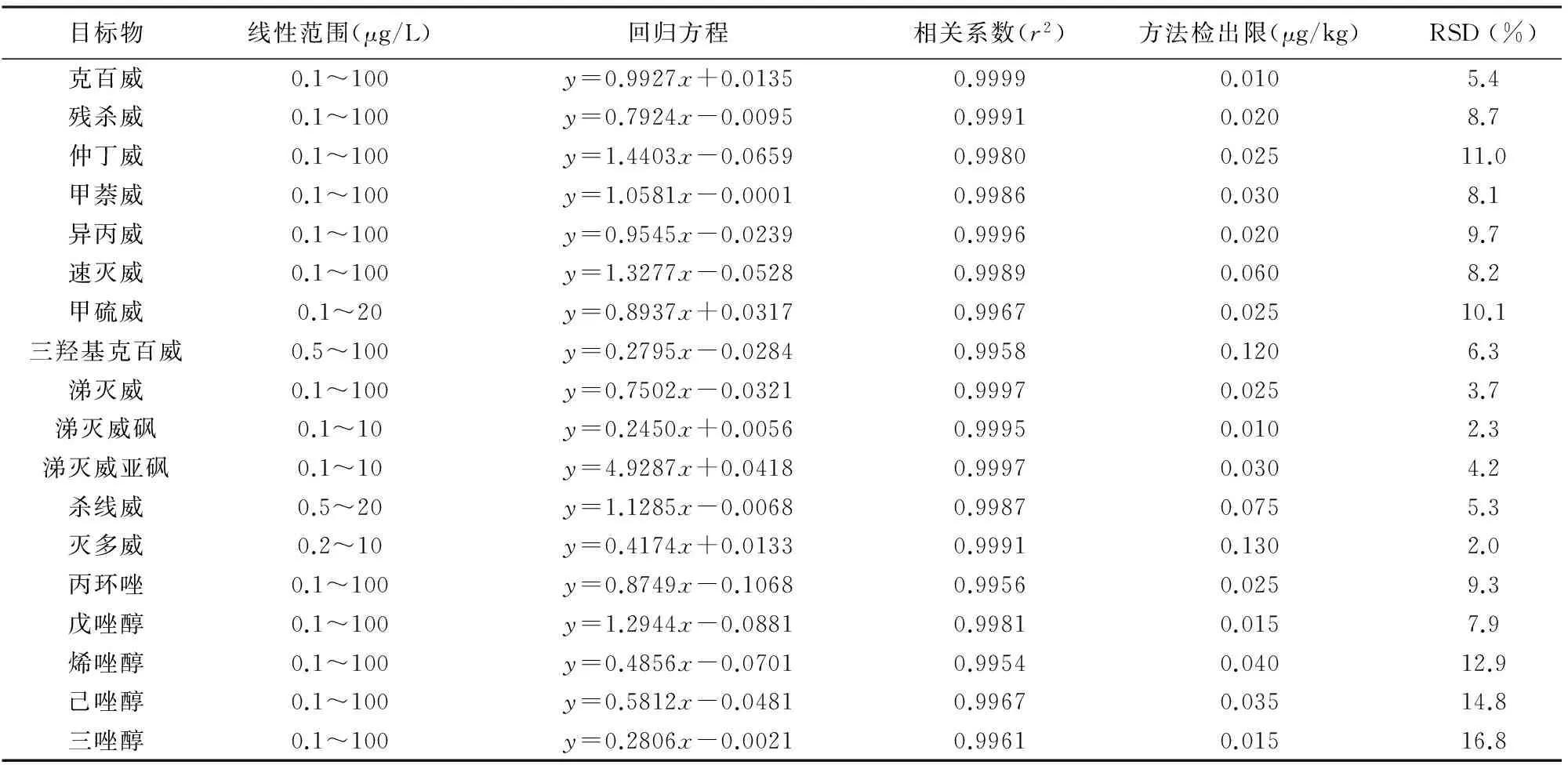
目标物线性范围(μg/L)回归方程相关系数(r2)方法检出限(μg/kg)RSD(%)克百威0.1~100y=0.9927x+0.01350.99990.0105.4残杀威0.1~100y=0.7924x-0.00950.99910.0208.7仲丁威0.1~100y=1.4403x-0.06590.99800.02511.0甲萘威0.1~100y=1.0581x-0.00010.99860.0308.1异丙威0.1~100y=0.9545x-0.02390.99960.0209.7速灭威0.1~100y=1.3277x-0.05280.99890.0608.2甲硫威0.1~20y=0.8937x+0.03170.99670.02510.1三羟基克百威0.5~100y=0.2795x-0.02840.99580.1206.3涕灭威0.1~100y=0.7502x-0.03210.99970.0253.7涕灭威砜0.1~10y=0.2450x+0.00560.99950.0102.3涕灭威亚砜0.1~10y=4.9287x+0.04180.99970.0304.2杀线威0.5~20y=1.1285x-0.00680.99870.0755.3灭多威0.2~10y=0.4174x+0.01330.99910.1302.0丙环唑0.1~100y=0.8749x-0.10680.99560.0259.3戊唑醇0.1~100y=1.2944x-0.08810.99810.0157.9烯唑醇0.1~100y=0.4856x-0.07010.99540.04012.9己唑醇0.1~100y=0.5812x-0.04810.99670.03514.8三唑醇0.1~100y=0.2806x-0.00210.99610.01516.8
注:x表示目标物浓度/内标物浓度;y表示目标物峰面积/内标物峰面积。
2.4 QuEChERS方法的技术指标和验证
2.4.1 QuEChERS方法的线性范围、检出限与精密度
配制不同浓度水平的目标物混合标准系列溶液,得到各目标物的线性范围、线性相关系数及回归方程;以空白土壤样品为基质进行低浓度水平加标实验,依据美国EPA方法计算各目标物的方法检出限,结果见表2。在10 μg/kg的土壤添加浓度水平进行8次平行实验,相对标准偏差(RSD)在2.0%~16.8%之间(表2)。
2.4.2 不同类型土壤对QuEChERS方法提取结果的影响
选取辽宁棕壤、四川紫色土、江西红壤、广东水稻土、陕西黄绵土等5种不同类型的土壤标准样品进行加标回收实验(每种土壤类型均设平行样S1、S2),加标浓度10 μg/kg,实验结果见表3。结果表明克百威、残杀威、异丙威、速灭威、三羟基克百威、涕灭威砜、涕灭威亚砜、杀线威、灭多威等组分的基体加标回收率为63.6%~114.7%,基本满足分析测试要求,其基体加标回收率与土壤类型相关性不大;而仲丁威、甲萘威、甲硫威、丙环唑、戊唑醇、烯唑醇、己唑醇、三唑醇等组分的基体加标回收率为13.2%~145.3%,显著与土壤类型相关,如广东水稻土中己唑醇的基体加标平均回收率仅为19.9%,而四川紫色土的基体加标平均回收率则达到74.0%;热稳定性差的涕灭威则在5种土壤类型中基体加标回收率均不理想,最高仅为21.3%。因此,在实际样品测试过程中要充分考虑样品基质对检测结果的影响。
3 结论
本文在对比ASE、UE和QuEChERS三种提取方法的基础上,研究优化了QuEChERS法提取土壤样品中18种痕量氨基甲酸酯和三唑类农药的方法。优化后的QuEChERS方法与ASE、UE相比提取效果更理想,17种组分回收率在76.3%~121.0%之间,涕灭威回收率也有明显提高,涕灭威亚砜回收率降至正常水平。研究还表明涕灭威回收率偏低、涕灭威亚砜回收率偏高与提取方法的热效应有关;部分组分如仲丁威、甲萘威的回收状况与土壤类型相关。总之,尽管QuEChERS方法在土壤的应用中受到一定限制,但本文研究结果表明优化后的QuEChERS方法还是可以应用于土壤中一些极性较强、热稳定较差的有机污染物的快速分析。
表 3 不同类型土壤样品的加标回收率
Table 3 Spiked recoveries of different soil types
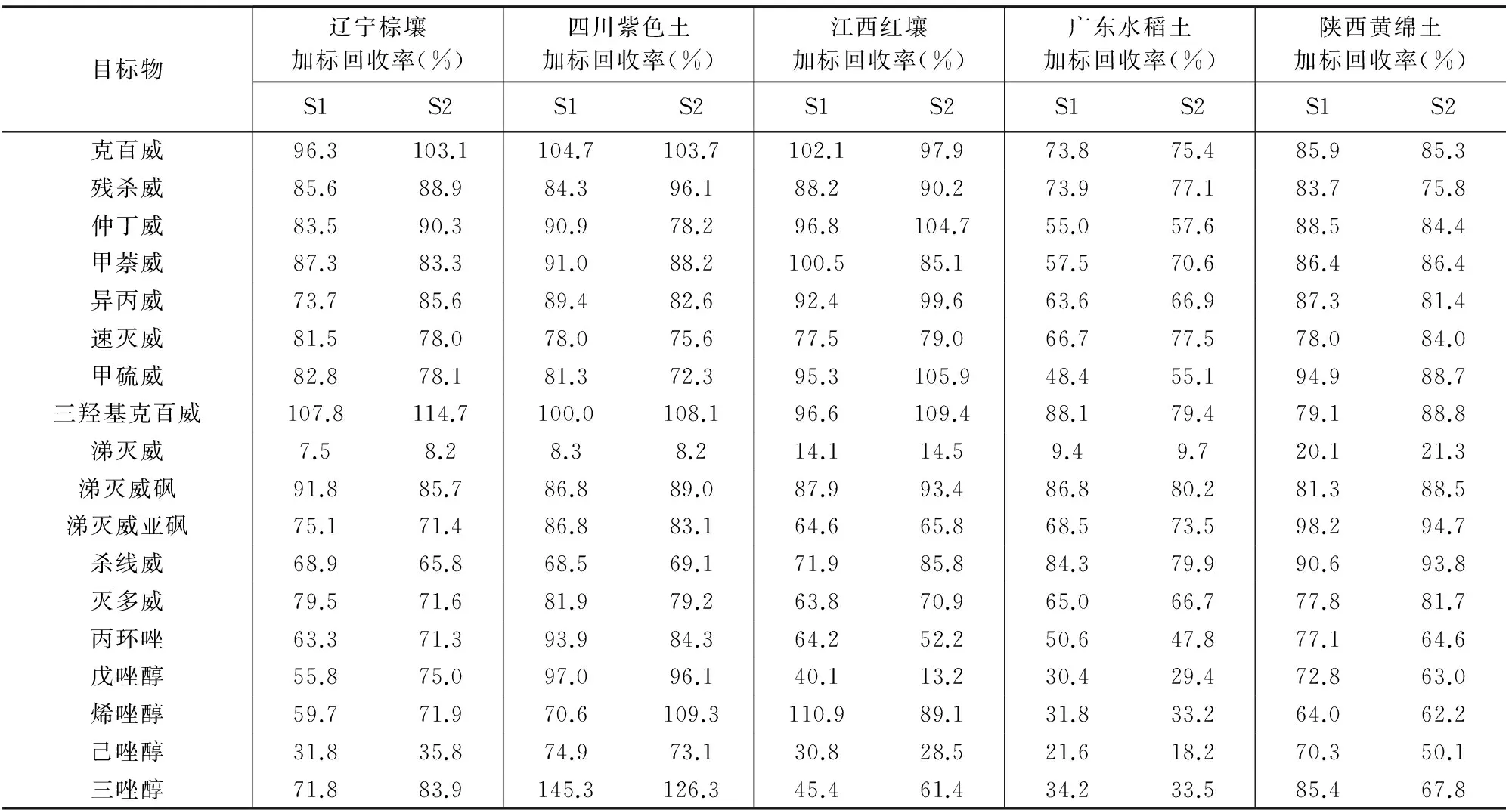
目标物辽宁棕壤加标回收率(%)四川紫色土加标回收率(%)江西红壤加标回收率(%)广东水稻土加标回收率(%)陕西黄绵土加标回收率(%)S1S2S1S2S1S2S1S2S1S2克百威96.3103.1104.7103.7102.197.973.875.485.985.3残杀威85.688.984.396.188.290.273.977.183.775.8仲丁威83.590.390.978.296.8104.755.057.688.584.4甲萘威87.383.391.088.2100.585.157.570.686.486.4异丙威73.785.689.482.692.499.663.666.987.381.4速灭威81.578.078.075.677.579.066.777.578.084.0甲硫威82.878.181.372.395.3105.948.455.194.988.7三羟基克百威107.8114.7100.0108.196.6109.488.179.479.188.8涕灭威7.58.28.38.214.114.59.49.720.121.3涕灭威砜91.885.786.889.087.993.486.880.281.388.5涕灭威亚砜75.171.486.883.164.665.868.573.598.294.7杀线威68.965.868.569.171.985.884.379.990.693.8灭多威79.571.681.979.263.870.965.066.777.881.7丙环唑63.371.393.984.364.252.250.647.877.164.6戊唑醇55.875.097.096.140.113.230.429.472.863.0烯唑醇59.771.970.6109.3110.989.131.833.264.062.2己唑醇31.835.874.973.130.828.521.618.270.350.1三唑醇71.883.9145.3126.345.461.434.233.585.467.8
[1] Trosken E R,Straube E,Lutz W K.Quantitation of Lanosterol and Its Major Metabolite FF-MAS in an Inhibition Assay of CYP51 by Azoles with Atmospheric Pressure Photoionization Based LC-MS/MS[J].Journal of the American Society for Mass Spectrometry,2004,15(8):1216-1221.
[2] 谢慧,朱鲁生,王军,等.涕灭威及其有毒代谢产物对土壤微生物呼吸作用的影响[J].农业环境科学学报,2005,24(1):191-195.
Xie H,Zhu L S,Wang J,et al.Effects of Aldicarb and Its Toxic Metabolites on Soil Respiration[J].Journal of Agro-Environment Science,2005,24(1):191-195.
[3] 饶竹.环境有机污染物检测技术及其应用[J].地质学报,2011,85(11):1948-1962.
Rao Z.Application Research of Environmental Organic Pollutants Test Techniques[J].Acta Geologica Sinica,2011,85(11):1948-1962.
[4] Pan D,Wang G P,Chen C Y,et al.Ultrasonic Assisted Extraction Combined with Titanium-plate Based Solid Phase Extraction for the Analysis of PAHs in Soil Samples by HPLC-FLD[J].Talanta,2013,108:117-122.
[5] Anastassiades M,Lehotay S J, tajnbaher D,et al.Fast and Easy Multiresidue Method Employing Acetonitrile Extraction/Partitioning and Dispersive Solid-Phase Extraction for the Determination of Pesticide Residues in Produce[J].Journal of AOAC International,2003,86 (2):412-431.
[6] Pragney D,Tirupathi A,Sanjit K,et al.LC-MS/MS Determination of Organophosphorus Pesticide Residues in Coconut Water [J].Food Analytical Methods,2013,6:1162-1169.
[7] Angelika W,Marek B.Determination of Pesticide Residues in Food Matrices Using the QuEChERS Methodology[J]. Food Chemistry,2011,125(3):803-812.
[8] Juliana S M,Giovana F,Lucila C R,et al.Development of a Multiresidue Method for the Determination of Endocrine Disrupters in Fish Fillet Using Gas Chromatography-Triple Quadrupole Tandem Mass Spectrometry[J].Talanta,2013,116:827-834.
[9] Rahman M M, El-Aty A M,Park J H,et al.Single-step Modified QuEChERS for Determination of Chlorothalonil in Shallot (Allium ascalonicum) Using GC-μECD and Confirmation via Mass Spectrometry[J]. Biomedical Chromatography,2013,27(4):416-421.
[10] Wang J,Chow W,Leung D.Applications of LC/ESI-MS/MS and UHPLC QqTOFMS for the Determination of 148 Pesticides in Fruits and Vegetables[J].Analytical and Bioanalytical Chemistry,2010,396:1513.
[11] Ozgur G,Bulent K.Determination of 115 Pesticide Resi-dues in Oranges by High-performance Liquid Chromatography-Triple-Quadrupole Mass Spectrometry in Combination with QuEChERS Method[J]. Journal of Food Composition and Analysis,2015,41:86-97.
[12] Rao Z,Liu Y,Lu G H,et al. Determination of Carbama-te and Triazol Pesticides in Soil Using QuEChERS with Liquid Chromatography-Tandem Mass Spectrometry[J].Asian Journal of Chemistry,2014,26(19):6456-6460.
Sample Extraction Methods for Determining Trace Carbamate and Triazole Pesticides in Soil
ZHANGJing1,2,RAOZhu2*,LIUYan3,LIXiao-jie2,HUANGYi2
(1.Faculty of Materials Science and Chemistry, China University of Geosciences (Wuhan), Wuhan 430074, China; 2.National Research Center for Geoanalysis, Beijing 100037, China; 3.Beijing LabTech Instruments Co. LTD, Beijing 101312, China)
QuEChERS method, Accelerated Solvent Extraction (ASE) and Ultrasound Extraction (UE) were used for sample extraction and are reported in this paper. Combined with liquid chromatograph coupled with mass spectrometry, these extraction methods were used to determine eighteen kinds of trace carbamate and triazole pesticides in soil with strong polarity and poor thermal stability. Results show that the standard addition recoveries of the QuEChERS method range from 76.3% to 121.0% with the exception of aldicarb (27.5%), whereas those of UE ranged from 71.0% to 100.0% with the exception of aldicarb (4.7%) and aldicarb sulfoxide (137.8%). The recoveries of ASE are mostly below 70%, but methiocarb, aldicarb and triadimenol are almost not recovered. Therefore, the QuEChERS method was eventually chosen as the sample extraction method for determining carbamate and triazole pesticides. The low recovery of aldicarb and high recovery of aldicarb sulfoxide were related to the heating effect of the extraction method, whereas the recoveries of fenobucarb and carbaryl were related to soil types.
soil; carbamate pesticides; triazole pesticides; QuEChERS; LC-MS/MS
2015-01-06;
2015-08-26; 接受日期: 2015-09-05 基金项目: 国土资源部公益性行业科研专项(200911043-28); 中国地质大调查项目(1212010816028,12120115047601) 作者简介: 张晶,硕士研究生,分析化学专业。E-mail: jingzhang2015@163.com。
饶竹,研究员,主要从事有机地球化学的研究工作。E-mail: raozhu@126.com。
0254-5357(2015)06-0692-06
10.15898/j.cnki.11-2131/td.2015.06.014
S151.93; O657.63
A

