孕兔羊水栓塞补体C3a、凝血功能的研究
龙艳丽 ,胡 勇,余 舰,张丽娟,杨 阳
(1.贵州省人民医院 病理科,贵州 贵阳 550002;2.遵义医学院附属医院 司法医学鉴定中心,贵州 遵义 563099;3.遵义医学院 法医学系,贵州 遵义 563099)
基础医学研究
孕兔羊水栓塞补体C3a、凝血功能的研究
龙艳丽1,胡 勇2,余 舰2,张丽娟3,杨 阳3
(1.贵州省人民医院 病理科,贵州 贵阳 550002;2.遵义医学院附属医院 司法医学鉴定中心,贵州 遵义 563099;3.遵义医学院 法医学系,贵州 遵义 563099)
目的 通过孕兔羊水栓塞动物模型测定凝血功能、补体C3a的含量以及补体C3a在肺组织中的表达,初步探索羊水栓塞(AFE)的发病机制。方法 健康妊娠晚期孕兔随机分3组(对照组、羊水组、羊水胎粪组),暴露子宫抽取羊水、胎粪。按2.5 mL/Kg注入自体羊水、羊水胎粪混合液(羊水原液与胎粪按质量比配成1%混合液)入血,对照组注入等剂量生理盐水。注射30 min后取血分别用血凝仪测凝血功能(凝血酶原时间 (PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原 (FIB))及ELISA法测血浆补体C3a含量。取血后10%KCl处死孕兔,取孕兔双肺做病理学检查。结果 ①补体C3a浓度:羊水组、羊水胎粪组补体C3a含量降低(P<0.05);②凝血功能检查结果:PT、APTT、TT羊水组、羊水胎粪组延长(P<0.05),FIB羊水组、羊水胎粪组降低(P<0.05)。结论 ①发生AFE时补体C3a含量降低,说明补体系统被激活,消耗补体成分发生类过敏反应;②AFE时PT、TT、APTT均延长,FIB降低,说明AFE时有发展为DIC的趋势。
羊水栓塞;凝血功能;补体C3a;免疫组织化学染色;类过敏反应
羊水栓塞(Amniotic Fluid Embolism,AFE)是严重分娩并发症,至今仍然是威胁母亲生命健康的重要原因之一。AFE的发病率为4/10万~6/10万,发生于足月妊娠时产妇的死亡率高达80%[1]。AFE发病急、病程进展迅速、死亡率较高,使得对该病的病因、临床发展过程、发病机理的研究带来了一定的难度。本实验通过健康妊娠晚期家兔建立AFE动物模型,检测补体C3a含量、凝血功能以及补体C3a在AFE时肺组织中的表达来初步探讨AFE的发病机制。
1 材料与方法
1.1 实验动物 健康妊娠晚期家兔(购于重庆第三军医大学)体重4~5 kg,胎龄25~31 d。随机分为3组:正常组、羊水组、羊水胎粪组,每组各10只。
1.2 仪器 LEICA-RMEB5石蜡切片机 (德国LEICA公司)、普通光学显微镜(日本OLYMPUS公司)、酶标仪(Biotek公司(型号ELX800))、血凝仪。
1.3 试剂 补体C3a(兔抗人,北京博奥森公司)、CK(兔抗人,北京博奥森公司)、补体C3a ELISA试剂盒(昆明绿盟科技有限公司)。
1.4 方法
1.4.1 羊水、胎粪收集方法 孕兔术前12 h禁食,饮水任意,3%戊巴比妥钠1 mL/kg沿耳缘静脉注射麻醉,麻醉生效后仰卧位固定于兔台上,下腹正中切开,行子宫次全切除术后关腹。将切下的子宫用温盐水纱布覆盖,打开宫壁,暴露胎膜,20 mL注射器穿刺抽取羊水。打开胎兔腹壁,取出胎兔大肠,将胎粪轻轻挤压出来,用匀浆器磨碎,与自体羊水原液按质量比配成1%的羊水胎粪液。
1.4.2 兔羊水栓塞模型的构建 羊水组、羊水胎粪组孕兔分别沿耳缘静脉按2.5 mL/kg自体注入已制备好的羊水、1%羊水胎粪液(羊水原液与胎粪按质量比配成1%混合液)注射液,对照组按2.5 mL/kg沿耳缘静脉注入生理盐水。分别在注射前、注射后30 min从兔耳缘静脉取血备用,若观察过程中出现死亡立即取血备用;分别查凝血功能(PT、TT、APTT、FIB)及离心3 000 r/min,15 min,取其上清液于-20 °C保存备用,ELISA法测补体C3a的含量。
1.4.3 免疫组织化学染色(Immunohistochemistry,IHC) 取孕兔双肺用10%中性福尔马林固定48 h后常规取材、石蜡包埋并HE染色。观察HE切片选取羊水组、羊水胎粪组肺血管内含羊水有形成分的蜡块连续切片,厚约4μm行IHC标记。对照组采用相同的方法HE染色并IHC标记。IHC采用Envison法,DAB显色(DAB按1∶50稀释)。组织抗原修复采用高压修复。补体C3a稀释浓度为1∶300,CK(细胞角蛋白)稀释浓度为1∶400。
1.5 结果处理
1.5.1 IHC标记阳性结果判断 CK阳性结果判断:肺小动脉或者肺毛细血管内出现棕黄色。补体C3a阳性结果判断:肺泡上皮细胞细胞浆呈棕黄色染色为阳性,淡棕黄色为弱阳性。

2 结果
2.1 孕兔在注射前、后的临床表现 对照组注入生理盐水后孕兔无不适临床表现,呼吸、心跳节律适中,无口唇、鼻尖青紫,无大小便失禁。羊水组注入羊水原液后孕兔表现为呼吸急促、躁动,口唇、鼻尖轻度青紫,部分孕兔出现大小便失禁,30 min内无孕兔死亡。羊水栓塞组注入羊水胎粪液后孕兔表现为呼吸急促、躁动、抽搐、口吐白沫,口唇和鼻尖中、重度青紫,大小便失禁,5 min内孕兔全部死亡。
2.2 孕兔在注射前、后凝血功能的变化情况(见表1、表2)
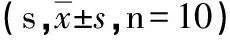

组别PT注射前注射后APTT注射前注射后对照组8.63±1.088.8±0.89 31.19±9.2631.62±9.06羊水组8.84±1.3310.94±2.09∗#36.83±10.8668.28±28.25∗#羊水胎粪组8.99±1.5313.73±2.87∗#35.36±8.5673.86±20.49∗#
*与本组注射前比较P<0.05,#与对照组注射后比较P<0.05。
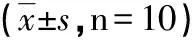

组别TT(s)注射前注射后FIB(g/L)注射前注射后对照组15.86±1.6116.28±1.702.29±0.432.20±0.46羊水组14.23±0.7625.95±3.09∗#2.26±0.401.37±0.47∗#羊水胎粪组14.82±1.1031.62±6.56∗#2.31±0.411.28±0.32∗#
*与本组注射前比较P<0.05,#与对照组注射后比较P<0.05。
2.3 孕兔在注射前、后血浆补体C3a浓度(见表3)
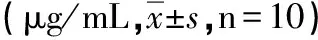

组别注射前注射后对照组23.70±1.7322.54±1.75羊水组23.37±1.4218.45±5.16∗羊水胎粪组23.17±1.9814.79±2.76∗#
*与本组注射前比较P<0.05,#与对照组注射后比较P<0.05。
2.4 病理检查结果
2.4.1 对照组肺组织HE染色未见肺水肿,肺血管内未见角化鳞状上皮等羊水有形成分。羊水组、羊水胎粪组肺组织HE染色可见不同程度的肺水肿,肺血管内见角化的鳞状上皮等羊水有形成分(见图1)。
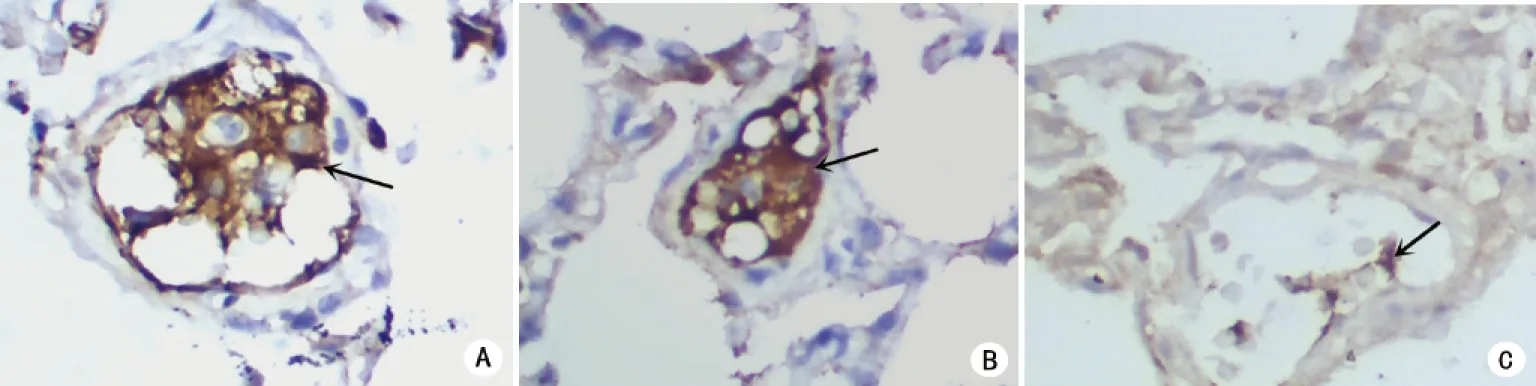
2.4.2 对照组肺血管内CK免疫组化染色未见角化的鳞状上皮等羊水有形成分。羊水组、羊水胎粪组CK免疫组化染色肺血管内可见呈棕黄色、丝状的角化鳞状上皮(见图2)。
2.4.3 对照组补体C3a免疫组化染色肺泡上皮细胞细胞浆呈棕黄色,强阳性。羊水组、羊水胎粪组补体C3a免疫组化染色肺泡上皮细胞细胞浆表达较对照组弱,呈弱阳性(见图3)。
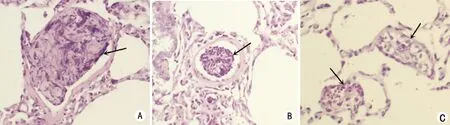
A:羊水组;B:羊水胎粪组;C:正常组。
A:羊水组;B:羊水胎粪组;C:正常组。
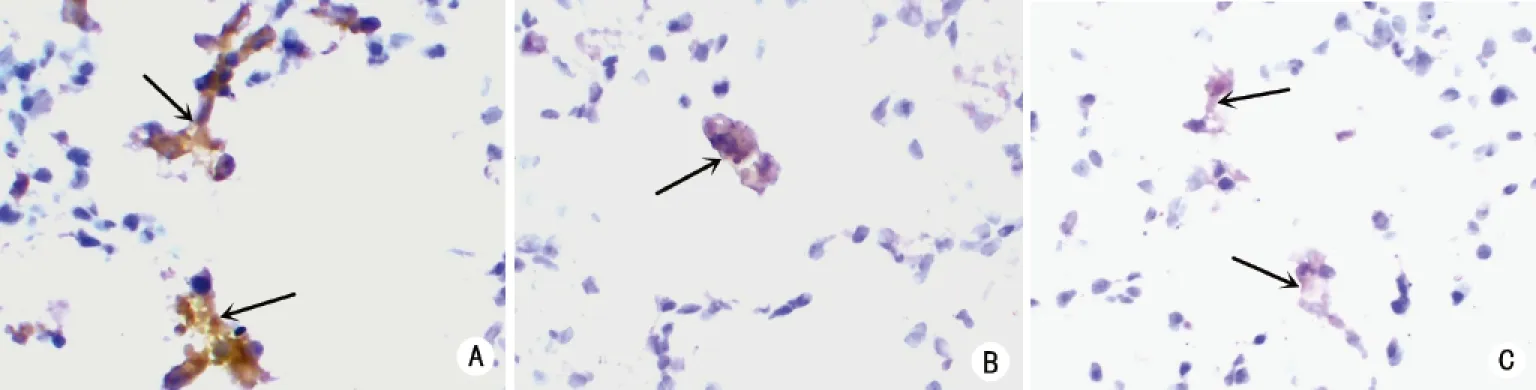
A:对照组;B:羊水组;C:羊水胎粪组。
3 讨论
羊水栓塞自1926年Meyer[2]第一次提出以来,对于AFE的发病机制、诊断标准目前暂未有统一的定论。AFE临床表现呈多样性但是缺乏特异性。Bonson等[3]认为AFE的本质可能是没有抗体参加的过敏反应,建议将AFE改名为“怀孕过敏反应综合征”。Vittoro Fineschi[4]等研究发现羊水栓塞组与对照组相比,羊水栓塞组补体C3a的量比对照组低(P<0.05),提示发生AFE时可能是补体系统被激活。
本实验通过孕兔回输自体羊水、羊水胎粪混合液建立AFE动物模型[5-6],初步探讨AFE的发病机制。羊水组、羊水胎粪组补体C3a含量降低(P<0.05),而对照组无明显变化(P>0.05),且羊水组、羊水胎粪组肺组织补体C3a免疫组织化学染色呈弱阳性表达,说明补体系统被大量激活。这与卢颖州[7]等研究一致。羊水组、羊水胎粪组凝血功能PT、APTT、TT均延长(P<0.05),FIB含量降低(P<0.05),而对照组无此变化,说明发生AFE时血液处于高凝状态有发生DIC的趋势。这与任广睦[8]等的研究一致。
既往研究理论无法解释补体活化现象[9]。卢颖州[7]等研究发现AFE的本质是类过敏反应。类过敏反应的特点是无IgE介导,首次接触即可发生,其发生机制与补体系统的激活,组胺等的释放有关 。在正常生理状态下,补体在清除病原微生物、处理免疫复合物等方面发挥重要作用,但其异常过度活化是许多临床疾病发生的基础[4]。国内学者通过动物实验研究发现注射羊水及胎粪液羊水后血清补体C3的量降低,由此说明了补体系统的激活消耗在AFE中起了一定的作用,可能是AFE的主要原因。
本实验结果显示羊水组、羊水胎粪组在分别注射羊水、羊水胎粪混合液后各项凝血指标均有变化(FIB降低,PT、TT、APTT均延长),说明AFE发生早期有并发DIC的趋势。休克与DIC也有相互促进的作用,在诸多因素的共同作用下才最终导致严重的凝血功能障碍直至发生DIC。为此,可以对疑似AFE患者检测凝血功能,对明确诊断或许有帮助。
目前,对于AFE的发病机理及诊断标准仍然没有达成统一的共识。由于AFE发病急、死亡率高的自身特点使得对AFE的认识力度不够。因此,临床怀疑AFE时可联合查患者凝血功能、补体C3a含量等指标协助诊断,争取做到早诊断、早治疗、预防严重并发症,降低产妇羊水栓塞发病率。 同时,也为AFE的进一步研究奠定基础。
[1] 乐杰,谢幸,林仲秋,等.妇产科学[M].第7版.北京:人民卫生出版社,2008:208-210.
[2] Meyer J R.Embolia pulmonar amnio caseosa [J].Bras Med,1926,2:301-303.
[3] Benson M D.A hypothesis regarding complement activatinon and amniotic fluid embolism[J].Med Hypotheses,2007,68(5):1019-1025.
[4] Fineschi V,Riezzo L,Cantatore S,et al.Complement C3a expression and tryptase degranulation as promising histopathological tests for diagnosing fatal amniotic fluid embolism[J].Virchows Arch,2009,454(3):283-290.
[5] Benson M D. Current concepts of immunology and diagnosis in amniotic fulid embolism[J].Clin Dev Immunol,2012,2012:946576.
[6] 赵敏,张国栋,余舰.实验性大鼠羊水栓塞角蛋白16表达的变化及意义[J].齐齐哈尔医学院学报,2011,17(32):2750-2751.
[7] 卢颖州,高谋.孕鼠羊水栓塞补体C3、C4和B因子的动态变化及意义[J].山西医药杂志,2014,15(3):220-222.
[8] 任广睦.实验性兔羊水栓塞血浆凝血指标的含量变化[J].山西医药杂志,2002,3(6):466-468.
[9] 李伟,余舰,龙艳丽,等.补体C3、类胰蛋白酶与羊水栓塞关系的研究[J].重庆医学,2013,42(30):3664-3666.
[收稿2014-12-05;修回2015-01-28]
(编辑:谭秀荣)
Study on complement C3a and coagulation function in amniotic fluid embolism of pregnant rabbits
LongYanli1,HuYong2,YuJian2,ZhangLijuan3,YangYang3
(1. Department of Pathology , Guizhou Provincial People’s Hospital, Guiyang Guizhou 550002, China; 2. Forensic Medicine Center,The Affiliated Hospital of Zunyi Medical University, Zunyi Guizhou 563099, China; 3.Department of Forensic Pathology,Zunyi Medical University, Zunyi Guizhou 563099,China)
Objective To determine the coagulation function and complement C3a content in amniotic fluid embolism of pregnant rabbit model and complement C3a expression in lung tissue and explore the pathogenesis of amniotic fluid Embolism.Methods Healthy trimester pregnant rabbits were randomly divided into the control, amniotic fluid and meconium groups. After the uterus exposure, the amniotic fluid and meconium were extracted. Rabbits
autologous amniotic fluid and meconium mixture (2.5 ml/kg) at the quality ratio of meconium and amniotic liquid matched into 1% mixture along the ear vein injection, while the control group was given the volume-matched saline. Thirty minutes after injection, the prothrombin time (PT), the activated partial thromboplastin time (APTT), the thrombin time (TT) and fibrinogen (FIB) were measured by coagulometer. Serum complement C3a content was detected by ELISA. The pathological examination of pregnant rabbit lungs was performed.Results The complement C3a level in amniotic fluid and meconium groups was lower than that in the control group. Compared with the control group, PT, APTT and TT in amniotic fluid and meconium groups were prolonged and FIB in amniotic fluid and meconium groups was decreased.Conclusion 1) In amniotic fluid embolism, the complement C3a was reduced, suggesting that the complement system is activated and the complement component is consumed and anaphylactoid reaction occurs.2) In amniotic fluid embolism, PT, TT and APTT are prolonged and FIB is decreased, suggesting that amniotic fluid embolism might develop to DIC.
amniotic fluid embolism; coagulation; complement C3a; immunohistochemistry; anaphylactoid reactions
贵州省科学技术基金资助项目(NO:黔科合J字[2012]2358)。
余舰,男,教授,硕士生导师,研究方向:羊水栓塞发病机制,E-mail:783065265@qq.com。
R714.46
A
1000-2715(2015)02-0164-04

