梅花鹿IFN-α基因的克隆与原核表达研究
苏凤艳,李哲,王晓霞,刘存发,曾范利,宗颖,王全凯,2∗
梅花鹿IFN-α基因的克隆与原核表达研究
苏凤艳1,李哲1,王晓霞4,刘存发3,曾范利1,宗颖1,王全凯1,2∗
(1.吉林农业大学中药材学院,长春130118;2.吉林省中韩动物科学研究院,长春130600;3.吉林省野生动物救护繁育中心,长春130122;4.吉林省蛟河林业实验区管理局,吉林吉林132517)
为研究梅花鹿IFN-α的抗病毒功能和分子机制,根据GenBank中牛IFN-α基因序列(A00145),设计并合成1对引物,以梅花鹿肝脏组织DNA为模板,采用PCR技术扩增梅花鹿IFN-α全基因核苷酸序列。序列分析表明梅花鹿IFN-α基因全长570 bp,编码189个氨基酸,其中含18个氨基酸的信号肽和169个氨基酸的成熟多肽,存在1个潜在跨膜区,基因随不同物种发育进化地位表现出种属间的差异性。在此基础上,合成1对引物,扩增梅花鹿IFN-α成熟肽核苷酸序列,构建pET28a-IFNα原核重组表达质粒并转化至大肠杆菌BL21(DE3)感受态细胞中。SDS-PAGE和Western blotting检测结果表明,在24 kd左右出现特异性蛋白带,表达产物主要为不溶性的包涵体,表达量占菌体总蛋白的34.04%,且表达产物与抗His标签抗体可发生特异性反应。将Ni柱纯化的pET28a-IFNα诱导表达产物复性后,细胞病变抑制法检测表明表达产物具抗病毒活性。研究结果为梅花鹿IFN-α蛋白抗病毒分子机制的研究及抗病毒药物的开发奠定了基础。
梅花鹿;IFN-α基因;序列分析;原核表达
野生梅花鹿是国家一级保护动物,是中国特有的集药用、皮用、肉用和观赏用等功能于一身的珍贵动物[1]。人工养殖梅花鹿已成为获得鹿产品的最有效的手段,但是随着规模化饲养,许多病毒性疾病(如鹿黏膜-腹泻病病毒、口蹄疫病毒等)严重危害了梅花鹿养殖业的发展[2-3]。
干扰素(Interferon,IFN)是动物细胞受到病毒、细菌、寄生虫、肿瘤细胞的侵染后产生的一种微量的具有抗病毒作用、抗肿瘤活性、调节机体免疫作用的分泌性蛋白质[4-6]。在畜牧兽医上干扰素是一种非特异性广谱抗病毒生物制剂,在对畜禽病毒性疾病如猪瘟、猪蓝耳病、猪伪狂犬病、鸡新城疫、鸡传染性法氏囊病、鸡传染性喉气管炎、犬瘟热和犬细小病毒病等的治疗中,采用干扰素治疗,可明显提高治愈率[7-9],但关于梅花鹿干扰素的研究报道非常少。研究表明干扰素的生物学活性具有严格的动物种属特异性,即某一种属的细胞所产生的干扰素,只能作用于相同种属的其他细胞,对异种细胞无效。但它对病毒复制的抑制作用则呈现非特异性,如牛口蹄疫病毒诱导产生的干扰素,除抑制牛口蹄疫病毒外,对牛的其他病毒感染同样具有抑制作用,干扰素的这种特性对于抗病毒生物制品的研发是独一无二的。由于天然干扰素在生物体内具有含量少且不易被提取等特点,在应用中受限制,从20世纪70年代起,科学家们开始不断的探索和研究利用基因工程方法来改造干扰素及其表达系统。本研究旨在利用大肠杆菌建立高效表达梅花鹿IFN-α体外表达系统,为梅花鹿IFN-α蛋白抗病毒分子机制的研究、重组梅花鹿IFN-α用作新型广谱抗病毒生物制剂和免疫增强剂的开发奠定基础。
1 材料与方法
1.1 菌株与载体 大肠杆菌E.coli JM109、BL21(DE3)由吉林农业大学经济动物疫病实验室保存,原核表达载体pET28a由吉林农业大学生命科学学院胡薇教授馈赠。
1.2 主要试剂 核酸分子量标准、PCR试剂盒、Bam HⅠ、Hin dⅢ为宝生物工程(大连)有限公司产品;DNA凝胶回收纯化试剂盒、质粒DNA抽提试剂盒为杭州维特洁生化技术有限公司产品;鼠抗6-His-Tag抗体,辣根过氧化物酶(HRP)标记的羊抗鼠IgG,HRP-DAB底物显色试剂盒为天根生化科技有限公司产品;低分子质量蛋白质标准、预染蛋白质分子量标准为上海生物工程技术有限公司产品。
1.3 梅花鹿IFN-α全基因的克隆与测序列测定根据GenBank中的牛IFN-α(A00145)基因序列,利用Primer 5.0软件设计1对引物(由上海生物工程技术服务有限公司合成),预期扩增的基因长度为698 bp。P1:5’-ATTTGGATCCTGAAGGAAG⁃GTCTT-3’,P2:5’-AAAGAAGCTTCTATTTCCGT⁃GTTGG-3’。在上、下游引物5’端分别引入Bam HⅠ和Hin dⅢ酶切位点。按Trizol法提取梅花鹿肝脏DNA,采用PCR扩增得到目的基因,将其克隆至pMD-18T Simple vector上,鉴定正确的质粒送上海生物工程技术有限公司测序。
1.4 生物信息学分析 用DNAStar软件对不同物种的IFN-α基因序列和推导的氨基酸序列进行同源性比对分析。用ProtParam Tool(http://web.expasy.org/protparam/)分析氨基酸组成、分子质量、等电点等理化性质。用ProtScale(http://web.expasy.org/protscale/)分析蛋白质的疏水性。用Signalp4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白质序列信号肽。用Conserved domains(http://www.ncbi.nlm.nih.gov/cdd)分析梅花鹿IFN-α的保守区域结构。用Tmpred(http://www.ch.embnet.org/software/TMPRED_form.htmlpred)分析预测蛋白质的跨膜区。
1.5 原核表达质粒pET28a-IFNα的构建 根据测序结果设计引物P3:5’-TAATGGATCCTGCCAC⁃CTGCCTCAC-3’,P4:5’-CCACAAGCTTTCAGTC⁃CTTCCTCCG-3’。以重组质粒pMD-18T-IFN-α为模板,以P3、P4为引物扩增梅花鹿IFN-α成熟肽基因。以Bam HⅠ和Hin dⅢ分别双酶切含梅花鹿IFN-α成熟肽基因的T载体和pET28a原核表达载体,切胶回收目的片段后,在T4DNA连接酶的作用下,16℃连接8 h,转化至E.coli JM109感受态细胞。提取重组质粒,Bam HⅠ、Hin dⅢ双酶切鉴定后,送至上海生物工程技术有限公司测序,测序正确的重组质粒命名pET28a-IFNα。
1.6 重组表达质粒pET28a-IFNα的诱导表达和鉴定 将pET28a-IFNα转化至表达宿主菌BL21(DE3)感受态细胞中,于37℃,加入终浓度为1.0 mmol/L的IPTG进行诱导表达。分别于诱导前、诱导后2、4 h收集菌液。同时设只含表达载体pET28a的BL21和诱导后pET28a的BL21对照。取菌液1 mL,于室温5000 g离心5 min,收集菌体,重悬于50 mmol/LPBS(pH 7.4)中,冰浴超声破碎(200W×10次,每次5 s,间歇3 s),最后于4℃、12000 g离心10 min,收集上清和沉淀,于100℃加热变性5 min,进行10%SDS-PAGE分析、薄层扫描和Western blot分析。
1.7 梅花鹿IFNα抗病毒活性检测 表达产物经Ni柱纯化后,采用薄层扫描法测定其纯度,Bradford法测定其含量。纯化产物经10倍稀释后再5倍连续梯度稀释,采用微量细胞病变抑制法,在Vero-牛病毒性腹泻/粘膜病病毒(BVDV)上检测重组梅花鹿IFNα的抗病毒活性,按照Reed-Muench法,根据下列公式计算其活性。

2 结果与分析
2.1 梅花鹿IFN-α基因的克隆 利用引物P1、P2,以肝脏基因组DNA为模板进行扩增,PCR产物经1%琼脂糖凝胶电泳后,在698 bp处出现特异带(图1),与预期DNA片段相符。PCR产物与pMD18-T载体连接后,转化JM109,提取质粒后,以Bam HⅠ和Hin dⅢ酶切,得到约2700 bp的pMD18-T线性片段和约700 bp的插入片段(图2),与预期结果一致,表明成功地构建了重组克隆载体pMD-IFNα。利用引物P3、P4,以pMD-IFNα为模板进行扩增,PCR产物经1%琼脂糖凝胶电泳后,约在500 bp处出现特异带(图3),与预期片段相符。
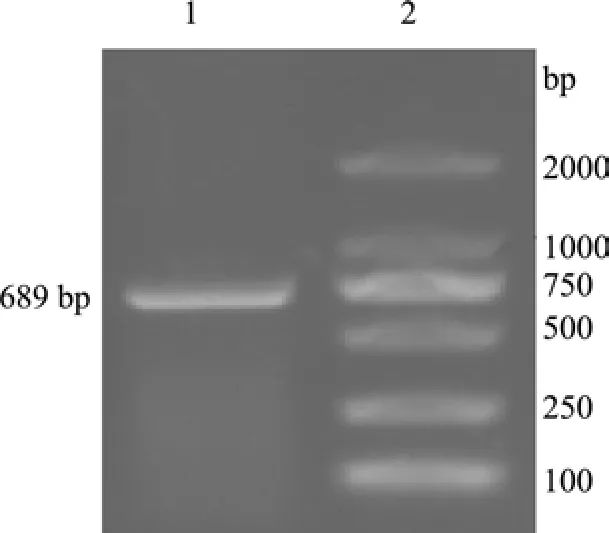
图1 干扰素-α全基因PCR扩增
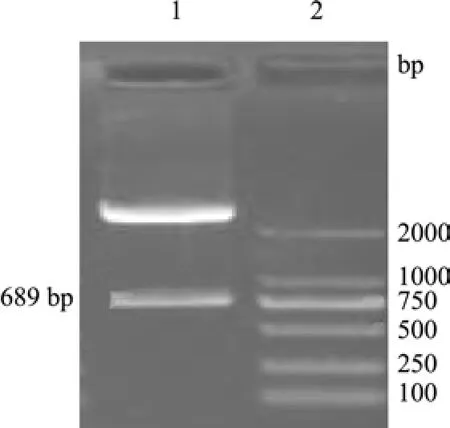
图2 重组克隆质粒的酶切鉴定
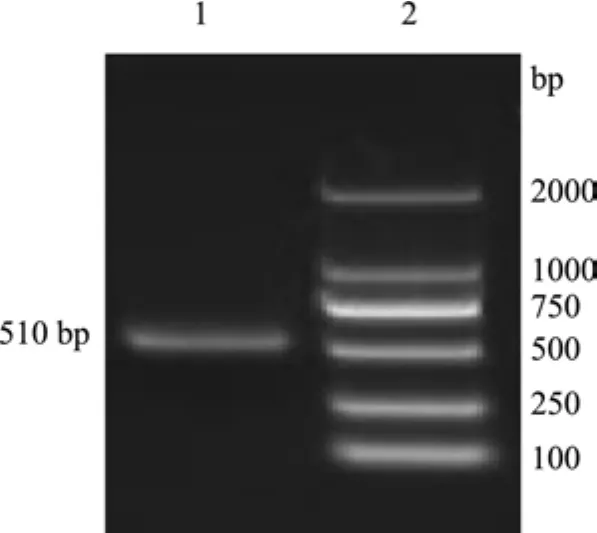
图3 梅花鹿IFN-α成熟肽基因PCR扩增
2.2 梅花鹿IFN-α的生物学信息分析 DNAStar软件对梅花鹿IFN-α序列进行分析表明,梅花鹿IFN-α基因全长570 bp,包含一个完整阅读框,编码189个氨基酸。将梅花鹿IFN-α基因与牛(NM_ 001017411)、马(NM_001114538)、大鼠(XM_ 001054291)、鹌鹑(AB154298)、斑胸草鹊(XM_ 002189305)、鸡(DQ226093)、貂(EF368207)、人(NM_002171)、猕猴(NM_001194384)、野猪(NM_ 214393)和犬(AB102731)的IFN-α基因进行序列比对,发现梅花鹿IFN-α基因序列与牛的同源性最高,为93.9%;与斑胸草鹊的同源性最低,为7.2%。人与猕猴的同源性较高,为94.6%;鹌鹑与鸡的同源性为90.9%(图4)。系统发育树表明,IFN-α基因随鸟类、哺乳类物种发育进化地位的差异,表现出种属间的差异性和种属内的保守性(图5)。ProtParam对梅花鹿IFN-α蛋白理化性质的分析表明,IFN-α蛋白分子质量为21.1 ku,等电点为9.05。ProtScale对其疏水性进行分析发现,IFN-α蛋白最大的疏水指数位于第10位,值为3.067;最小疏水指数位于第184位,值为-2.367。SignalP 4.1 Server对其信号肽的预测分析表明,梅花鹿IFN-α蛋白N端前18个氨基酸为信号肽。用Conserved domains工具分析梅花鹿IFN-α保守区结构域,发现该蛋白存在Dispanin结构域(干扰素α、β结构域),是结构保守蛋白。利用TMpred分析梅花鹿IFN-α蛋白的二级结构,发现该蛋白存在1个潜在跨膜区,是第5~23位氨基酸。2.3 重组质粒pET28a-IFNα的鉴定 梅花鹿IFN-α成熟肽基因与pET28a连接后,转化E.coli JM109,挑白色菌落提取质粒,以Bam HⅠ和Hin dⅢ双酶切重组质粒,得到5369 bp的pET28a线性片段和约500 bp的插入片段(图6),与预期结果相符。将双酶切鉴定为阳性的重组质粒测序,测序结果与梅花鹿IFN-α成熟肽基因的编码序列完全一致。证实成功地构建了重组原核表达质粒pET28a-IFNα。
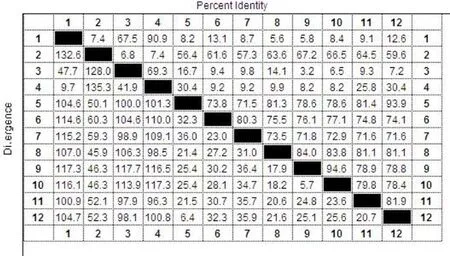
图4 十二个物种间IFN-α基因核苷酸序列的同源性
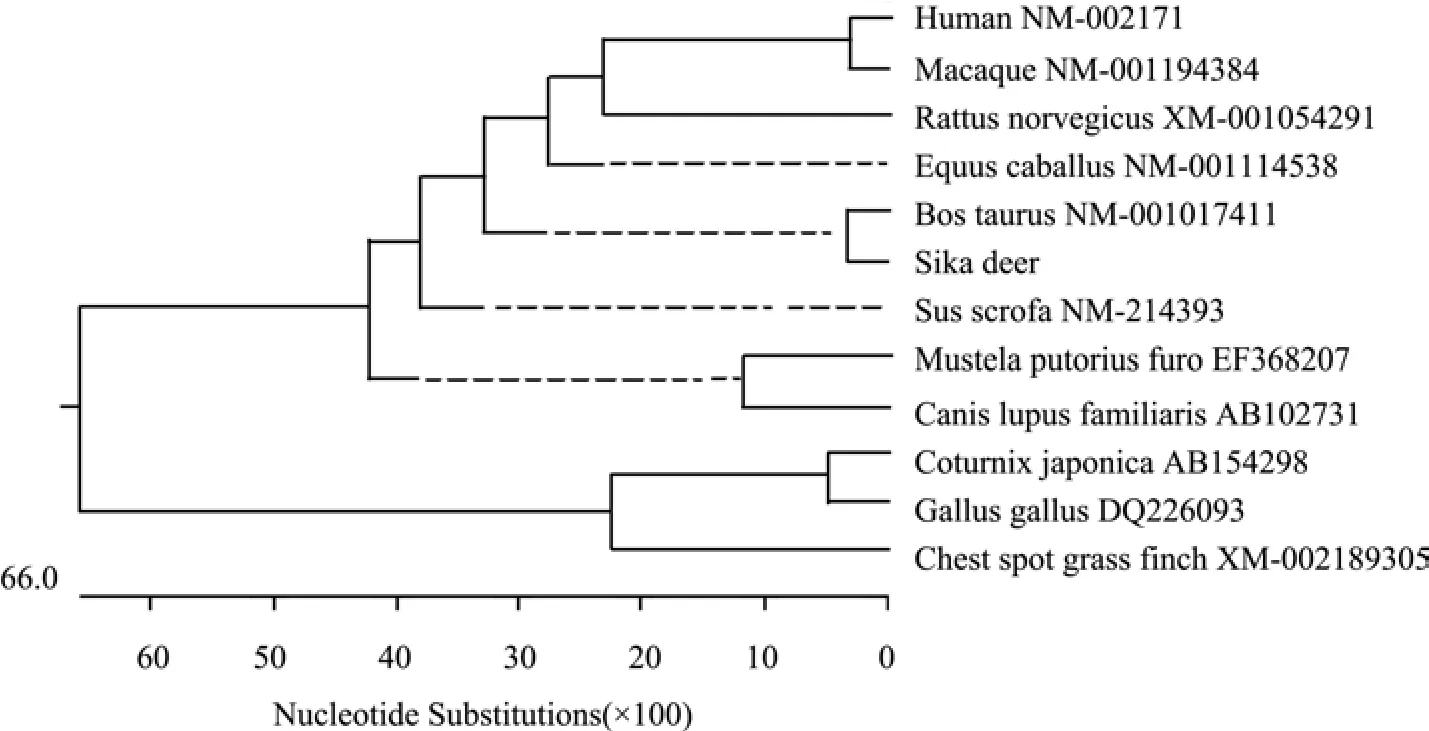
图5 IFN-α基因的系统发育树
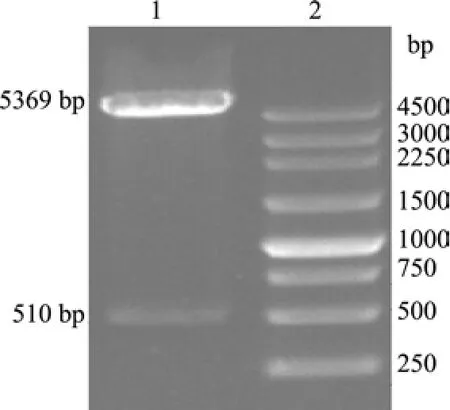
图6 重组质粒的鉴定pET28a-IFNα
2.4 重组梅花鹿IFN-α成熟肽基因的表达与鉴定
在BL21(DE3)中,重组表达质粒pET28a-IFNα在IPTG诱导表达下,在20.1~31 kd之间产生了特异蛋白质条带(图7,5、6列),而以pET28a空载体作为对照或IPTG诱导前pET28a-IFNα的克隆,在相应位置均没有产生特异性条带(图7,1、2、3列)。薄层扫描分析结果显示,IPTG诱导4 h,表达蛋白占菌体总蛋白的34.04%(图7,6列)。以鼠抗His单抗为一抗,HRP标记的羊抗鼠IgG为二抗进行Western blot分析显示,pET28a-IFNα经IPTG诱导产生的24 kd蛋白条带与鼠抗His单抗具有较强的交叉反应(图7,7列),表明诱导表达的目的蛋白是重组的梅花鹿IFN-α。
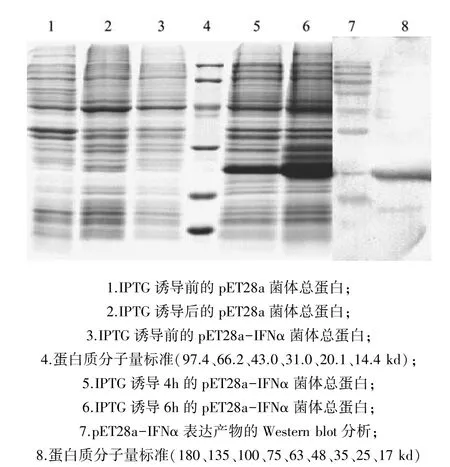
图7 pET28a-IFNα表达产物的鉴定
2.5 梅花鹿IFNα抗病毒活性检测 表达产物经Ni柱纯化并复性后,蛋白纯度达87%。Bradford法检测终浓度约为0.098mg/mL。微量细胞病变法测定原核表达重组梅花鹿IFN-α在Vero细胞上抑制BVDV复制的结果见表1,按照Reed-Muench法计算其活性。距离比例=(78.6-50)/(78.6-46.2)=0.88,则重组梅花鹿IFN-α在Vero细胞上抗BVDV活性为(10×53.88U/0.1mL)/0.098mg/mL=5.26×104U/mg。结果显示,重组梅花鹿IFN-α能够有效的抑制BVDV在Vero细胞中的复制,具有良好的抗病毒活性。
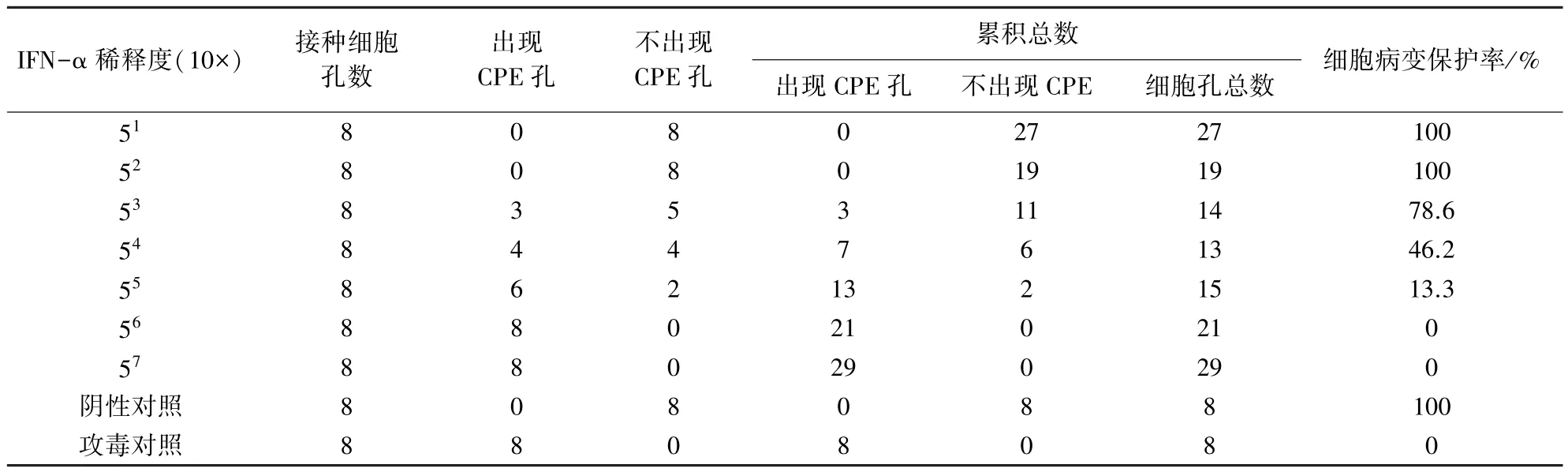
表1 原核表达重组梅花鹿IFN-α在Vero细胞上抑制BVDV致细胞病变结果
3 讨论
中国是鹿业生产大国,也是将鹿产品应用于医药保健事业最早的国家。梅花鹿是中国特产的珍贵药用动物,作为野生动物已属濒危,但在中国已形成规模化的人工养殖,特别是吉林省,已成为特色产业,是吉林省支柱产业之一,其产品享誉国内外,产业发展潜力巨大。不过近年来,疾病问题已成为了危害梅花鹿养殖业可持续发展[2-3]的关键因素之一,因此梅花鹿养殖业急需研制广谱抗病毒生物制剂和免疫增强剂来防治疾病减少损失。
干扰素是在特定抗原刺激下由细胞产生的一类具有抗病毒、抗肿瘤和免疫调节功能等生物活性的诱生蛋白,作用于机体组织细胞后,可使机体获得抗多种病毒和微生物的能力,从而保护未被感染细胞免受攻击。干扰素的种类繁多,其中IFN-α主要由单核巨噬细胞产生,具有广谱抗病毒、调节免疫、抑制肿瘤细胞增殖和促进细胞凋亡等多种生物学活性。IFN-α主要通过调控一系列干扰素刺激因子的表达,干扰病毒的复制和转录、抑制病毒蛋白的翻译等途径发挥抗病毒效应;同时IFN-α还可通过调节T细胞、树突状细胞等免疫细胞的分化、存活及功能[10-11],从而起到免疫调节作用,并增强抗病毒能力[12-13]。IFN-α由于可同时起到抗病毒和免疫调节效应,故在病毒病的治疗和预防中具有重要的作用[14-15]。
本研究应用PCR技术从梅花鹿肝脏组织DNA中克隆得到梅花鹿IFN-α基因,对核苷酸序列同源性及IFN-α蛋白的理化性质、二级结构、疏水性、保守区域结构及信号肽进行了分析,结果显示,IFN-α基因随物种发育进化地位的不同,表现出种属间的差异性和种属内的保守性。这一结论与Li Tian的研究结果一致[16]。梅花鹿IFN-α是由189个氨基酸构成的保守蛋白,含有1个信号肽,存在1个潜在跨膜区。构建的成熟肽原核表达重组质粒pET28a-IFNα,在IPTG诱导下,成功地在BL21细胞中表达了24 kd左右的蛋白质,所表达的蛋白质以包涵体形式存在。Western blotting结果表明经原核表达的梅花鹿IFN-α蛋白具有良好的反应原性。微量细胞病变抑制法(Vero-BVDV系统)检测表明梅花鹿IFN-α具有抗病毒活性,抗BVDV活性达5.26×104U/mg。本研究获得的重组梅花鹿IFN-α有望作为鹿科动物的抗病毒制剂,在鹿养殖业中广泛应用,以提高鹿科动物养殖的经济效益。
本研究首次从中国梅花鹿肝脏基因组中克隆IFN-α基因,建立了IFN-α成熟肽基因原核表达系统,并实现了表达,且表达产物具有较好的抗病毒活性。这些研究为抗梅花鹿IFN-α多克隆抗体的制备、梅花鹿IFN-α抗病毒分子机制的研究及抗病毒药物和免疫增强剂的开发提供了理论基础,为梅花鹿INF-α走向动物医学临床创造了良好的条件。
[1] 许飞,郭素华.梅花鹿药用产品的研究现状[J].中国鹿业,2011(2):11-13.
[2] 吕见涛,张一斌,陈法荣,等.梅花鹿口蹄疫免疫操作技术[J].中国兽医杂志,2010,46(1):47-48.
[3] 郜玉钢,李璠瑛,刘佳佳,等.鹿源牛病毒性腹泻病毒E0基因的RT-PCR扩增[J].生物学杂志,2009,26(1):5-7.
[4] 王照,王磊,李天松,等.动物干扰素的研究进展[J].中国动物检疫.2012,29(2):71-73.
[5] 郑拓,吴长德.犬干扰素的研究进展[J].中国兽医杂志.2012,48(1):77-79.
[6] Elizabeth I,Buchbinder,M D,David F,et al.Interferon,interleukin-2,and other cytokines[J].Hematology/Oncology Clinics of North America,2014,28(3):571-583
[7] Cella N Groner B,Hynes N E.Characterization of Stat5a and Stat5b homodimers and heterodimersand their association with the glucocorticoid receptor in mammary cells[J].Mol CellBiol,1998,18:1783-1792.
[8] Imada K,Bloom E T,Nakajima H,et al.Stat5b is essential for natural killer cell-mediated proliferation and cytolytic activity[J].JExp Mdd,1998,188:2067-2074.
[9] 常维山,沈强,张译元,等.家禽干扰素的研究进展与应用[J].中国家禽.2011,33(22):45-48.
[10]Dias CC,MoraesMP,Segundo FD,etal.Porcine type Iinterferon rapidly protects swine against challenge with multiple serotypes of foot-and-mouth disease virus[J].J Interferon Cytokine Res,2011,31(2):227-236.
[11]Xiong Y,Lin M,Yuan B,et al.Expression of exogenous IFN-alpha by bypassing the translation block protects cells against FMDV infection[J].Antiviral Res,2009,84(1):60-66.
[12]Cheng G,Zhao X,Yan W,et al.Alpha interferon is a powerful adjuvant for a recombinant protein vaccine against foot-andmouth disease virus in swine,and an effective stimulus of in vivo immune response[J].Vaccine,2007,25(28):5199-5208.
[13]Du Y,Dai J,Li Y,et al.Immune responses of recombinant ade⁃novirus co-expressing VP1 of foot-and-mouth disease virus and porcine interferon alpha in mice and guinea pigs[J].Vet Immu⁃nol Immunopathol,2008,124(3-4):274-283.
[14]Nfon CK,Ferman GS,Toka FN,et al.Interferon-alpha production by swine dendritic cells is inhibited during acute infection with footand-mouth disease virus[J].Viral Immunol,2008,21(1):68-77.
[15]Su-Mi Kim,Se-Kyung Kim,Jong-Hyeon Park,et al.A recombinant adenovirus bicistronically expressing porcine interferon-αand interferon-γenhances antiviral effects against foot-and-mouth disease virus[J].Antiviral Research,2014,104:52-58.
[16]Li Tian,Panpan Zhao,Bo Ma,et al.Cloning,expression and antiviral bioactivity of red-crowned crane interferon-α[J].Gene,2014,544(1):49-55.
(编辑:陈希)
Study on Cloning and Prokaryotic Expression of Interferon -αGene of Sika Deer
SU Feng-yan1,LIZhe1,LIU Cun-fa3,ZENG Fan-li1,ZONG Ying1,WANG Quan-kai1,2∗
(1.College ofChinese Medicinal Materials,Ji Lin Agricultural University,Changchun 130118,China;2.Jinlin Sino-ROK Academy of Animal Sciences,Changchun 130600,China;3.Wild Animal rescue and Breed center of Jilin Province,Changchun 130122,China;4.Jiaohe forestry experimental area ofadministration in Jilin province,Jilin,Jinlin 132517,China)
In order to investigate the antiviral function andmolecularmechanism of interferon alpha(IFN-α),one pair of primers were designed and synthesized according to the bovine IFN-αgene nucleic acid sequence(A00145)published in the GenBank.The IFN-αgene of sika deer was amplified by PCR from genome DNA extracted directionally from liver of sika deer,then cloned and sequenced.the result showed the full length sequence of sika deer IFN-αgenewas consisted of 570 bp,which encode 189 amino acids,Containing 18 amino acids of signal peptide and mature polypeptide of 169 amino acids.IFN-αprotein of sika deer had one transmembrane domain.IFN-αgene was different among species due to their evolution status.The primers of IFN-α mature peptide were synthesized according to the result of sequencing.IFN-αmature peptide gene was amplified.The expression vector pET28a-IFNαwas constructed and transformed into E.coli BL21(DE3)cells.By the detection of SDS-PAGE and Western blotting,the Sika deer IFN-αrecombinant protein was 24 kd and formed aninsoluble inclusion body.The amount of recombinant protein accounted for 34.04%of the total fraction of bacterial proteins.Expression products could react with His tag antibody specificity reaction.The expression product of pET28a-IFNαwas purified by The Ni column and renatured.Then,cytopathic inhibition method detected that express product possess antiviral activity.This study provide the foundations for study of the antiviral molecular mechanism of sika deer IFN-αand the development of antiviral drugs.
sika deer;IFN-αgene;sequence analysis;prokaryotic expression
2014-10-31
A
1002-1280(2015)02-0007-06
S858.25
吉林省自然科学基金项目(201115194);国家国际科技合作专项(2011DFA32900)
苏凤艳,副教授,从事经济动物疾病防治研究。
王全凯。E-mail:13944125038@163.com

