不同靶点下脑深部电刺激治疗帕金森的疗效对比
白茫茫,钟 海,李 健
(1.延安大学附属医院神经外科,陕西延安716000;2.西安医学院第一附属医院神外一科,陕西西安710077)
不同靶点下脑深部电刺激治疗帕金森的疗效对比
白茫茫1,钟 海2,李 健1
(1.延安大学附属医院神经外科,陕西延安716000;2.西安医学院第一附属医院神外一科,陕西西安710077)
目的 探讨不同靶点下脑深部电刺激治疗帕金森病(PD)的疗效。方法 立体定向微电极植入丘脑底核(STN)与苍白球内侧核(GPi),术后观察PD症状的改善情况,分别计算“关”状态下和“开”状态下肢体症状改善率,分别于术前、术后1月、1年对患者进行UPDRS运动功能及日常生活评分的随访分析,并比较手术前后左旋多巴服用剂量变化情况。结果 DBS对PD症状有效率达到100%,且术后在“关”状态下较“开”状态的改善率更高,效果更明显。术后UPDRS运动功能及日常生活评分较术前显著降低,且STN-DBS术后左旋多巴用量在减轻PD症状的同时可减少术后药物使用量。结论 DBS治疗帕金森病具有显著疗效,其中尤以STN-DBS在保证疗效同时可减少药物用量。
立体定向;脑深部电刺激;帕金森病
帕金森是(parkinson disease,PD)是一种好发于中老年人的中枢神经系统慢性退行性病变,其临床表现以肌肉不自主震颤、僵直、运动及姿势障碍为特征。其治疗方法是早期应用药物控制症状治疗,随着病情加重,当药物疗效下降时则选择手术治疗。目前手术方法包括神经核团毁损术、脑深部电刺激术(DBS),但DBS因具有安全、可逆且疗效确切的优点而逐渐替代毁损术,但此方法由于材料价格及手术费用昂贵而使其临床应用受到一定限制。DBS手术靶点有丘脑底核(STN)与苍白球内侧核(GPi)等,此研究对PD患者在不同靶点下DBS手术前后治疗的疗效进行观察、对比、分析,报道如下。
1 资料与方法
1.1 一般资料
选取2009-01~2014-01期间,在第四军医大学唐都医院神经外科住院治疗的PD病人,患者总例数44例,男性29例,女性15例;年龄区间35~74岁,平均年龄62岁;疾病病程3~17年,平均7年。所选病例均符合以下标准:(1)原发帕金森病患者,排除其他原因引起的帕金森综合征;(2)服用左旋多巴类药物治疗曾有效;(3)药物治疗效果随用药时间延长而降低或出现运动症状波动进而影响生活质量;(4)除外严重的痴呆和精神疾病以及心肺疾病或不能耐受手术者。所选病例为:同期双侧丘脑底核(STN)DBS 33例,同期双侧苍白球内侧部(GPi)8例,单侧丘脑底核(STN)DBS 2例,分期双侧STNDBS1例。
1.2 手术方法
术前1天所有病人均停用左旋多巴。局部浸润麻醉后安装头部定位器,然后在1.5 T Siemens MRI下行头部靶点解剖学定位,确定前联合(AC)、后联合(PC)及其连线(IC)位置。先设定STN及Gpi靶点坐标值,二者可根据具体临床症状做适当调整。然后用结合坐标值定位的图像直接定位法确定靶点,计算靶点坐标后换算成头架坐标。单侧手术者,局麻下患侧额部头皮切开,颅骨钻孔,根据术前定位,通过导针用微推进器将微电极送入到靶点位置,通过记录细胞电生理信号,对解剖定位的靶点进行功能定位并确认。然后将刺激电极送至此前验证过的靶点,再次给予微刺激进行验证,经观察疗效满意后,在全麻下固定电极、导线和锁骨处皮下植入Soleter 7426脉冲发生器,并将它们相连接起来。双侧者,将先行手术侧导线暂时放置于切口内,应用相同方法于另外一侧置入电极,微刺激验证后将先手术侧导线自后手术侧切口导出,缝合双侧伤口,锁骨处皮下置入Kinter 7428脉冲发生器,与导线相连接。分期手术者采用相同原理。术后1月开启脉冲发生器,行体外程控,根据患者症状的改善以及副作用发生情况进行参数调整。
1.3 疗效与随访分析
分析术后震颤、运动迟缓及僵直等症状的改善情况,选取评价标准为:显效(症状完全消失);有效(部分症状得到缓解);无效(症状无明显好转)。分别计算“关”状态下和“开”状态下肢体症状改善率:(术前UPDRS评分-刺激术后脉冲发生器开启时UPDRS评分)÷术前UPDRS评分×100%。此外,分别于术前、术后1月、1年对患者进行UPDRS运动功能及日常生活评分的随访分析,比较手术前后左旋多巴服用剂量变化情况。
1.4 统计学分析
2 结果
2.1 疗效分析
所有病例经DBS术后症状得到有效缓解,总有效率100%,其中有显著治疗效果病例38例,所占比例86%,部分症状得以改善者6例,占14%,而完全没有效果者0例。所有病例在“关”状态下和“开”状态下症状改善率可见表1。
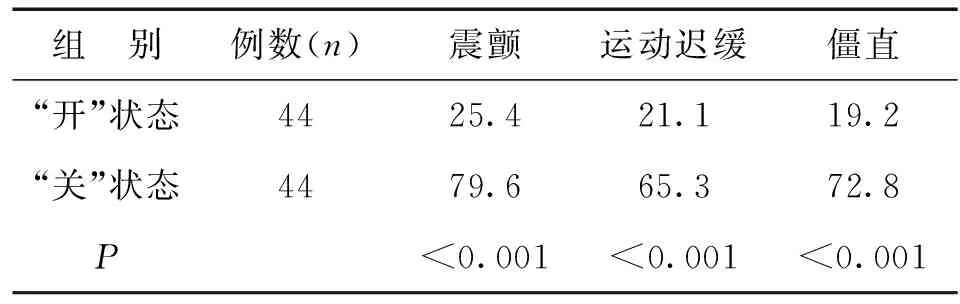
表1 DBS术后“开”与“关”状态下肢体症状改善率(%)
2.2 随访及并发症
所有病例分别于术前、术后1月、术后1年对患者进行UPDRS运动功能及日常生活评分进行随访,分析结果可见:UPDRS运动功能评分在术前、术后1月及术后1年相比于术前显著下降(P<0.017),而术后1月与术后1年相比则无明显变化(P>0.017);UPDRS日常生活评分在术前、术后1月及术后1年相比于术前显著下降(P<0.017),而术后1月与术后1年相比则无明显变化(P>0.017)(见表2)。比较手术前后左旋多巴服用剂量变化情况,结果显示:术前与术后相比药物使用量变化明显,且术后药物使用量明显下降,差异具有统计学意义(P<0.05)(见表3)。另外,DBS术后随访发现1年内并发症发生,1例患者出现吞咽困难,1例表现为感觉障碍,无脑出血及死亡病例。
表2 术前和术后不同时间UPDRS运动功能及日常生活评分比较分)

表3 术前和术后左旋多巴服用剂量比较
3 讨论
帕金森作为一种好发于中老年人的神经退行性病变,不仅严重损害个人的身体健康,降低病人生活质量,而且从社会经济学角度上来讲也使社会经济效益受到影响,增加了家庭和社会的经济负担。因而为了能彻底治愈PD患者,人们也在一直不断努力探索和开发更为有效、安全的新方法。PD治疗方法的转变经历了两次重大突破,1968年药物(左旋多巴)的问世,为广大帕金森患者带来福音,它能有效缓解病人肌强直、肢体震颤和运动减少等临床症状,成为PD治疗史上的第一座里程碑。但药物治疗随着时间的延长,治疗效果不断下降且副作用显著增高,人们转而将视线聚焦于治疗效果更为长久的手术治疗。早期应用于临床的是靶点射频毁损术,其治疗效果显著,较为经济,在一段时间内是手术治疗的主流方法,但该方法使脑出血发生率增高,并有毁损灶偏移、水肿等并发症的发生,其推广、使用在一定程度上受到限制[1]。
为解决上述问题,脑深部电刺激术(DBS)应运而生,它具有不破坏脑组织正常结构,对今后其他治疗方法不产生影响,且脑出血等并发症的发生率低等优点,已逐步取代毁损术成为PD外科手术首选治疗方法,同时也被认为是PD治疗史上的第二座里程碑[2]。决定PD的手术治疗效果以及并发症发生的关键因素是手术靶点定位的精确程度[3]。而靶点的定位精确性则依赖于影像学的发展程度[4]。最早的定位方法使用X线脑室造影,由于其定位不准确,早期限制了PD的外科手术治疗,直到较高分辨率的CT与MRI出现并应用于立体定向技术中才使得这一状况得到根本改善,同时,随着电生理技术的应用,微电极记录技术逐渐被临床医生所认可,靶点定位的精确性得以进一步提高,使DBS手术已成为目前的主流术式。DBS手术的常用靶点包括GPi、STN以及丘脑腹中间核(Vim)等,而STN是目前的首选治疗靶点[5]。因而本研究选择以STN作为手术靶点的病例为主,观察患者术后症状的缓解率,对患者进行UPDRS运动功能及日常生活评分进行随访分析。结论显示DBS对震颤、运动迟缓以及僵直等肢体症状的有效率达到100%,且术后患者在“开”、“关”状态下症状均得到有效改善,其中尤以在“关”状态下的改善率更高,效果更明显。术前、术后UPDRS运动功能及日常生活评分随访结果进一步证实了DBS治疗PD的有效性,且患者术后症状得到显著改善。另外,比较GPi-DBS与STN-DBS手术前后左旋多巴用量变化情况,结果显示GPi-DBS虽能减轻PD的症状,但不能减少术后药物使用量,而STN-DBS在减轻PD症状的同时可减少药物的使用量,降低了大剂量用药带来的副作用。因而进一步证明了STN作为首选靶点的可靠性。术后对所有病例进行随访发现,1例患者出现吞咽困难,1例表现为感觉障碍,但无脑出血及死亡病例,总体来说并发症相对较少,与国内外大多数报道相符合[2,6]。
无论是药物治疗亦或手术治疗,均无法有效阻断PD的病理进程,难以使其达到彻底治愈的目标,如何选择合适的治疗方法显得至关重要。与药物治疗及毁损术相比,DBS具有长效、安全、可逆等优势,目前已成为一种治疗中晚期PD的首选治疗措施。而DBS手术后要取得理想的的治疗效果关键在于:选择符合DBS手术标准的病例,术前精确靶点定位,术中精确植入电极以及尽可能减少并发症的发生[7]。尽管DBS具有这么多的优点,但是其临床应用仍受到一定程度上的限制,究其原因为材料价格及手术费用昂贵,目前仍不能完全取代毁损术。但我认为,随着国产材料设备的研发应用以及逐渐将DBS手术纳入医疗保险范围,在不久的未来,该手术能够更加广泛地应用于临床,必将使更多的PD病人受益。
[1]陶振玉,杨天明.立体定向脑核团毁损治疗帕金森病[J].东南大学学报(医学版),2010,29(2):220-223.
[2]李强,陈宝友,李建国.神经核团毁损术与电刺激术治疗帕金森病疗效观察[J].中华实用诊断与治疗杂志,2013,27(9):878-880.
[3]曾雪,胡春华.帕金森病脑深部刺激疗法中STN靶点定位方法综述[J].生命科学仪器,2014,12:12-16.
[4]OstremJL,GalifianakisNB,MarkunLC,etal.ClinicaloutcomesofPDpatientshavingbilateralSTNDBSusinghigh-fieldinterventionalMR-imagingforleadplacement[J].ClinNeurolNeurosurq,2013,115(6):708-712.
[5]张建国.脑深部电刺激术的现状与未来[J].中华神经外科学杂志,2010, 26(5):385-386.
[6]PilitsisJG,ChuY,KordowerJ,etal.Postmortemstudyofdeepbrainstimulationoftheanteriorthalamus:casereport[J].Neurosurgery,2008,62(2):530-532.
[7]ShuklaAW,OkunMS.SurgicaltreatmentofParkinson'sdisease:patients,targets,devices,andapproaches[J].Neurotherapeutics,2014,11(1):47-59.
Comparison the efficacy of deep brain stimulation with different target points on patients of parkinson's disease
BAIMang-mang1,ZHONGHai2,LIJian1
(1.Department of Neurosurgery,Affiliated Hospital of Yanan University,Yanan 716000,China;2.The First Department of Neurosurgery,First Affiliated Hospital of Xi'an Medical University,Xi'an 710077,China)
Objective To observe curative efficacy of deep brain stimulation (DBS) treatment for Parkinson's disease(PD) in the different target points.Methods Stereotactic microelectrode implanted in the subthalamic nucleus (STN) and globus pallidusinterna (Gpi),and the improvement of symptoms in PD after operation were observed,meanwhile the improvement rate of body symptom in the “on” and “off” states were calculated respectively.UPDRS motor function and activities of daily living scores of patients were investigated before surgery and 1 and 12 month after surgery,as well as the levodopa dose changes before and after surgery.Results It is 100% efficiency for DBS treatment of PD symptoms.Compared with the “open” state,the improvement rate of the “off” state was higher,and the effect is more obvious.The score of motor function and daily living reduced significantly after operation compared with the preoperative.STN-DBS not only can reduce postoperative levodopa dosage but also relieve the symptoms of PD.Conclusion There is a significant effect by using DBS to treat Parkinson's disease, and especially,STN-DBS ensure efficacy and reduce drug dosage.
Stereotactic; Deep brain stimulation; Parkinson's disease
白茫茫(1971—),男,陕西米脂人,主任医师,副教授,研究方向:神经外科学,医学遗传学。
R742.5
A
1672-2639(2015)02-0018-03
2014-04-15;责任编辑 赵菊梅]

