2010年版GMP在江苏省的实施简况分析
程锦 于广华 刘昊然 王坤
(盐城卫生职业技术学院药学系,江苏盐城224005)
2010年版GMP在江苏省的实施简况分析
程锦 于广华 刘昊然 王坤
(盐城卫生职业技术学院药学系,江苏盐城224005)
对江苏省药品生产企业2010年版GMP的实施现状以及认证中存在的主要问题进行了分析和总结,并为保障GMP的顺利实施提出了一系列可行的措施。
新版GMP;实施现状;问题;措施
0 引言
《药品生产质量管理规范(2010年修订)》(简称新版GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行新版GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,减少各种差错的发生,是提高药品质量的重要措施。
根据国家食品药品监督管理总局对药品生产企业的要求,自2011年3月1日起,凡是新建药品生产企业、药品生产企业新建(改、扩建)车间,均应符合《药品生产质量管理规范(2010年修订)》的相关要求。
对现有药品生产企业血液制品、疫苗、注射剂等无菌药品的生产,则应在2013年12月31日前达到《药品生产质量管理规范(2010年修订)》要求,其他类别药品的生产企业均应在2015年12月31日前达到《药品生产质量管理规范(2010年修订)》要求。
江苏省自2011年起实施新版GMP认证,本文将对我省2010年版GMP实施情况进行分析,找出企业在实施GMP过程中存在的共性问题,并提出相应的对策。
1 江苏省新版GMP实施现状
2015年12月31日将是非无菌制剂通过新版GMP的大限日期,以国家食品药品监督管理总局、江苏省食品药品监督管理局官方网站公布的数据为基础数据,到2015年5月31日为止,江苏省有药品生产许可证的526家药品生产企业中,经现场检查和审核批准,有近400家企业符合《药品生产质量管理规范(2010年修订)》要求,获得了416张《药品GMP证书》,占企业总数的76%。通过分析近几年非无菌制剂《药品GMP证书》年度核发情况(表1),可以看出通过率呈逐年上升的趋势,2013年和2014年通过认证的企业数量达到了高峰,江苏省各制药企业均在加紧完成新版GMP的认证工作。
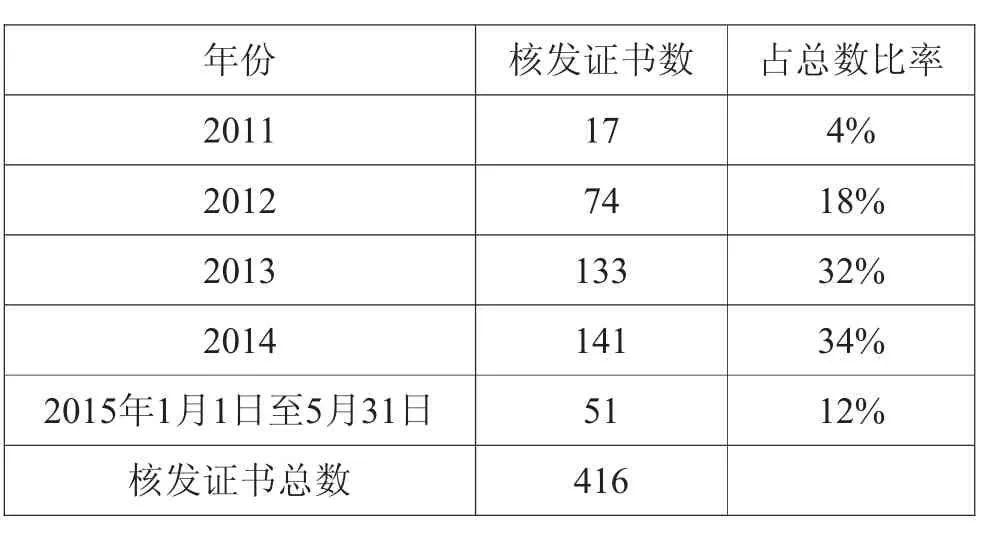
表1 非无菌制剂《药品GMP证书》年度核发情况
2 新版GMP实施过程中存在的问题
《药品生产质量管理规范认证管理办法》规定:严重缺陷指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷;主要缺陷指与药品GMP要求有较大偏离的缺陷;一般缺陷指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。
2.1 缺陷项目分布情况
通过收集资料和查阅相关文献发现,江苏省食品药品监督管理局对非无菌制剂企业进行新版GMP认证的现场检查中,缺陷项目主要集中在一般缺陷,少数属于主要缺陷,严重缺陷基本没有。除总则和附则外,2010年版GMP正文中的12个章节中均发现存在缺陷项,主要缺陷主要分布在确认与验证、机构与人员、文件管理、厂房与设施、质量控制与质量保证;一般缺陷主要分布在设备、文件管理、质量控制与质量保证;质量管理、委托生产与委托检验、产品发运与召回、自检的缺陷项较少。
文献中指出主要缺陷的表现大致包括:
(1)确认与验证方面的主要缺陷表现在关键设备确认、清洁验证或工艺验证工作没有做,或者项目和内容不全、数据不完整;
(2)机构与人员方面的主要缺陷表现在培训效果较差、人员资质不符合要求、人员配置不足和个人承担的职责过多;
(3)文件管理方面的主要缺陷表现在批生产记录设计的内容不完整、不合理,工艺规程内容不全等;
(4)厂房与设施方面的主要缺陷包括设计与布局不能有效防止污染、交叉污染、混淆和差错,设施选择不合理、不便于清洁,产尘操作间缺少除尘设施等;
(5)质量控制与质量保证方面的主要缺陷表现在物料和产品检验不符合要求,取样管理不规范以及标准品、对照品管理不规范等。
2.2 存在的主要问题以及对应措施
通过分析现场检查中各缺陷项目的主要表现和收集的资料发现,新版GMP实施过程中存在的问题主要表现在以下4个方面。
2.2.1 对新版GMP的理解与运用
部分企业在实施新版GMP的过程中,对新版GMP的实质和新概念理解不透彻,将其简单地理解为只是硬件改造和软件增补,把大量的资金投入到硬件的改造上。
其实,新版GMP的精髓在于完善质量管理体系和风险管理体系,企业应当在GMP质量管理中引入风险管理意识,将机构与人员、厂房与设施、物料与产品、文件与记录、生产与质量控制等各个环节有机地融合,通过变更控制、偏差处理、持续稳定性考察、产品质量回顾、GMP自查等一系列措施主动识别、控制并降低风险,通过纠正预防措施使质量体系得到持续改进,形成一套符合新版GMP要求的体系架构,有效贯彻于产品的质量和风险管理中,确保药品的安全有效。
2.2.2 硬件的改造建设
良好的厂房、完善的设施和先进的设备等硬件条件是GMP实施的基础,新版GMP在厂房设施、仪器设备等硬件建设上提出了更高的要求,大多数企业也都不惜投入大量的资金,用于建立更新生产厂房、购买先进的设备和设施,总体上硬件还是符合要求的。但是,制药企业这种大规模的厂房、设施、设备的改造和新建,也容易带来产品、人员和硬件之间的兼容性,厂房、设施和设备安装、运行和验证等方面的隐患。
制药企业应合理实施硬件改造和建设,把有限的资金用在关键的地方,提高生产的现代化、自动化和连续化能力,检验技术的规范化,注重硬件与人、工艺、参数、环境等结合,按照GMP要求完成硬
件的设计、安装、运行和性能的确认,为生产出符合规定用途和注册要求的药品提供保障。
2.2.3 企业相关人员素质
新版GMP关于人员素质的规定有较大的提高,如关键人员中引进“质量受权人”概念;提高了关键人员资质,要求本科以上学历、3~5年的药品生产经验以及质量管理经验;细化了人员职责规定,完善了人员培训规定。而现场检查情况均不同程度地反映出目前江苏省各制药企业相关部门工作人员的学历、培训和实践经验不符合新版GMP要求,相关人员质量管理意识淡薄,专业水平不高。
企业应该注重人才的引进和培养:配备符合新版GMP要求的数量足够的,并具有适当资质的工作人员;明确各个部门和各个岗位的职责;重视新版GMP的宣传培训工作,特别是变更控制、偏差管理、纠正和预防、质量风险管理和产品质量回顾等方面的新概念、新内容的培训,使企业相关人员及时有效地掌握并提升产品质量的知识和技能,提高自身的质量意识。
2.2.4 管理、操作与GMP文件不符
这是在各个环节普遍存在的问题,企业GMP文件里的规章制度与实际的管理工作和具体操作有不符合的现象。导致这一问题的主要原因包括:一方面,企业没有结合自身的具体品种、企业实际的管理模式、人员结构、现有的生产条件等实际,客观地起草编写GMP文件,而是更多地将其他企业的文件拿来生搬硬套、机械应用,导致制定的文件与实际不符,不具有可行性;另一方面,少数企业的相关管理和技术人员缺乏严格执行GMP文件、维护GMP文件的质量管理意识,存在侥幸心理。
要想解决这一问题,不仅要提升注重源头设计的理念和质量管理的意识,还要加强药品监管部门和企业自身的监督管理力度,后者尤为重要。企业有了一套较完善的管理制度和操作规程,要有较好的执行力,质量保证部门起到了关键的作用,企业应提高对质量保证部门的重视程度,培养监督人员的专业知识、执行工作的原则性和质量意识,充分发挥他们的质量监督作用。
3 结语
GMP认证是制药企业的生命线,它既是机遇,又是挑战。企业应当立足自身,积极采取有利措施,解决在实施新版GMP过程中遇到的实际困难和问题,顺利完成新版GMP的认证工作。
[1]国家食品药品监督管理局.关于实施《药品生产质量管理规范(2010年修订)》有关事宜的公告[EB/OL].(2011-02-28)[2015-08-31].http://www. sda.gov.cn/WS01/CL0087/59027.html.
[2]王金伟,陈永飞.2013年度江苏省药品生产企业新版GMP认证检查缺陷项目分析[J].药学与临床研究,2014,22(6).
[3]中华人民共和国卫生部.药品生产质量管理规范(2010年修订)[S].2011.
2015-09-02
程锦(1980—),女,江苏盐城人,硕士研究生,讲师,研究方向:药剂学。
2013年江苏省高等学校大学生实践创新训练计划,项目编号:201312682004Y

