KI溶液对冬虫夏草生物量及多糖含量的影响
杨绍斌,赵 莹,孙慧珍,陈玉波
(沈阳大学 生命科学与工程学院,辽宁 沈阳 110044)
KI溶液对冬虫夏草生物量及多糖含量的影响
杨绍斌,赵 莹,孙慧珍,陈玉波
(沈阳大学 生命科学与工程学院,辽宁 沈阳 110044)
研究不同浓度KI溶液对冬虫夏草液体发酵液中虫草生物量和虫草多糖含量的影响,筛选出提高虫草生物量及虫草多糖含量的最优KI浓度.将不同浓度的KI溶液添加到虫草液体发酵培养基中,测定虫草生物量,提取虫草多糖,用苯酚-硫酸法对其含量进行检测.结果表明,在冬虫夏草液体发酵液中,添加KI溶液能明显提高虫草生物量及虫草多糖含量,当KI质量浓度为5 mg/mL时,虫草生物量质量浓度达31.64 mg/mL,菌丝体长势很强,胞内多糖含量为26.4 mg/g,胞外多糖质量浓度为3.6 mg/mL,为最优浓度梯度.冬虫夏草发酵培养过程中添加KI溶液能明显提高虫草生物量及虫草多糖含量.
冬虫夏草; KI; 发酵培养; 生物量; 虫草多糖
冬虫夏草(Cordycepssinensis(Berk.)Sacc.)属真菌门(Eumycota)、子囊菌亚门(Ascomycotina)、核菌纲(pyrenomyerees)、麦角菌目(Clavieipitales)、麦角菌科(Clavieipitaceae)、虫草属(Cordyceps),寄生于蝙蝠蛾(Hepialusarmoricanus)幼虫上,主要分布在四川、青海、西藏等地,是我国传统的名贵中药材.冬虫夏草含有虫草多糖、虫草素、核苷类物质、麦角甾醇、虫草酸、蛋白质、SOD、氨基酸、维生素、多种微量元素及类胡萝卜素等多种有效成分[1].其富含虫草多糖(Polysaccharides from cultured mycelium ofCordycepssinensis,PCS),能降低胰岛素抵抗指数,减轻β细胞的负荷,具有胰岛素增敏作用[2-3].并且其味甘性平,以全草入药,具有非常重要的药用价值以及广泛的药理作用.由于冬虫夏草生长条件苛刻,天然资源匮乏,因此科技人员将研究开发的重点放在冬虫夏草的菌种培养上.但是在菌种发酵过程中,冬虫夏草菌丝体极易被氧化,影响菌丝体产量及多种有效成分的产率,目前有多种方法提高菌丝体产量及虫草多糖产率的方法,只是从抗氧化角度着手研究和开发其功效的尚少,在冬虫夏草液体发酵培养基中添加抗氧化KI溶液的效果鲜为人知.在液体发酵培养过程中,如何高效利用这一方法提高培养基的抗氧化性,提高冬虫夏草菌的产率,已成为亟待解决的问题.目前,有关液体培养时添加KI溶液对虫草生物量和虫草多糖含量的影响还未见报道,笔者进行了该研究[4-5].
本研究将9个浓度梯度的KI溶液添加到冬虫夏草液体发酵培养基中,通过对照实验和显著性测定,筛选出提高虫草生物量及虫草多糖含量的最优KI浓度,从而有效提高冬虫夏草的菌丝体生物量及虫草多糖含量,并且进行优化虫草液体培养实验,对虫草产业发展具有一定的理论与实践意义[6].
1 材 料
1.1 供试菌株
冬虫夏草菌种(Hirsutellasinensis),由中国科学院微生物研究所提供,于沈阳大学重点实验室低温保存.
马铃薯、葡萄糖、大豆粉、蚕蛹粉、蛋白胨、KH2PO4、MgSO4、维生素B1、琼脂、蔗糖、牛肉膏、95%乙醇.其他试剂为国产分析纯.
1.2 主要仪器
DHC-9146电热恒温鼓风干燥箱、DNP-9082型电热恒温培养箱(上海精宏实验制备有限公司);PB-10pH计(北京赛多利斯仪器系统有限公司);Lab Alliance 3500G高效液相色谱仪(美国SSI公司);SW-GJ-2FD洁净工作台(苏州安泰空气技术有限公司);681磁力加热搅拌器(上海南汇电讯器材厂);高速冷冻离心机(美国科峻仪器公司);HZS-H型水浴振荡器(哈尔滨东联电子开发有限公司);RE5299旋转蒸发仪(上海亚荣仪器有限公司);PB203-N电子天平(深圳市怡华新电子有限公司);FW177中草药粉碎机(天津泰斯特有限责任公司);721分光光度计(上海仪电分析仪器有限公司).
2 实验方法
2.1 培养基设计
(1) 斜面培养基:马铃薯200 g,葡萄糖20 g,牛肉膏10 g,蚕蛹粉10 g,蛋白胨10 g,KH2PO43 g,MgSO4·7H2O1.5 g,维生素B110 mg,琼脂20 g,水1 000 mL.
(2) 种子培养基:马铃薯200 g,葡萄糖20 g,牛肉膏10 g,蛋白胨10 g,KH2PO43 g,MgSO4·7H2O1.5 g,维生素B110 mg,水1 000 mL.
(3) 发酵培养基:配方见表1.

表1 发酵培养基配方表Table1 Component of fermentation medium
2.2 接种培养
2.2.1 菌种的活化.将冷冻保藏的菌种无菌操作接种到斜面培养基中,27 ℃无光培养,斜面上菌丝洁白旺盛并无杂菌时待用.
2.2.2 种子培养液的制备.先将制备好的斜面培养基上的母种用接种铲取一块约20 mm2大小的菌苔接入种子培养基(装样量为50 mL/100 mL三角瓶)中,在27 ℃、130 r/min恒温振荡器上无光培养180 h,形成微小的菌球.
2.2.3 液体发酵培养.在100 mL三角瓶中装入50 mL发酵培养液,每种配方KI溶液的添加量按培养基设计浓度梯度添加,配方一(对照组)不添加任何物质.121 ℃、20 min灭菌后接入培养180 h的种子液5 mL(为保证接种量的一致性,将1 mL枪头头部孔径剪大,用1 mL自动移液器分5次吸取种子液分别添加到不同培养基中.处理中,每次取样前将种子液摇匀,并颠倒取样顺序),培养温度26 ℃,摇床转速130 r/min,培养时间为300 h[7-8].
2.2.4 虫草胞外多糖提取.
(1) 发酵样品和透析袋的预处理.①发酵菌液离心(4 000 r/min×20 min),过滤,得到上清液和沉淀(菌丝体).②将透析袋剪成适当长度小段,在200 mL质量浓度为20 g/L的碳酸氢钠和浓度为1 mmol/L EDTA (pH=8.0)(体积比1∶1)中将透析袋煮沸10 min,用蒸馏水清洗透析袋,在浓度为1 mmol/L EDTA(pH=8.0)中将透析袋煮沸10 min,冷却后存放于4 ℃冰箱保存备用.
(2) 醇沉.取滤液50 mL,加入4倍体积的体积分数为95%乙醇溶液,于4 ℃下静置12 h,离心(3 000 r/min×15 min),过滤,取沉淀.加入少量无水乙醇、乙醚、丙酮洗涤沉淀并置于-25 ℃冷冻干燥.35 ℃解析至恒质量,即得冬虫夏草胞外粗多糖.
(3) 脱蛋白.取冬虫夏草胞外粗多糖,配制成质量浓度为10 mg/mL溶液.配制质量浓度为10 mg/mL胰蛋白酶溶液,保持酶解温度为37 ℃,pH7.5.将胞外粗多糖与胰蛋白酶按12∶1混合,酶解45 min.酶解后100 ℃水浴灭酶5 min,冷却至室温.离心(3 500 r/min×5 min),取上清液,加入体积分数为20%TCA溶液.静置12 h,离心取上清液,浓缩至相对密度为1.05(20~25 ℃),加入4倍体积的体积分数为95%乙醇,静置12 h,离心得沉淀,加入适量无水乙醇、丙酮、乙醚洗涤,抽滤,干燥后得冬虫夏草胞外多糖.
(4) 脱色.胞外多糖溶液加1.5%活性炭去色素,煮沸10~20 min,离心(4 000 r/min×20 min),过滤,留滤液.
(5) 透析.从冰箱中取出处理过的透析袋,用蒸馏水清洗,装入脱色后的多糖溶液,置于蒸馏水中透析24 h,将透析后的溶液加3倍体积乙醇于4 ℃沉淀12 h,离心沉淀干燥,得冬虫夏草胞外多糖.
2.2.5 虫草胞内多糖提取.
发酵所得的虫草菌丝体用研钵研碎,准确称取干燥的菌丝体50 g,按料液体积比1∶30加入蒸馏水.85 ℃水浴浸提3 h,滤渣反复浸提3次,合并滤液,离心(2 500 r/min×20 min)取上清液.50 ℃减压浓缩至200 mL,加人4倍体积的体积分数为95%乙醇溶液,于4 ℃下静置12 h,离心(3 000 r/min×15 min)得沉淀.加入少量无水乙醇、乙醚、丙酮洗涤沉淀并置于-25 ℃冷冻干燥.35 ℃解析至恒质量,即得冬虫夏草胞内粗多糖[9].
同胞外多糖的制备步骤(3)、步骤(4)一样,得胞内多糖.
2.3 样品处理
2.3.1 观察菌丝体长势.菌丝体长势是评价菌丝体生长情况的重要指标.以菌丝体长势为指标,观察并记录每种配方中菌丝体的长势.观察结果用很强、强、较强、弱4个等级表示.
2.3.2 测定菌丝体的生物量干重.采用干质量法,离心(4 000 r/min×10 min),取菌丝体用蒸馏水冲洗2次后于60 ℃烘干箱中烘12 h至质量恒定,称量记录干菌质量.如上步骤,进行3次,取平均值.
2.3.3 多糖用苯酚-硫酸法测定[10].
3 结果与分析
3.1 不同质量浓度KI溶液对冬虫夏草液体发酵液中虫草生物量的影响
由表2可见,KI溶液对冬虫夏草液体发酵液中虫草生物量的作用明显.配方一作为对照试验没有加入KI溶液,虫草的生物量质量浓度为5.58 mg/mL,随着添加KI溶液质量浓度的增大,虫草生物量也在迅速增加,且菌丝体长势逐渐增强,当添加KI溶液质量浓度为5 mg/mL时,虫草生物量达到了峰值.随后,当添加的KI溶液质量浓度继续增大时,虫草的生物量并没有随之增加,反而呈下降趋势,菌丝体的长势在逐渐减弱,KI溶液添加量质量浓度为8 mg/mL时,虫草生物量质量浓度降为4.21 mg/mL,和配方一无KI溶液相比,不仅没有促进,还起到了抑制的效果,不利于虫草菌丝体的培养.可见,KI溶液对于虫草的长势以及生物量有一个最适合的质量浓度,过多或者过少都不利于冬虫夏草生物量的积累,当KI质量浓度为5 mg/mL时,是最优质量浓度梯度,得到的虫草生物量含量最高.
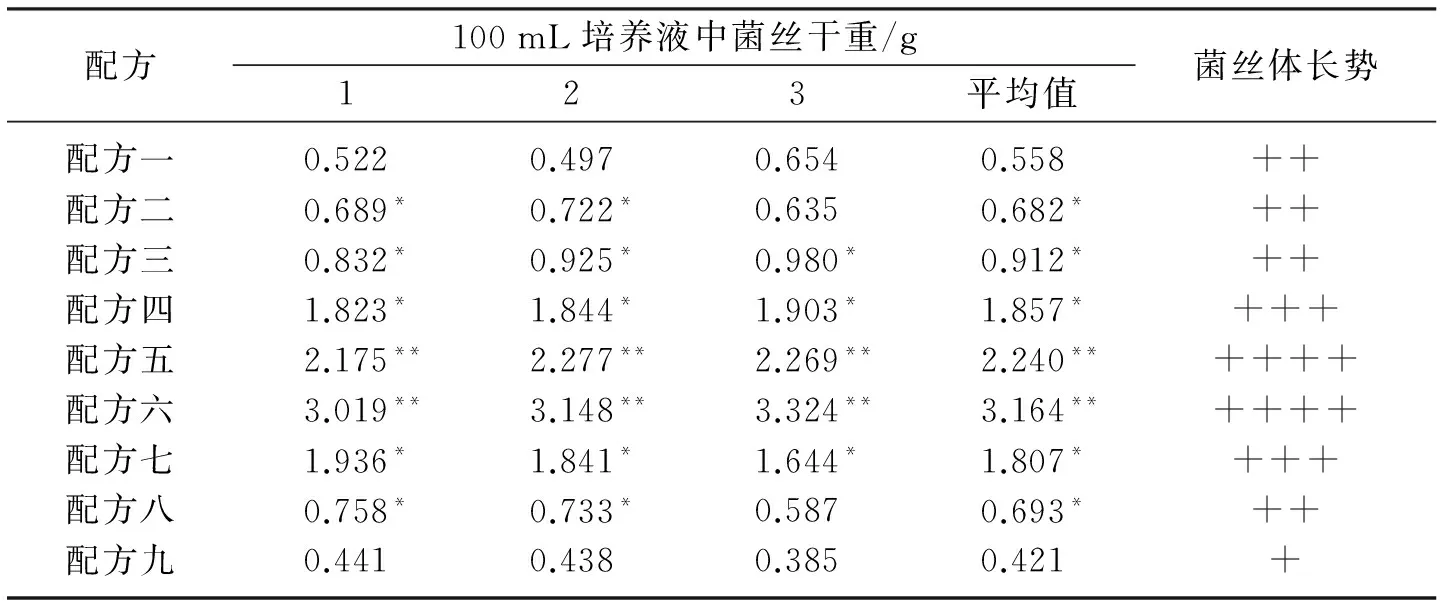
表2 不同质量浓度KI溶液对虫草生物量的影响Table2 Effects of KI solution of different concentration on biomass of Cordyceps sinensis
注: 菌丝体长势 +表示弱,++表示较强,+++表示强,++++表示很强.*p<0.05,与配方一 相比,差异显著;**p<0.01,与配方一相比,差异极显著.
3.2 不同质量浓度KI溶液对冬虫夏草液体发酵液中虫草多糖含量的影响
由表3可见,配方一作为对照试验没有加入KI溶液.当添加KI溶液质量浓度为0~5 mg/mL 时,虫草胞内多糖含量平稳增加;当KI溶液质量浓度添加量为5 mg/mL时,胞内多糖含量达26.4 mg/g,此时虫草胞内多糖产量最高.随着KI添加量的进一步增加,虫草胞内多糖含量在逐渐减少,配方九中KI溶液添加量为8 mg/mL,虫草胞内多糖含量为24.1 mg/g,和配方一相比虽然增加幅度也很大,但并不是最优质量浓度梯度.当KI溶液质量浓度为0~5 mg/mL时,虫草胞外多糖含量逐渐增加;配方六中KI溶液添加量为5 mg/mL时,虫草胞外多糖产量最高质量浓度达3.6 mg/mL.同样随着添加KI溶液质量浓度的增加,虫草胞外多糖含量明显下降,配方九中KI溶液添加量为8 mg/mL,虫草胞外多糖含量为2.1 mg/mL,较配方六明显减少许多.由表3可得,不同质量浓度KI溶液对胞内多糖和胞外多糖含量的影响,KI质量浓度为5 mg/mL都是最优质量浓度梯度,所得到的虫草多糖含量最高.
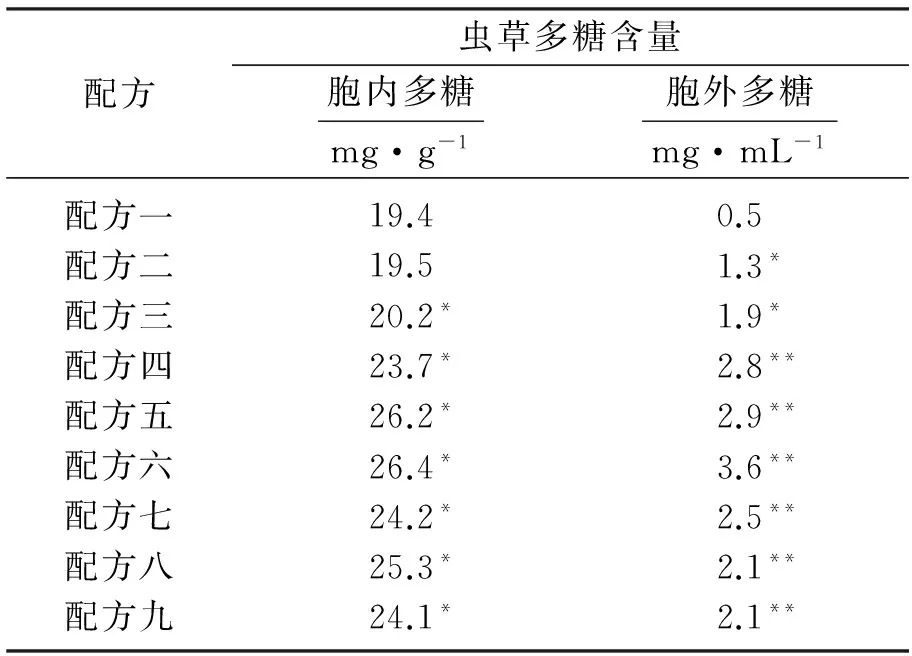
表3 不同质量浓度KI溶液对虫草多糖含量的影响Table3 Effects of KI solution of different concentrations on content of cordyceps polysaccharide
注: *p<0.05,与配方一相比,差异显著;**p<0.01,与配方一相比,差异极显著.
4 讨 论
本研究结果表明,不同质量浓度梯度KI溶液的添加对冬虫夏草液体发酵液中虫草生物量和虫草多糖的合成有不同程度的影响.从虫草生物量方面看,当KI溶液质量浓度在1~7 mg/mL时有促进作用,虫草生物量均高于配方一(空白对照组);从虫草多糖含量方面看,当KI溶液质量浓度在1~8 mg/mL时有促进作用,虫草多糖含量均高于配方一(空白对照组).其中当KI质量浓度为0~5 mg/mL时,虫草生物量随着KI溶液浓度的增加在迅速增加,虫草胞内多糖含量与胞外多糖含量平稳增加,说明KI溶液质量浓度在0~5 mg/mL范围内时虫草生物量和虫草多糖含量均呈上升趋势.当KI质量浓度为5 mg/mL时,虫草生物量达31.64 mg/mL,且菌丝体长势很强,胞内多糖为26.4 mg/g,胞外多糖为3.6 mg/mL,对虫草生物量的影响和虫草多糖合成的促进作用最明显,说明KI质量浓度为5 mg/mL的抗氧化性对虫草菌丝体的培养和虫草多糖的合成产生显著的影响,为最优质量浓度梯度.
从微生物代谢角度进行分析可知,菌丝体的液体发酵培养中,菌丝体极易接触空气进而被氧化.因此KI溶液的添加能直接与氧气进行氧化还原反应,保护菌丝体,促进菌丝体生长,增加菌丝体生物量,保护糖类代谢转化,促进多糖的合成.但当KI溶液浓度过高时,液体培养基会出现浑浊现象,并伴随胶体产生,不利于虫草菌丝体的培养和虫草多糖的合成.关于KI溶液对虫草素等其他成分的合成促进机理还不明确,有待进一步探讨.
[1] 邹赢锌,陈雅琳,储智勇,等.冬虫夏草成分及活性研究进展[J].海军医学杂志,2014(1):83-85.
(Zou Yingxin,Chen Yalin,Chu Zhiyong,et al.Research Advance in Constituents and Pharmacological Activities of Cordyceps sinensis[J].Journal of Navy Medicine,2014(1):83-85.)
[2] 刘雪芹,于湄,张燕,等.虫草多糖对2型糖尿病小鼠InsR/IRS-1通路及糖代谢的影响[J].中国药师,2011,14(2):163-166.
(Liu Xueqin,Yu Mei,Zhang Yan,et al.Effects of Cordyceps Polysaccharide on InsR/IRS-1 Pathway and Glucose Metabolism in Type 2 Diabetic Mice[J].China Pharmacist,2011,14(2):163-166.)
[3] Hou Z,Zhang Z,Wu H.Effect ofSanguisdraxonis(a Chinese Traditional Herb) on the Formation of Insulin Resistance in Rats[J].Diabetes Research and Clinical Practice,2005,68(1):3-11.
[4] 张翼,王海燕,李军延,等.不同剂量的碘化钾与碘酸钾对大鼠血浆抗氧化能力的影响[J].中国地方病防治杂志,2013(3):166-168.
(Zhang Yi,Wang Haiyan,Li Junyan,et al.Effect of Potassium Iodide and Potassium Iodate on Antioxidative Capability of Rat Blood Plasma[J].Chinese Journal of Control of Endemic Diseases,2013(3):166-168.)
[5] 吴玲芳,王晓瑞,柳志强,等.冬虫夏草液体发酵培养的研究进展[J].发酵科技通讯,2014,43(4):25-29.
(Wu Lingfang,Wang Xiaorui,Liu Zhiqiang,et al.Research Advances in Submerged Fermentation ofCordycepssinensis[J].Fermentation Technology Communication,2014,43(4):25-29.)
[6] 李春丽,刘晓兰,陈慧鑫,等.蛹虫草深层培养产菌丝体及胞外多糖的初步研究[J].农产品加工:创新版,2010(2):22-26.
(Li Chunli,Liu Xiaolan,Chen Huixin,et al.Elementary Study on the Submerged Culture Conditions for Micellium and Exopolyasccharides Production byCordycepsmilitaris[J].Farm Products Processing: Innovational Edition,2010(2):22-26.)
[7] 王战勇,张建东,李莹,等.北虫草液体培养基的研究[J].辽宁石油化工大学学报,2004,24(1):19-21,25.
(Wang Zhanyong,Zhang Jiandong,Li Ying,et al.Liquid Medium onCordycepsmilitaris[J].Journal of Liaoning University of Petroleum & Chemical Technology,2004,24(1):19-21,25.)
[8] 张秀君.微生物在温室气体排放与吸收中的多样性[J].沈阳大学学报,2008,20(4):1-5.
(Zhang Xiujun.Microorganism Diversity in Production and Emission of Greenhouse Gases[J].Journal of Shenyang University,2008,20(4):1-5.)
[9] 周国海,张泳,赵力超,等.蛹虫草多糖提取纯化工艺研究[J].食品与机械,2014(5):220-224.(Zhou Guohai,Zhang Yong,Zhao Lichao,et al.Extraction and Purification of Polysaccharides fromCordycepsmilitaris[J].Food & Machinery,2014(5):220-224.)
[10] 来永斌,王琦,孙月.蛹虫草多糖含量的测定与分析[J].中成药,2001,23(7):517-518.
(Lai Yongbin,Wang Qi,Sun Yue.Determination and Analysis ofCordycepsmilitaris(Fr) Link’s Amylose Content[J].Chinese Traditional Patent Medicine,2001,23(7):517-518.)
【责任编辑: 祝 颖】
Effect of KI Solution on Contents of Polysaccharide and Biomass inCordycepssinensis
YangShaobin,ZhaoYing,SunHuizhen,ChenYubo
(College of Life Science and Bioengineering,Shenyang University,Shenyang 110044,China)
To study the effect KI of different concentration on the contents of polysaccharide and biomass inCordycepssinensisliquid fermentation medium,and select the optimal KI concentration to improve the polysaccharide contents and biomass inCordycepssinensis,KI of different concentration were added to theCordycepssinensisliquid fermentation medium,the biomass was measured and the cordyceps polysaccharides was extracted fromCordycepssinensis.The content was tested by using the phenol-sulfuric acid method.The results show that,in theCordycepssinensisfermentation medium,adding KI solution can obviously increase the contents of polysaccharide and biomass inCordycepssinensis.When the mass cencentration of KI is 5 mg/mL,biomass cencentration ofCordycepssinensisis 31.64 mg/100 mL,the mycelium growth is very strong,the content of intracellular polysaccharides is 26.4 mg/g,the concentration of extracellular polysaccharides is 3.6 mg/mL,which is the optimal concentration gradient.In the process ofCordycepssinensisliquid fermentation,adding KI solution can obviously increase the contents of polysaccharide and biomass.
Cordycepssinensis; KI; fermentation medium; biomass; cordyceps polysaccharide
2015-01-21
沈阳市科技计划项目(F13-216-9-00).
杨绍斌(1959-),男,辽宁沈阳人,沈阳大学教授.
2095-5456(2015)04-0272-05
TS 201.3
A

