替比夫定与拉米夫定阻断中国HBV母婴传播效应及安全性Meta分析
王丽,张艳琼,王宇明,何云
替比夫定与拉米夫定阻断中国HBV母婴传播效应及安全性Meta分析
王丽,张艳琼,王宇明,何云
目的评估孕妇在妊娠中晚期应用替比夫定(LdT)和拉米夫定(LAM)阻断HBV母婴传播的临床疗效及安全性。方法检索经LdT和LAM治疗后阻断HBV母婴传播的临床文献,并应用RevMan 5.2软件对HBV感染孕妇血清HBV DNA水平以及婴儿血清中HBsAg和HBVDNA阳性率进行合并性分析。结果共纳入11篇文献,其中LdT组926例,LAM组425例,对照组1056例。孕妇分娩前,LdT组和LAM组HBVDNA水平明显低于对照组,差异均有统计学意义[LdT组vs对照组:SMD=-4.22,95%CI(-4.39,-4.05),P<0.05;LAM组vs对照组:MD=-4.18,95%CI(-4.52,-3.85),P<0.05]。进一步分析发现LdT组HBV DNA下降更加明显,且病毒学应答高[LdT组vs LAM组:SMD=-0.61,95%CI(-0.77,-0.46),P<0.000 01;RR=1.58,95%CI(1.19,2.08),P<0.001]。随访6~12月龄婴儿,LdT组和LAM组婴儿血清中HBsAg和HBV DNA阳性率显著低于对照组[LdT组vs对照组:RR=0.05,95%CI(0.02,0.14),P<0.000 01;RR=0.04,95%CI(0.01,0.14),P<0.000 01。LAM组vs对照组:RR=0.21,95%CI(0.11,0.40),P<0.000 01;RR=0.22,95%CI(0.11,0.43),P<0.000 1]。进一步分析,LdT组在阻断HBV母婴传播的效应中与LAM组差异无统计学意义[LdT组vs LAM组:RR=0.36,95%CI(0.04,3.32),P=0.36]。结论妊娠中晚期孕妇经LdT或LAM抗病毒治疗后,血清中HBV DNA水平均下降,LdT组HBV DNA水平下降更加明显,且LdT和LAM阻断HBV母婴传播的效应无明显差异。
乙型肝炎病毒;母体胎儿间交换;拉米夫定;治疗学
HBV感染呈全球性流行,约有20亿人曾感染过HBV,其中3亿~4亿发展为慢性HBV感染[1]。我国属于HBV感染高流行区,2006年流行病学调查发现我国1~59岁人群中HBsAg携带者占7.18%,约9300万为慢性感染,其中约2000万为慢性乙型肝炎(chronic hepatitis B,CHB)患者[2]。CHB患者中约50%通过母婴传播感染HBV,阻断母婴传播是预防HBV感染最有效和最关键的途径,新生儿肌内注射乙型肝炎免疫球蛋白(hepatitis B immune globulin,HBIG)和乙型肝炎疫苗联合免疫被认为是阻断母婴传播有效途径,但仍有5%~10%新生儿感染HBV[3-4]。由于孕妇血清中HBV DNA高水平,尤其达到106~108IU/ml时可导致胎盘绒毛膜毛细血管内皮细胞中出现HBV[5-6],引发宫内感染,因此降低孕妇血清中HBV DNA水平是关键。当前,大量研究发现拉米夫定(LAM)或替比夫定(LdT)能有效阻断HBV母婴传播,但在阻断母婴传播的效应性及安全性上是否有差异缺乏循证学依据。本研究旨在通过Meta分析,综合性评价二者阻断母婴传播的效应性及安全性,为阻断HBV母婴传播提供更准确和可靠的依据。
1 方法
1.1 文献收集通过检索PubMed、EMBASE、MEDLINE、中国生物医学文献数据库、万方数据库和中国知网等数据库,主要检索关键词为HBV、LdT、LAM、垂直传播、围生期传播、宫内感染和母婴传播等,截止时间为2014年10月,纳入对象为国内外公开发表的临床研究。
1.2 纳入和排除标准纳入标准:①前瞻性随机对照或非随机对照研究;②试验组和对照组均为CHB孕妇,在妊娠期间血清HBVDNA水平高达106IU/ml;③试验组服用LdT(600 mg/次,1次/d)或LAM(100 mg/次,1次/d),对照组未使用任何抗病毒药物;④所有婴儿均给予主动和被动联合免疫,即注射乙型肝炎疫苗(0、1、6方案)和HBIG;⑤各独立研究均包含LdT或LAM组与对照组例数以及2组各观察指标数据;⑥效应指标,包括孕妇血清HBV DNA水平以及婴儿血清HBsAg和HBV DNA阳性率。排除标准:①原始数据重复文献;②孕妇HBV感染诊断不明确的文献;③孕妇妊娠期使用其他药物,如免疫调节剂、细胞毒性药物或皮质激素等;④无对照组临床分析文献;⑤孕妇合并其他感染。
1.3 纳入试验质量评价采用Jadad质量评分法,按是否进行随机分组、是否实施盲法、是否描述退出或失访人数及原因进行质量评价。RCTs分为l~5分(1~2分为低质量研究,3~5分为高质量研究)。
1.4 资料提取和分析从文献中主要提取第一作者、发表时间、受试组临床特征(病例数、孕妇平均年龄、基线HBVDNA水平及分娩前HBVDNA水平)、研究设计方法、孕妇用药时间和剂量,以及6~12月龄婴儿血清HBsAg和HBV DNA阳性率及不良事件等。当遇分歧时,通过讨论解决。主要对婴儿血清HBsAg和HBV DNA阳性率进行合并分析,其次对孕妇分娩前血清中HBV DNA水平进行合并分析。
1.5 统计学处理采用Cochrane Library专用软件RevMan 5.2版进行Meta分析,其中计量资料采用标准化均数差(SMD)或均数差(MD)及其95%CI为衡量效应尺度的指标;分类资料采用相对危险度(RR)或比值比(OR)及其95%CI作为衡量效应尺度的指标;当合并统计后,P<0.05表示差异有统计学意义。各研究间异质性检验使用I2检验,当P<0.10或I2>50%时,采用随机效应模型对各研究进行合并分析,反之采用固定效应模型。
2 结果
2.1 纳入文献基本情况本Meta分析从不同数据库共检索到相关文献261篇,通过阅读标题和摘要排除238篇,剩余23篇纳入本研究。通过全文阅读,发现6篇为综述或Meta分析,3篇无对照组,3篇数据不全,最后共纳入11篇文献(表1)。LdT组926例,LAM组425例,对照组1056例。
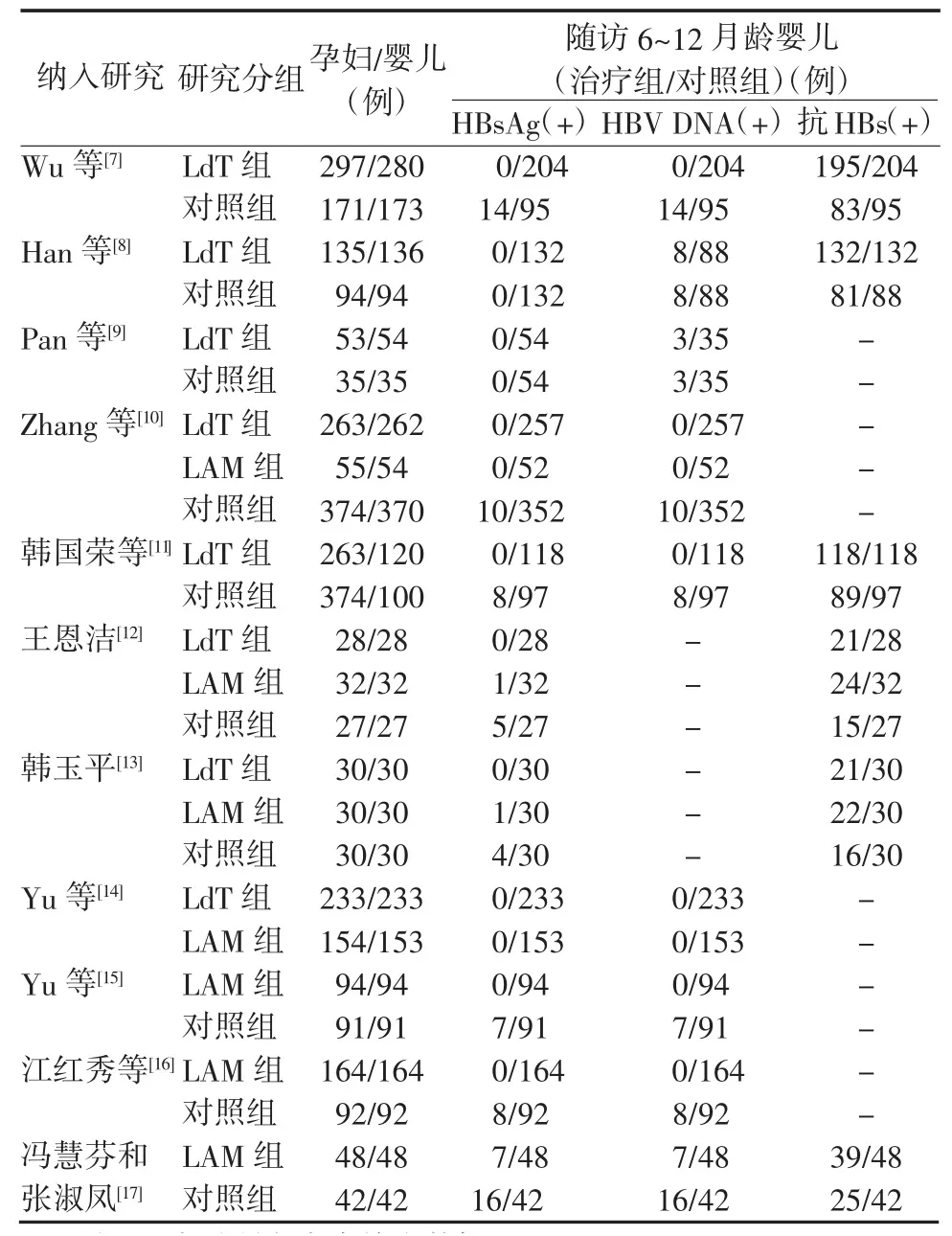
表1 M eta分析纳入文献的基本特征Table 1 Characteristics of the literatures included in the meta-analysis
2.2 孕妇分娩前血清HBV DNA水平比较7篇文献报道了LdT组和对照组孕妇分娩前血清HBV DNA水平,6篇报道了LAM组和对照组孕妇分娩前血清HBV DNA水平,经χ2和I2检验发现各文献间存在异质性(χ2=73.73,P<0.1,I2=92%;χ2=16.63,P=0.005;I2=70%)。采用随机效应模型进行合并性统计分析,证实经LdT或LAM治疗后孕妇血清HBV DNA水平明显降低,有统计学意义[SMD=-4.21,95%CI(-4.87,-3.56),P<0.000 01;MD=-4.18,95%CI(-4.52,-3.85);P<0.000 01](图1~2)。
4篇文献报道LdT组和LAM组孕妇分娩前HBV DNA水平,采用固定效应模型进行SMD合并分析,发现LdT组HBV DNA水平下降更加明显,2组间差异有统计学意义[SMD=-0.61,95%CI(-0.77,-0.46),P<0.000 01](图3)。其中2篇统计孕妇经抗病毒治疗后的病毒学应答,LdT组为36.29%(180/496),LAM组为22.49%(47/209),经RR合并分析发现差异有统计学意义[RR=1.58,95%CI(1.19,2.08);P=0.001]。
2.3 6~12月龄婴儿血清HBsAg、HBV DNA阳性率及抗HBs阳性率7篇文献报道了LdT组和对照组血清HBsAg阳性率,4篇报道了LdT组和对照组HBV DNA阳性率,采用固定效应模型RR进行合并分析(χ2=1.30,P=0.97,I2=0%;χ2=0.77,P=0.86,I2= 0%),LdT组婴儿血清HBsAg和HBV DNA阳性率均为0%,而对照组HBsAg和HBV DNA阳性率分别为7.18%(52/724)和10.48%(33/315),差异有统计学意义[RR=0.05,95%CI(0.02,0.14),P<0.000 01;RR=0.04,95%CI(0.01,0.14),P<0.000 01](图4~5)。LdT能有效阻断HBV母婴传播,且婴儿血清抗HBs阳性率差异有统计学意义[RR= 1.11,95%CI(1.06,1.17),P<0.000 01],分别为95.12%(487/512)和84.27%(284/337)。
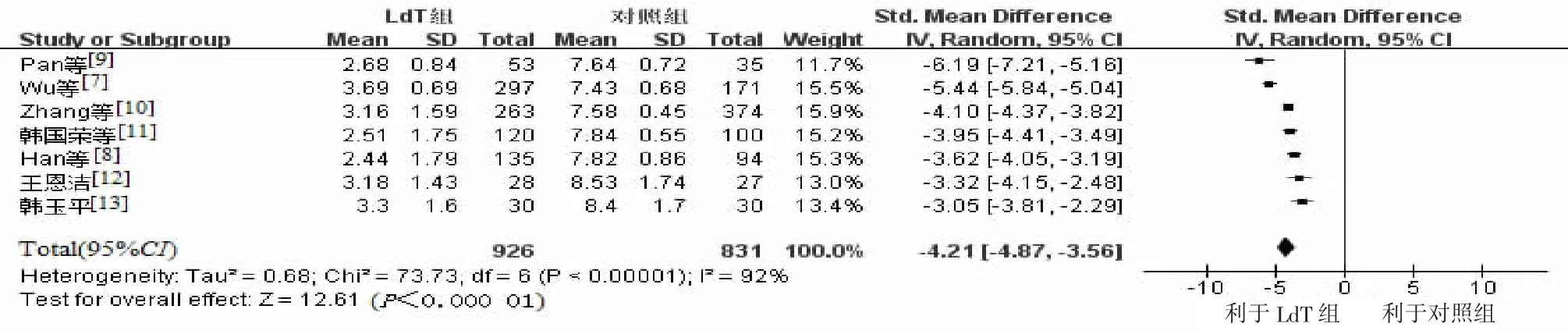
图1 经LdT治疗后孕妇分娩前血清HBV DNA水平与对照组比较森林图Figure 1 Com parison of serum HBV DNA levels prior to delivery between LdT group and the control group
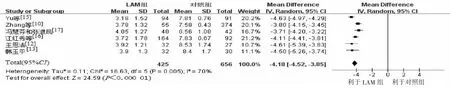
图2 经LAM治疗后孕妇分娩前血清HBV DNA水平与对照组比较森林图Figure 2 Com parison of serum HBV DNA levels prior to delivery between LAM group and the control group
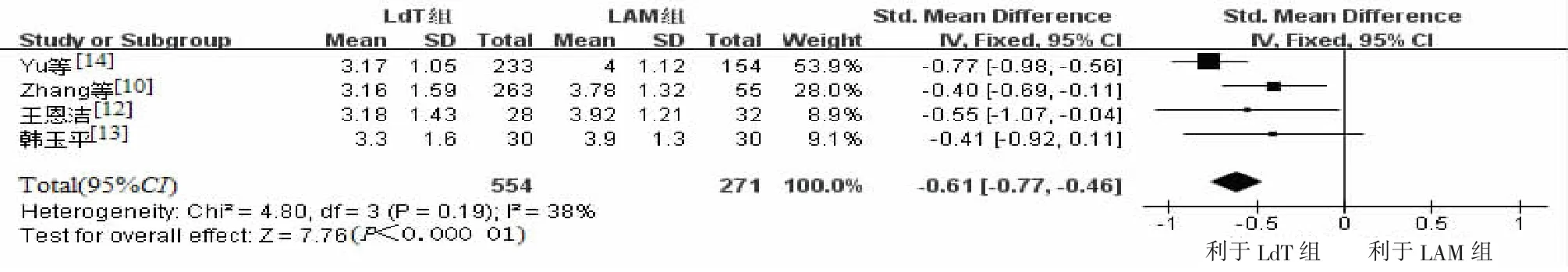
图3 经LdT和LAM治疗后孕妇分娩前血清HBV DNA水平比较森林图Figure 3 Comparison of serum HBV DNA levels prior to delivery between LdT group and LAM group
6篇文献统计了LAM组和对照组婴儿血清HBsAg阳性率,4篇统计了LAM组和对照组HBV DNA阳性率。采用固定效应模型RR进行合并分析(χ2=4.6,P=0.47,I2=0%;χ2=4.48,P=0.21,I2=33%),2组间差异有统计学意义[RR=0.21,95%CI(0.11,0.40),P<0.000 01;RR=0.22,95%CI(0.11,0.43),P<0.000 1](图6~7)。HBsAg阳性率分别为2.14%(9/420)和7.89%(50/634),HBV DNA阳性率为1.96%(7/358)和7.1%(41/577)。LAM能有效阻断HBV母婴传播,且婴儿血清抗HBs阳性率分别为77.27%(85/110)和56.57%(56/99),差异有统计学意义[RR=1.36,95%CI(1.12,1.67),P=0.002]。

图4 孕妇经LdT治疗后所生的6~12月龄婴儿血清HBsAg阳性率与对照组比较森林图Figure 4 Com parison of serum HBsAg positive rates of 6-12-month-old infants between LdT group and the control group
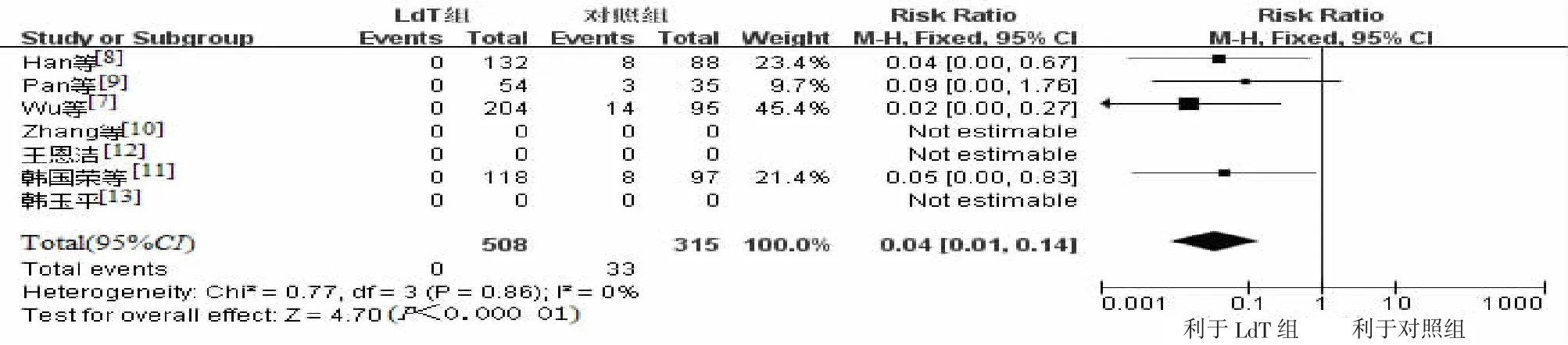
图5 孕妇经LdT治疗后所生的6~12月龄婴儿血清HBV DNA阳性率与对照组比较森林图Figure 5 Comparison of serum HBV DNA positive rates of 6-12-month-old infants between LdT group and the control group
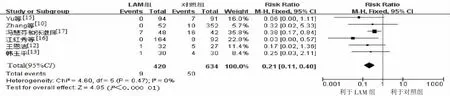
图6 孕妇经LAM治疗后所生的6~12月龄婴儿血清HBsAg阳性率与对照组比较森林图Figure 6 Comparison of serum HBsAg positive rates of 6-12-month-old infants between LAM group and the control group
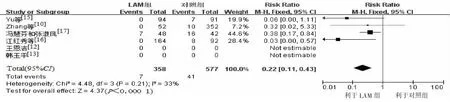
图7 孕妇经LAM治疗后所生的6~12月龄婴儿血清HBV DNA阳性率与对照组比较森林图Figure 7 Comparison of serum HBV DNA positive rates of 6-12-month-old infants between LAM group and the control group
4篇文献统计了LdT组和LAM组婴儿血清HBsAg阳性率,采用固定效应模型RR进行合并分析,发现2组间差异无统计学意义[RR=0.36,95% CI(0.04,3.32),P=0.36](图8),血清HBsAg阳性率分别为0%(0/548)和0.75%(2/267),提示LdT和 LAM阻断HBV母婴传播效应无明显差异,但是2组间婴儿血清抗HBs有统计学差异[RR=1.36,95% CI(1.03,1.8),P=0.03],抗HBs阳性率分别为74.2%(46/62)和54.4%(31/57)。
2.4 安全性评价7篇文献报道婴儿不良事件,其中2篇报道婴儿发生肺炎[8-9],LdT组9例,对照组6例。2篇报道LdT组孕妇血清中CK升高[10,14]。3篇提到婴儿先天性畸形[7,10],其中LdT组发现2例婴儿唇腭裂;对照组4例发生不良事件(6指、足内翻、唇腭裂及心室中隔缺失);LAM组未发现先天性畸形。
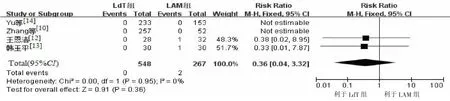
图8 LdT组和LAM组孕妇所生的6~12月龄婴儿血清HBsAg阳性率比较森林图Figure 8 Comparison of serum HBsAg positive rates of 6-12-month-old infants between LdT group and LAM group
3 讨论
我国多数CHB患者感染途径为母婴传播,过去认为晚期妊娠孕妇注射HBIG能阻断HBV母婴传播,然而宫内感染仍时常发生。近来发现,孕妇血清高HBV DNA水平是宫内感染的独立危险因素,降低HBV DNA水平是阻断HBV母婴传播的关键措施[18]。本研究发现,妊娠中晚期孕妇经LdT或LAM治疗后,分娩前HBV DNA水平均显著降低,但进一步分析发现2组间HBV DNA下降水平有显著统计学差异。经LdT/LAM治疗CHB的研究发现,LdT能更明显降低血清HBV DNA水平,病毒学应答更高,结果具有一致性,提示LdT更能有效抑制HBV DNA复制,更能降低孕妇血清HBV DNA水平[19]。LdT和LAM均为新型左旋核苷酸类药物,可高度特异性抑制HBV聚合酶[20-21]。本研究均未发现妊娠孕妇出现耐药,孕妇经抗病毒治疗4个多月,出现耐药的概率低[22]。但Allen等[23]对CHB患者长期服用LdT和LAM效应的荟萃分析,发现LAM在病毒学突破和病毒耐药率方面更为显著,1年耐药率为25%,5年耐药率高达76%,提示短期服用LdT和LAM安全性高,未来可对早期妊娠孕妇服用LAM和LdT的疗效和安全性进行研究。
近年研究发现,LdT和LAM在阻断HBV母婴传播的效应上无统计学差异[14]。本Meta分析通过扩大数据进行分析,发现LdT/LAM治疗均能显著降低HBV母婴传播,进一步分析发现其阻断母婴传播的效应差异无统计学意义,结果具有一致性。但LdT组婴儿血清学HBsAg或HBV DNA阳性率低于LAM组,分别为0%和0.75%,而婴儿血清学抗HBs阳性率显著高于LAM组,提示LdT在阻断HBV母婴传播效应上优于LAM。在安全性评价上发现LdT组孕妇血清CK高于对照组,经LdT治疗后,血清中常会出现CK升高,但为自限性或瞬时现象,不良事件发生率低[24]。LAM临床试验已证实其对孕妇的安全性[25],在本研究LAM组文献引入中,均未报道不良事件的发生,而且毒理学研究证实其无致癌性、致畸性、致突变性及无线粒体毒性[26]。
综上所述,本Meta分析提示高病毒载量孕妇服用LdT或LAM均能显著降低分娩前血清HBV DNA水平,且均无明显不良反应,但LdT在抑制病毒复制和病毒学应答效应上更优,在阻断HBV母婴传播的效应上无明显统计学意义。经LdT抗病毒治疗结合新生儿主被动免疫,能更有效降低HBV母婴传播,在此基础上,尚需更多临床数据来充实本研究结果。
[1]Kumar M,Sarin SK,Hi ss ar S,et al.Virologic and hi s tologic feature s of chronic hepatiti s B viru s-infected a s ymptomatic patient s with per s i s tently normal ALT[J].Ga s troenterology,2008,134(5): 1376-1384.
[2]Lu FM,Zhuang H.Management of hepatiti s B in China[J].Chin Med J(Engl),2009,122(1):3-4.
[3]Lavanchy D.Hepatiti s B viru s epidemiology,di s ea s e burden,treatment,and current and emerging prevention and control mea s ure s[J].JViral Hepat,2004,11(2):97-107.
[4]del Canho R,Gro s heide PM,Mazel JA,et al.Ten-year neonatal hepatiti s B vaccination program,The Netherland s,1982-1992: protective efficacy and long-term immunogenicity[J].Vaccine, 1997,15(15):1624-1630.
[5]Li XM,ShiMF,Yang YB,etal.Effect of hepatiti s B immunoglobulin on interruption of HBV intrauterine infection[J].World J Ga s troenterol,2004,10(21):3215-3217.
[6]Xu DZ,Yan YP,Choi BC,et al.Ri s k factor s and mechani s m of tran s placental tran s mi ss ion of hepatiti s B viru s:a ca s e-control s tudy[J].JMed Virol,2002,67(1):20-26.
[7]Wu Q,Huang H,Sun X,etal.Telbivudine prevent s vertical tran smi ss ion of hepatiti s B viru s from women with high viral load s:a pro s pective long-term s tudy[J].Clin Ga s troenterol Hepatol,2015, 13(6):1170-1176.
[8]Han GR,Cao MK,Zhao W,et al.A pro s pective and open-label s tudy for the efficacy and s afety of telbivudine in pregnancy for the prevention of perinatal tran s mi ss ion of hepatiti s B viru s infection[J].JHepatol,2011,55(6):1215-1221.
[9]Pan CQ,Han GR,Jiang HX,et al.Telbivudine prevent s vertical tran s mi ss ion from HBeAg-po s itive women with chronic hepatiti s B[J].Clin Ga s troenterol Hepatol,2012,10(5):520-526.
[10]Zhang H,Pan CQ,Pang Q,etal.Telbivudine or lamivudine u s e in late pregnancy s afely reduce s perinatal tran s mi ss ion of hepatiti s B viru s in real-life practice[J].Hepatology,2014,60(2):468-476.
[11]韩国荣,江红秀,王根菊,等.替比夫定对乙型肝炎病毒高载量孕妇母婴传播的阻断效果及其安全性[J].中华肝脏病杂志,2012,20(3):201-205.
[12]王恩洁.拉米夫定和替比夫定阻断孕晚期乙肝病毒母婴传播的疗效及安全性比较研究[J].中国全科医学,2012,15(31):3 628-3630.
[13]韩玉平.拉米夫定与替比夫定孕期抗病毒乙肝母婴阻断的疗效比较[J].河北医药,2014,36(3):389-390.
[14]Yu MM,Jiang Q,Ji Y,et al.Compari s on of telbivudine ver s u s lamivudine in interrupting perinatal tran s mi ss ion of hepatiti s B viru s[J].JClin Virol,2014,61(1):55-60.
[15]Yu M,Jiang Q,Ji Y,et al.The efficacy and s afety of antiviral therapy with lamivudine to s top the vertical tran s mi ss ion of hepatiti s B viru s[J].Eur JClin Microbiol Infect Di s,2012,31(9):2211-2218.
[16]江红秀,韩国荣,王根菊,等.妊娠后期拉米夫定抗病毒治疗HBV DNA高载量孕妇的母婴结局分析[J].中华肝脏病杂志,2012,20(12):888-891.
[17]冯慧芬,张淑凤.拉米夫定阻断乙型肝炎病毒母婴传播的作用[J].实用儿科临床杂志,2007,22(13):1019-1020.
[18]Jona s MM.Hepatiti s B and pregnancy:an undere s timated i ss ue[J].Liver Int,2009,29(Suppl 1):S133-S139.
[19]Hou J,Yin YK,Xu D,et al.Telbivudine ver s u s lamivudine in Chine s e patient s with chronic hepatiti s B:Re s ult s at 1 year of a randomized,double-blind trial[J].Hepatology,2008,47(2):447-454.
[20]Bridge s EG,Selden JR,Luo S.Nonclinical s afety profile of telbivudine,a novel potent antiviral agent for treatment of hepatiti s B[J].Antimicrob Agent s Chemother,2008,52(7):2521-2528.
[21]Han Z,Shi Y,Zhu J,etal.Forty-eight-week retro s pective s tudy of telbivudine and lamivudine treatment in patient s with hepatiti s B-related cirrho s i s[J].JViral Hepat,2013,20(Suppl 1):S58-S64.
[22]Shi Z,Yang Y,Ma L,et al.Lamivudine in late pregnancy to interrupt in utero tran s mi ss ion of hepatiti s B viru s:a s y s tematic review and meta-analy s i s[J].Ob s tet Gynecol,2010,116(1):147-159.
[23]Allen MI,De s laurier s M,Andrew s CW,et al.Identification and characterization of mutation s in hepatiti s B viru s re s i s tant to lamivudine.Lamivudine Clinical Inve s tigation Group[J].Hepatology, 1998,27(6):1670-1677.
[24]任江波,王宇,李红艺,等.替比夫定治疗慢性乙型肝炎期间肌酸激酶升高的观察与分析[J].中华肝脏病杂志,2012,20(9): 641-643.
[25]Yi W,Liu M,Cai HD.Safety of lamivudine treatment for chronic hepatiti s B in early pregnancy[J].World JGa s troenterol,2012,18 (45):6645-6650.
[26]Kura s hige N,Hiramat s u N,Ohkawa K,et al.Initial viral re s pon s e i s the mo s t powerful predictor of the emergence of YMDD mutant viru s in chronic hepatiti s B patient s treated with lamivudine[J]. Hepatol Re s,2008,38(5):450-456.
(2015-02-15收稿 2015-06-20修回)
(责任编委 王永怡 本文编辑 陈玉琪)
Efficacy and safety of telbivudine versus lam ivudine in interruptingmother-to-child transm ission of HBV:ameta-analysis
WANG Li,ZHANG Yan-qiong,WANG Yu-ming*,HE Yun*
Infectious Diseases Teaching and Research Section,Guiyang Medical University,Guiyang,Guizhou 550004,China
*Corresponding author.WANG Yu-ming,E-mail:wym417@163.com;HE Yun,E-mail:heyun66@126.com
Objectives To evaluate the clinicalefficacy and safety of telbivudine(LdT)and lamivudine(LAM)treatment in interruptingmother-to-child transmission of HBV in themiddle and late pregnancy.M ethods Clinical literatures about the interruption ofmother-to-child transmission of HBV after LdT or LAM treatmentwere retrieved.Ameta-analysiswas conducted by integrating the serum HBV DNA levelof the HBV-infectedmothersand serum HBsAg and HBV DNA positive ratesof the infantswith the RevMan 5.2 software.Results Eleven literatureswere included for themeta-analysiswith 926 cases in LdT group,425 cases in LAM group and 1056 controls in the control group,respectively.Before delivery,HBV DNA levels of LdT group and LAM group were both lower than those of the control group,and the differences between them were significant[LdT group vs control group:SMD=-4.22,95%CI (-4.39,-4.05),P<0.05;LAM group vs controlgroup:MD=-4.18,95%CI(-4.52,-3.85),P<0.05].Compared with LAM group,HBV DNA levelof LdT group decreasedmore greatly,and the virological response ratewas higher[LdT group vs LAM group:SMD=-0.61, 95%CI I(-0.77,-0.46),P<0.00001;RR=1.58,95%CI(1.19,2.08),P<0.001].After 6-12months of follow-up after delivery,serum HBsAg and HBV DNA positive rates of the infants of LdT group and LAM group were significantly lower than those of the controlgroup [LdTgroup vs the controlgroup:RR=0.05,95%CI(0.02,0.14),P<0.000 01;RR=0.04,95%CI(0.01,0.14),P<0.000 01.LAM group vs the controlgroup:RR=0.21,95%CI(0.11,0.40),P<0.000 01;RR=0.22,95%CI(0.11,0.43),P<0.000 1].LdTgroup and LAM group showed no significantdifference in blockingmother-to-child transmission of HBV[LdT group vs LAM group:RR=0.36,95%CI(0.04, 3.32),P=0.360].Conclusions Pregnantwomen receiving LdT treatmentor LAM treatmentduring themiddle and late pregnancy have decreased levelof serum HBV DNA,but the level of those receiving LdT treatment decreasesmoremarkedly.Moreover,LdT treatment and LAM treatmentare notsignificantly different in blockingmother-to-child transmission of HBV
hepatitis B virus;maternal-fetalexchange;lamivudine;therapeutics
R373.21
A
1007-8134(2015)04-0217-06
10.3969/j.issn.1007-8134.2015.04.008
国家自然科学基金(30830090);国家“十二五”科技重大专项(2012ZX10002004-004)
550000,贵阳医学院感染科教研室(王丽);400038重庆,第三军医大学西南医院全军感染病研究所(张艳琼、王宇明);100091北京,解放军第三〇九医院门诊部(何云)
王宇明,E-mail:wym417@163.com;何云,E-mail:heyun 66@126.com

