AMPK信号通路在ECG诱导人鼻咽癌细胞株C666-1凋亡中的作用研究
蔡 轶 赵 莉
(广州医科大学药学院蛇毒研究所,广东广州511436)
AMPK信号通路在ECG诱导人鼻咽癌细胞株C666-1凋亡中的作用研究
蔡 轶 赵 莉
(广州医科大学药学院蛇毒研究所,广东广州511436)
目的研究AMPK信号通路在ECG诱导人鼻咽癌细胞株C666-1凋亡中的作用。方法人鼻咽癌C666-1细胞给予AMPK特异性抑制剂compound C或不同浓度ECG处理后,分别采用CCK-8法和TUNEL染色法检测细胞增殖情况和凋亡;采用Western blotting法检测AMPK、p70S6K、S6等相关蛋白磷酸化水平。结果ECG可剂量依赖性地增加C666-1细胞中AMPK的磷酸化水平并抑制p70S6K和S6的磷酸化;给予compound C预处理之后可显著逆转ECG对C666-1细胞增殖和凋亡的影响,并逆转ECG对AMPK、p70S6K和S6等磷酸化水平的影响。结论ECG通过调控AMPK依赖的通路抑制人鼻咽癌细胞株C666-1增殖,并诱导其凋亡。
表儿茶素没食子酸酯;AMP激活的蛋白激酶;C666-1
表儿茶素没食子酸酯(epicatechin gallate,ECG)是绿茶多酚中的主要成分之一。研究表明ECG具有广泛的生物学功能,主要集中在消除自由基、抗氧化、杀菌抗病毒和抗肿瘤作用等方面[1-3]。我们在前期的研究工作中首次发现ECG可时间和剂量依赖性地抑制人鼻咽癌C666-1细胞增殖,并诱导其凋亡(已另文发表)。然而,ECG调控C666-1细胞增殖与凋亡的具体分子机制并不十分清楚。
AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)是一种在真核细胞中高度保守的丝氨酸/苏氨酸蛋白激酶,通常以异源三聚体的形式存在于哺乳动物几乎所有组织中[4]。激活AMPK可以增强分解代谢,抑制合成代谢,并调节细胞增殖、凋亡和自噬等多种生物学过程[5]。近年来AMPK在肿瘤发生与发展中的关系逐渐受到重视。AMPK可通过调控下游哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路调节肝癌、肺癌、鼻咽癌等多种肿瘤细胞的增殖与凋亡。然而,目前ECG与AMPK之间的关系国内外研究较少,AMPK是否参与ECG对人鼻咽癌细胞C666-1的增殖与凋亡的调控作用尚未见任何报道。本实验以人鼻咽癌细胞株C666-1为研究对象,通过观察ECG对AMPK信号通路的调控作用以及干预AMPK之后ECG对C666-1细胞增殖和凋亡的影响,初步探讨ECG抑制鼻咽癌的具体分子机制,为将ECG发展成治疗鼻咽癌的新型抗肿瘤药物提供必要的实验依据。
1 材料与方法
1.1 材料与试剂鼻咽癌细胞株C666-1由南方医科大学基础医学院肿瘤研究所姚开泰院士惠赠。DMEM高糖培养基和新生牛血清购自Gibco公司。ECG(纯度>95%)购自Sigma-Aldrich公司,用磷酸盐缓冲液(PBS)配成100 mM,-20℃避光保存;Cell Counting Kit-8(CCK-8)购自日本同仁化学研究所;一步法TUNEL细胞凋亡原位检测试剂盒购自南京凯基生物技术发展有限公司;p-AMPK,AMPK、pp70S6K、p70S6K、p-S6和S6兔多抗购自基因有限公司(CST);β-actin小鼠单抗、辣根过氧化物酶标记的羊抗鼠、羊抗兔二抗购自广州市洁利生物医学有限公司(Santa Cruz);AMPK抑制剂compound C购自Sigma-Aldrich公司,用DMSO配成50 mM,-20℃避光保存。
1.2 细胞培养与处理鼻咽癌细胞株C666-1使用含10%新生牛血清的DMEM高糖培养基,于培养箱内常规培养。取对数期生长细胞,根据实验要求接种至不同规格的细胞培养板中,待细胞贴壁后进行血清饥饿12 h,随后无血清条件下加入指定浓度的ECG或AMPK抑制剂compound C(20 μM)培养预定时间,培养结束后进行后续实验。
1.3 CCK-8法检测细胞增殖接种C666-1细胞于96孔板,血清饥饿完成之后,加入20 μM compound C预处理1 h后,再加入ECG继续处理48 h,每组设6个平行孔。处理结束后,每孔加入10 μl CCK-8试剂,继续在CO2培养箱内孵育1 h,450 nm波长处检测吸光度值A,并计算细胞增殖。增殖率(%)=实验组OD450/对照组OD450×100%。
1.4 TUNEL染色法检测细胞凋亡检测步骤按原位细胞凋亡检测试剂盒说明书进行。药物作用结束后,弃培养基,PBS漂洗,风干后室温下置于4%多聚甲醛固定15 min,PBS漂洗,1%Triton X-100通透液通透细胞5 min,3%H2O2封闭液封闭15 min,加入DNase I反应液避光反应30 min,漂洗DNase I反应液,加入TdT酶反应液,37℃避光反应30 min,漂洗后,于荧光显微镜下激发波长450~500 nm,发射波长515~565 nm检测荧光。细胞核呈绿色为TUNEL反应阳性细胞。显微镜下随机计数10个高倍视野下阳性细胞所占百分数即为细胞凋亡率。
1.5 Western blotting检测蛋白表达按照实验要求加入ECG或AMPK抑制剂compound C处理细胞,给药结束后,弃培养基,加入2×SDS sample buffer提取细胞总蛋白,依次进行聚丙烯酰胺凝胶电泳、电转、封闭,4℃孵育一抗过夜,第二日室温孵育二抗1 h,采用化学发光法检测蛋白表达情况,使用Image J软件进行条带灰度分析。
1.6 统计学方法使用SPSS 15.0软件进行统计学分析,各组数据以均值±标准差表示,采用单因素方差分析(One-way ANOVA)进行多组间比较,P≤0.05表明差异具有统计学意义。
2 结果
2.1 ECG对人鼻咽癌C666-1细胞AMPK信号通路的影响不同浓度ECG(0、25、50、100 μM)处理C666-1细胞48 h后,采用Western Blotting检测C666-1细胞AMPK、p70S6K、S6三种蛋白磷酸化水平的变化。结果表明,随ECG浓度的增加,AMPK的磷酸化水平显著增加,其下游mTOR信号通路中p70S6K和S6的磷酸化水平均显著下降(图1)。
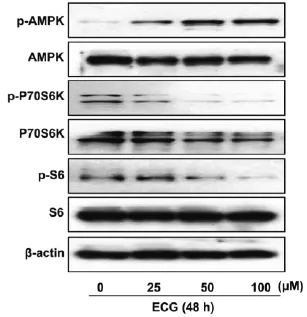
图1 ECG对人鼻咽癌C666-1细胞AMPK信号通路的影响
2.2 ECG通过激活AMPK抑制人鼻咽癌C666-1细胞增殖为了明确AMPK是否参与了ECG对C666-1增殖的影响,我们给予C666-1细胞20 μM compound C预处理1 h,再加入ECG(100 μM)继续刺激C666-1细胞48 h,采用CCK-8检测试剂盒检测ECG对细胞增殖的影响。结果表明,单独给予ECG,C666-1细胞的增殖率显著下降,给予compound C预处理可显著改善ECG诱导的细胞增殖率下降(图2)。
2.3 ECG通过激活AMPK诱导人鼻咽癌C666-1细胞凋亡为了明确AMPK是否参与了ECG对C666-1凋亡的影响,我们给予C666-1细胞20 μM compound C预处理1 h,再加入ECG(100 μM)继续刺激C666-1细胞48 h,采用Tunel法检测ECG对细胞凋亡的影响。结果表明,单独给予ECG,C666-1细胞的凋亡率显著增加,给予compound C预处理可保护ECG诱导的细胞凋亡(图3)。
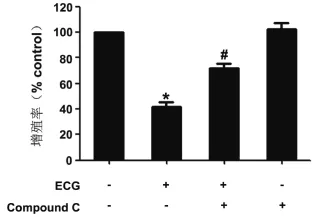
图2 ECG通过激活AMPK抑制人鼻咽癌C666-1细胞增殖与对照组比较,*P<0.05
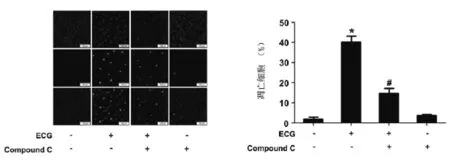
图3 ECG通过激活AMPK诱导人鼻咽癌C666-1细胞凋亡与对照组比较*P<0.05
2.4 AMPK参与ECG对其下游信号通路的调控作用C666-1细胞给予20 μM compound C预处理1 h,再加入ECG(100 μM)继续刺激C666-1细胞48 h,采用Western Blotting检测C666-1细胞AMPK、p70S6K、S6三种蛋白磷酸化水平的变化。结果表明,给予compound C预处理可逆转ECG对AMPK及其下游信号通路的调控作用(图4)。
3 讨论
鼻咽癌是我国南方地区高发的头颈部恶性肿瘤之一。由于鼻咽癌原发部位隐蔽,早期症状不明显,因此大多数鼻咽癌患者发现时多处于中晚期。单一采用放疗手段治疗中晚期鼻咽癌患者,其5~10年生存率仅为40%左右[6]。因此,寻找有效低毒的药物与放疗联合应用来提高鼻咽癌的治疗效果是目前需要解决的难题。ECG主要存在于茶属植物中,是绿茶多酚的主要成分之一。大量研究证明ECG具有抑制肿瘤细胞增殖、诱导凋亡、抑制肿瘤细胞的侵袭等多种生物学作用[7]。在本实验室前期的研究工作中首次发现ECG可抑制人鼻咽癌细胞C666-1的增殖并诱导其凋亡,提示ECG可能是一个潜在的治疗鼻咽癌的药物。但是迄今为止,ECG调控C666-1细胞的具体分子机制并不十分清楚,值得进一步研究。
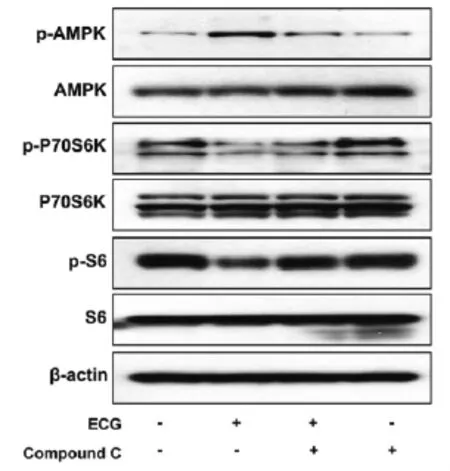
图4 AMPK参与ECG对其下游信号通路的调控作用
AMPK是生物能量代谢调节的关键分子。近年来,AMPK在肿瘤中的作用日益受到人们的关注。研究表明AMPK可降低肿瘤细胞在糖饥饿等代谢应激状态下的代谢活动,进而增强细胞的存活能力。糖饥饿时,AMPK被激活并进一步通过结节性硬化复合体(tuberous sclerosis complex,TSC)突变基因抑制其下游底物哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)减少蛋白合成、抑制肿瘤细胞生长[8]。mTOR与其结合蛋白可形成两种复合体,即mTORC1和mTORC2。mTORC1对雷帕霉素敏感,可调节mTOR下游底物核糖体蛋白S6激酶(p70S6K)及真核翻译启动因子(4EBP1);而mTORC2则调节肌动蛋白细胞骨架及蛋白激酶(Akt)[9]。在本实验中,我们首次发现ECG可剂量依赖性地增加C666-1细胞中AMPK的磷酸化水平进而抑制mTOR下游p70S6K和S6的磷酸化。为了进一步明确AMPK依赖的信号通路是否参与了ECG对人鼻咽癌C666-1细胞增殖和凋亡的调控作用,我们给予C666-1细胞AMPK的特异性抑制剂compound C预处理,并分别检测细胞的增殖的凋亡。单独给予ECG之后,C666-1细胞增殖率下降,凋亡率增加。给予compound C预处理可显著逆转ECG对C666-1增殖和凋亡的影响。进一步的研究表明compound C预处理还可逆转ECG对AMPK及其下游信号通路的调控作用。
综上所述,本实验证明ECG通过调控AMPK及其下游mTOR信号通路诱导人鼻咽癌C666-1细胞凋亡。本研究为ECG在鼻咽癌防治中的应用提供了必要的理论依据。
[1]Chen L,B Yu,Y Zhang,et al.Bioactivity-Guided Fractionation of an Antidiarrheal Chinese Herb Rhodiola kirilowii(Regel)Maxim Reveals-Epicatechin-3-Gallate and-Epigallocatechin-3-Gallate as Inhibitors of Cystic Fibrosis Transmembrane Conductance Regulator[J].PLoS One,2015,10(3):e0119122.
[2]Byun M R,M K Sung,A R Kim,et al.Epicatechin gallate (ECG)stimulates osteoblast differentiation via Runt-related transcription factor 2(RUNX2)and transcriptional coactivator with PDZ-binding motif(TAZ)-mediated transcriptional activation[J].J Biol Chem,2014,289(14):9926-9935.
[3]Siddique Y H,S Jyoti,F Naz.Effect of epicatechin gallate dietary supplementation on transgenic Drosophila model of Parkinson's disease[J].J Diet Suppl,2014,11(2):121-130.
[4]Han G,H Gong,Y Wang,et al.AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell[J].Cancer Biol Ther,2015,16(1):77-87.
[5]Andris F,O Leo.AMPK in lymphocyte metabolism and function[J].Int Rev Immunol,2015,34(1):67-81.
[6]Fang C Y,C C Wu,H Y Hsu,et al.EGCG inhibits proliferation,invasiveness and tumor growth by up-regulation of adhesion molecules,suppression of gelatinases activity,and induction of apoptosis in nasopharyngeal carcinoma cells[J].Int J Mol Sci,2015,16(2):2530-2558.
[7]Pan M H,Y S Chiou,Y J Wang,et al.Multistage carcinogenesis process as molecular targets in cancer chemoprevention by epicatechin-3-gallate[J].Food Funct,2011,2(2):101-110.
[8]Schuster S,M Penke,T Gorski,et al.FK866-induced NAMPT inhibition activates AMPK and downregulates mTOR signaling in hepatocarcinoma cells[J].Biochem Biophys Res Commun,2015,458(2):334-340.
[9]Li J,X Li,W Xu,et al.Antifibrotic effects of luteolin on hepatic stellate cells and liver fibrosis by targeting AKT/mTOR/p70S6K and TGFbeta/Smad signalling pathways[J].Liver Int,2015,35 (4):1222-1233.
ECG-induced cell apoptosis through AMPK signaling pathways in human nasopharyngeal carcinoma cell line C666-1
CAI Yi ZHAO Li
(Guangzhou Venom Research Institute,Guangzhou 511436,China)
Objective:To study whether AMPK participate in the effect of ECG on the apoptosis of nasopharyngeal carcinoma cell line C666-1.Methods:C666-1 cells were treated with different concentrations(0~100 μM)ECG or compound C,CCK-8 assay was used to evaluate the proliferation and Tunel assay was used to investigate the apoptosis of C666-1 cells.Western blotting was performed to detect the expression levels of p-AMPK,p-p70S6K and p-S6.Results:ECG increased the protein expression of p-AMPK and inhibited the expression level of p-p70S6K and p-S6 in C666-1 cells.Pretreated with compound C abrogated the effect of ECG on the proliferation,apoptosis and the protein expression of p-AMPK,p-p70S6K and p-S6 in nasopharyngeal carcinoma cell line C666-1.Conclusion:ECG inhibits proliferation and induces apoptosis of nasopharyngeal carcinoma cell line C666-1 by regulating AMPK-dependent signaling pathway.
epicatechin gallate;AMP-activated protein kinase;C666-1
R967
A
1004-7115(2015)07-0721-04
10.3969/j.issn.1004-7115.2015.07.001
2015-01-18)
国家自然科学基金青年项目(81300085),广东省自然科学基金博士启动项目(S2013040013895),广东省科技计划项目-广东省
高科技发展专项资金项目(2013B010403024),广州市教育局市属高校科技计划项目(1201430926),广州医科大学博士启动项目
(2012C03)。
蔡轶(1984-),男,安徽合肥人,助理研究员,博士,研究方向:药理学。
赵莉。

