间充质干细胞应用于软骨组织工程的研究进展
虞冀哲 董学海 陈海丹 赵红卫
间充质干细胞应用于软骨组织工程的研究进展
虞冀哲 董学海 陈海丹 赵红卫
本文主要回顾了不同来源的间充质干细胞作为种子细胞的软骨组织工程学研究进展,并讨论自体软骨细胞移植技术和诱导间充质干细胞成软骨分化的软骨组织再生技术各自的优缺点,并展望其临床应用前景。
间充质干细胞;软骨;组织工程;诱导分化;支架
由于自身少细胞,无血管淋巴分布的结构特点,软骨损伤后其自发再生和修复的能力十分有限,因此软骨缺损是临床骨关节疾病中常见的难题。传统的外科修复方法有关节镜下清创灌洗术、微骨折术、开放性自体骨膜移植术、自体骨软骨移植术和自体软骨细胞移植(autologouschondrocyteimplantation,ACI)等。其中ACI在临床中已经应用了几十年,虽然可以取得满意疗效,但仍存在很多问题,而且这种方法无法应用于大面积软骨缺损的再生修复。
对软骨再生修复技术的迫切需求推动了软骨组织工程的发展,而将种子细胞或种子细胞复合支架材料在体外条件下经生物活性物质诱导形成软骨组织以应用于软骨修复是软骨组织工程的主要内容。近年来,组织工程学的工作主要集中于干细胞的研究,而获取足量的、具有多向分化潜能的干细胞是关键。干细胞主要分为两种类型:一种是胚胎干细胞(ESCs);另一种为成体干细胞。成体干细胞是指存在于一种已经分化组织中的未分化细胞,主要包括造血干细胞、间充质干细胞和神经干细胞,其中间充质干细胞已被证实具有多向分化潜能。人类胚胎干细胞(ESCs)来源于囊胚的内层细胞团,是全能型多向潜能干细胞。相对于MSCs,ESCs在体外可表现出更强的自我更新能力和多向分化潜能,可作为肌肉骨骼组织再生修复的一种潜在细胞来源[1]。然而,即使在体外特定诱导条件下,胚胎干细胞仍然有产生畸胎瘤的趋势[2],这迫使科学家和临床医生对其任何临床应用都保持谨慎。此外,与之相关的伦理和法律障碍也使其临床应用更加困难,许多国家已明令禁止将胚胎干细胞应用于临床治疗。为了规避研究胚胎干细胞所面临的伦理和法律问题,Kazutoshi Takahashi和ShinyaYamanaka等[3-6]研究人员利用病毒载体向小鼠成纤维细胞导入Oct3/4、Sox2、c-Myc和Klf这四种外源性转录因子基因,诱导成纤维细胞转化为多向潜能干细胞。产生的诱导多能干细胞(induced pluripotent stem cells, iPSCs)在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸胎瘤生成能力、分化能力等方面都与胚胎干细胞相似[7]。虽然iPSCs大有希望作为组织再生医学的另一种细胞来源[8],但在用于临床治疗之前,仍需要开展更多的研究并制定相关技术规范。
本文主要回顾了以间充质干细胞为种子细胞来源的软骨组织工程学研究进展,并讨论自体软骨细胞移植技术和诱导间充质干细胞成软骨分化的软骨组织再生技术各自的优缺点,并展望其应用前景。
1 软骨的组织结构及其损伤修复研究进展
软骨组织由软骨细胞、基质(ECM)及水分所构成。软骨细胞仅占软骨组织总体积的1%~2%[9]。软骨基质的化学组成主要为软骨粘蛋白和胶原纤维(II型胶原蛋白为主),其中软骨粘蛋白的主干为透明质酸分子,其蛋白核心结合了大量糖胺多糖类物质如硫酸角质蛋白和硫酸软骨素。软骨内无血管,但由于软骨组织内富含水分,易于与周围关节滑液及细胞外液进行营养物质或代谢废物的交换。
根据软骨组织内所含纤维成分的不同,可将软骨分为透明软骨、弹性软骨和纤维软骨三种。透明软骨基质主要成分为水、粘蛋白和 II型胶原蛋白,主要分布于关节软骨和肋软骨,在人体中起到承重负荷,减少关节间骨骼摩擦等重要的作用[10];弹性软骨基质中含有弹性蛋白,主要分布于耳廓及呼吸道等处,起着结构支撑的作用;纤维软骨分布于椎间盘、关节盘及耻骨联合等处,其基质中所含I型胶原比例较高。由于软骨内无血管,无论是哪种软骨发生损伤,其自我修复能力都十分有限。
运动损伤、创伤、感染、先天性畸形等因素均可导致关节软骨损伤或缺损,软骨损伤后,自我修复能力很差,当关节软骨缺损超过一定面积持续发展会导致骨性关节炎,给病人带来很大痛苦。目前临床上对于软骨损伤的治疗措施包括关节镜下清创灌洗术、微骨折术、开放性自体骨膜移植术、自体骨软骨移植术和自体软骨细胞移植 (ACT)等。然而,虽然软骨细胞移植术在临床上以应用了十几年,但仍面临了许多问题,如供体不足、供体位点坏死、疼痛、瘢痕形成等;而其它类型移植物如同种异体软骨和异质性支架材料,由于排斥反应,很容易引发感染或移植物吸收,最终导致修复失败。此外,软骨移植术通常需要外科手术切开操作,会影响局部肢体的美观。骨关节退变性疾病或创伤所致软骨缺损的再生修复已成为骨外科修复技术的一种挑战,而体外重建软骨组织有望从根本上解决软骨缺损修复的难题,为软骨组织供体来源的研究开辟一条新的途径。
近几年来,应用种子细胞或种子细胞复合支架材料经细胞因子的诱导作用在体外重建软骨移植物成为了软骨组织工程的主要内容[11]。诱导干细胞分化的生物性因素包括生物化学信号因子,细胞外基质,环境因素如压应力刺激以及细胞间信号转导等。多种因素的共同作用促进了细胞的增殖和分化,但其潜在的信号通路及生物学机制仍需要得到进一步的阐明。
2 软骨组织工程
为了满足组织工程学要求,种子细胞必须具有较强的自我更新和定向分化潜能。目前有多种细胞可用于软骨组织工程,包括自体软骨细胞、骨髓来源的间充质干细胞、脂肪来源的间充质干细胞、脐带干细胞、胚胎干细胞等,这些细胞在特定诱导培养条件下分化为软骨组织。在选择种子细胞时,必须考虑细胞的增值能力、细胞表型是否稳定、免疫原性等因素。目前美国食品与药品管理委员会 (FDA)仅批准将软骨细胞用于软骨缺损再生修复的治疗。
2.1 自体软骨细胞移植的应用现状
1987年,Peterson等[12]首次将自体软骨细胞移植用于临床,而Brittberg等[13]发表对软骨缺损修复技术最初的研究报告。自体软骨细胞移植术中使用的软骨细胞取自患者非负重关节面,通过4~6周的体外培养及增殖使软骨细胞达到足够数量,然后将细胞注入清创后的关节软骨缺损部位,从而用于自体软骨缺损的再生修复;由于新注入的软骨细胞无法立即附着,临床上通常将骨膜瓣缝合至关节软骨缺损处[14]。虽然经体外扩增的自体软骨细胞不会引起免疫排斥反应,但体外培养的软骨细胞可能出现去分化现象[15],这是因为在单层培养模式下,软骨细胞离开了特定的细胞外基质环境,失去了软骨特异性细胞表型,导致I型胶原表达增多而II型胶原表达减少[16,17]。最近研究表明利用琼脂糖凝胶、藻酸盐微球、胶原载体等将软骨细胞在体外进行三维培养,可以使软骨细胞保持表型特征[18];也有研究表明可在培养基中添加转化生长因子 (TGF-)和胰岛素样生长因子1(IGF-1)可延长或恢复单层培养软骨细胞的再分化能力[19]。
尽管有临床研究报道90%的软骨缺损患者经自体软骨细胞移植后恢复良好[20],但应注意的是它仅适用于50岁以上由于创伤所致的关节软骨缺损患者。此外,用于分离细胞的取活检部位必须为正常软骨组织,而这都是以牺牲自体健康组织为代价。临床中向软骨缺损部位注入经体外扩增培养的软骨细胞后,通常再使用骨膜瓣进行封盖,然而这仍然难以避免注入细胞受冲击或震荡,这也是术后软骨细胞存活率低 (仅10%~30%)的主要原因[21]。基质诱导自体软骨细胞移植 (matrix-induced autologous chondrocyte implantation, MACI)改进传统ACI中将体外培样软骨细胞直接注入软骨缺损位点的做法,MACI先将软骨细胞在体外接种至生物膜上,再将贴覆有软骨细胞的生物膜覆盖至软骨缺损处,这种事先固定细胞的方法有效提高了术后软骨细胞的存活率[22]。
2.2 间充质干细胞在软骨缺损修复中的应用
间充质干细胞 (MSCs)是来源于中胚层的具有多向分化潜能的成体干细胞。MSCs最早由Friedenstein等[23]于上世纪60年代从骨髓中分离出来,随后世界各国研究者们又陆续在各种组织、脏器之间和表面 (如骨膜)、骨髓、血管周围及疏松结缔组织等组织中发现间充质干细胞的存在[24,25],其中骨髓组织中含量最为丰富。随着间充质干细胞存在的部位不同,它们的分化潜能也有所差别,近年发现以骨髓中间充质干细胞的分化潜能最强[26]。然而,由于间充质干细胞属于混杂细胞,目前尚未发现特异性细胞表面标记,许多有关间充质干细胞的分子生物学特征还有待进一步研究。
2.2.1 骨髓间充质干细胞 (BMSCs)
大量研究表明,在体外特定培养条件下BMSCs能向成骨细胞,软骨细胞、脂肪细胞、神经细胞等分化[27],因此BMSCs在组织工程领域有着广阔的应用前景。目前以细胞治疗为目的而开展的骨髓间充质干细胞体外基础研究已得到迅速发展[28-32],而临床上也有大量应用骨髓间充质干细胞治疗节段性骨缺损、软骨病变、脊髓损伤[33-36]、血液系统疾病[37]及移植抗宿主病的成功案例。
大量研究表明TGF-在间充质干细胞向软骨细胞分化的过程中发挥重要作用。在TGF-的存在的情况下,MSCs逐渐由纤维样细胞演变为成熟软骨细胞形态,并伴有软骨特异性细胞外基质蛋白包括 II型胶原、糖胺聚糖和软骨粘蛋白的生成[38]。Wakitani等[39]通过胶原凝胶三维培养体系,诱导BMSCs分化为软骨细胞并应用于9例髌股关节软骨缺损患者的治疗,6个月后3位患者关节功能得到明显改善;Nejadnik等[40]将72例关节软骨缺损患者随机分为两组,一组使用BMSCs胶原凝胶三维培养诱导形成的软骨细胞修复缺损部位,而另一组使用自体软骨细胞移植,两年随访结果表明两种软骨修复方法效果相当,但第一组无需进行软骨活检这一侵入性操作;而Davatchi等[41]发现将体外扩增的BMSCs直接注入膝关节腔内也可明显改善骨性关节炎症状。
然而,用骨髓穿刺方法获取的骨髓组织中BMSCs含量极低 (仅占0.001%~0.01%),且骨髓中BMSCs的数量和质量都会随着年龄的增长或疾病的发生而下降[42]。Narcisi R[43]等将 BMSCs体外培养并大量扩增并进行成软骨诱导培养,结果发现随着BMSCs的不断扩增,其成软骨细胞分化的潜力逐渐下降,因此很大程度上阻碍了其临床应用。鉴于BMSCs应用过程中出现的这些问题,需要寻找比骨髓间充质干细胞更合适且容易获取的种子细胞,从而进一步推动组织工程学的发展。
2.2.2 脐带间充质干细胞(umbilicalcord-derived mesenchymal stem cells,UC-MSCs)
人体脐带长约60cm,直径1.0~2.5cm,表面覆盖羊膜,内含动静脉,血管周围被半透明的基质包绕着,这种基质称之为华通胶 (Wharton's jelly)。以往研究显示,脐带血、脐带血管内皮、Wharton'sjelly等可分离出间充质干细胞[44-46]。Romanov等[47]研究发现从Wharton's jelly中分离出MSCs (即脐带间充质干细胞)的比率达100%,而从脐带其它部分中分离出MSCs的比例仅30%。Ishige等[48]研究发现脐血间充质干细胞(UCB-MSCs)与脐带间充质干细胞(UC-MSCs)细胞形态和免疫表型无明显区别。UC-MSCs与BMSCs的分化潜能相差无异,在体内外也可分化为多种细胞和组织,然而其优势在于脐带是胎儿出生后的废弃组织,来源比较充足且不会给供者带来痛苦或伤害,且UC-MSCs具有不涉及医学伦理问题的优势。Wang等[49]将体外培养的BMSCs和UC-MSCs进行对比,发现UC-MSCs在单层培养时可形成更密集的成纤维样细胞集落单位(colony-formingunit,CFU),因此细胞增值速度更快。此外,脐带内间充质干细胞的含量很高,可在原代即获取足量的细胞。因此,相对于自体软骨细胞和BMSCs,UC-MSCs的组织工程学应用前景更为广阔。
2.2.3 脂肪间充质干细胞 (adipose-derived mesenchymal stem cells,ADMSCs)
脂肪间充质干细胞是从脂肪组织中分离出的MSCs,平均300mL脂肪组织中可分离出2.0×108~6.0×108个ADMSC,其分化潜能也与BMSCs相当。Lee等[50]报道软骨细胞可有效诱导ADMSCs向软骨细胞分化。Musumeci等[51]的研究表明体外诱导培养21天是ADMSCs分化为软骨细胞的最佳时间。国内郑东等[52]的研究结果显示通过慢病毒载体将TGF-3转染至ADMSCs可高速有效地促进其成软骨分化进程。
2.3 间充质干细胞的成软骨诱导及软骨生长因子
诱导间充质干细胞成软骨分化,是对软骨组织工程最为重要和相关的实际问题。目前已发现多种细胞因子可诱导MSCs成软骨分化,其中包括胰岛素样生长因子(IGFs)、TGF-、软骨来源的形态形成蛋白(cartilagederivedmorphogenetic proteins,CDMPs)、骨形态形成蛋白 (BMPs)、bFGF及整合素等。IGFs是最早被确认的可作用于软骨的生长因子之一,其中IGF-1是软骨基质合成的主要刺激因子。体外实验表明[53],IGF-1可以增加软骨组织的胶原和蛋白多糖的合成,同时抑制软骨基质降解。BMPs在软骨发育的多个环节中均发挥调节作用;bFGF是软骨细胞最强力的有丝分裂原,可以刺激软骨细胞增殖及诱导体内的关节软骨缺损修复;TGF-的作用较为复杂,其功能的实现依赖于其它生长因子之间的相互作用。地塞米松是MSCs分化的非特异性诱导剂,它既可以诱导MSCs成软骨分化,也可使MSCs分化成骨细胞或脂肪细胞等。检测培养细胞中 II型胶原的表达情况,可以帮助判断MSCs向软骨分化的程度。
2.4 软骨组织工程支架材料
对于关节软骨缺损来说,无论细胞,还是以生长因子为基础来进行组织工程软骨的修复与重建,在缺损区植入支架都是必要的。如果没有支架存在,植入细胞在较大的缺损空间内无法进行有序的组织与增殖。理想的支架材料应满足以下要求:具有良好的生物相容性;可生物降解;拥有足够的孔隙结构;具备承载生长因子的能力;能与周围组织融为一体等。然而目前还没有一种支架能完全满足这些条件,当前常用作软骨组织工程的支架材料主要有天然的胶原、纤维蛋白材料和人工合成的高分子聚合物如 PGA、PLA、琼脂糖凝胶、透明质酸凝胶及藻酸盐凝胶等 (表1)。
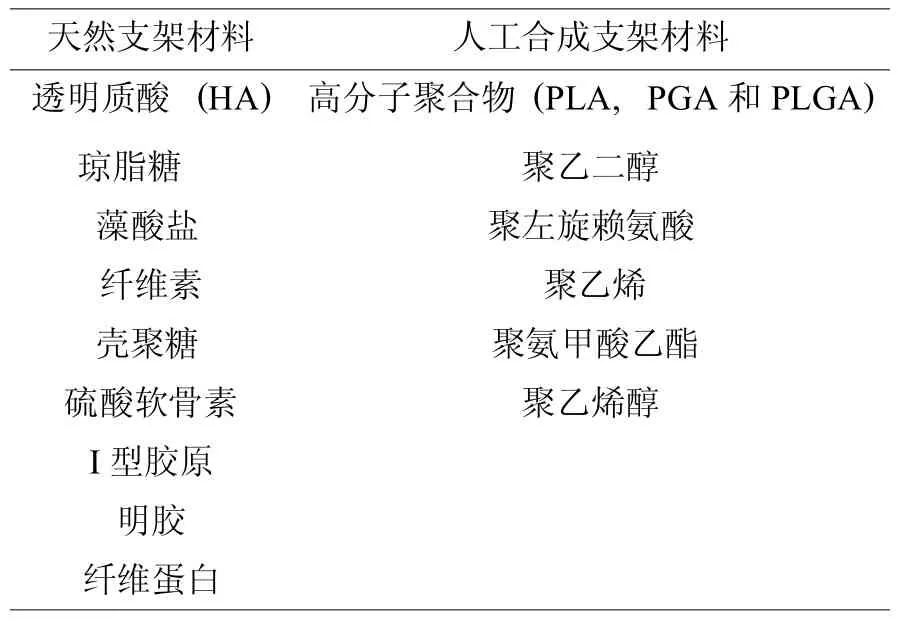
表1 可用于软骨组织工程的支架材料
3 MSCs应用于软骨缺损修复中存在的问题及未来展望
由于具有来源广泛、取材方便、安全性高、对机体损伤小、低免疫源性等优点,间充质干细胞已被认为是组织工程学理想的种子细胞。和软骨细胞相比,MSCs具有更强的增殖能力,因此能够通过体外扩增获得组织工程所需的大量细胞。目前,将组织工程和干细胞技术相结合已成为研究软骨和骨关节疾病治疗措施的一种新途径。尽管应用MSCs的软骨组织再生医学发展了很长时间,但MSCs在临床应用中仍有许多需要解决的问题,其遗传稳定性目前也仍有争议[54]。
未来软骨组织工程的工作重点应一方面规范MSCs的分离、体外培养及扩增技术,另一方面进一步研究MSCs成软骨分化的确切机制及软骨分化相关信号转导通路;同时还需寻找或研发更适合于软骨修复的天然或人工合成支架材料,使体外培养的组织工程软骨的生物学及机械特性与自体软骨更加接近,从而更进一步推动软骨再生修复医学的发展。
[1] RoobrouckVD,KVanuytsel,etal.Concise review:culture mediated changes in fate and/or potency of stem cells[J].Stem Cells, 2011,29(4):583-589.
[2] JukesJM,CAvanBlitterswijk,etal.Skeletaltissueengineeringusing embryonic stem cells[J].J Tissue Eng Regen M,2010,4(3):165-180. [3] Takahashi K,K Tanabe,et al.Induction of pluripotent stem cells fromadult humanfibroblastsbydefinedfactors[J].Cell,2007,131 (5):861-872.
[4] Nakagawa M,M Koyanagi,et al.Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts[J]. Nat Biotech,2008,26(1):101-106.
[5] Meissner A,M Wernig,et al.Direct reprogramming of genetically unmodified fibroblasts into pluripotent stem cells[J].Nat Biotech, 2007,25(10):1177-1181.
[6] YuJ,MAVodyanik,et al.Inducedpluripotentstem cell linesderived from human somatic cells[J].Science,2007,318(5858):1917-1920.
[7] Guenther MG,GM Frampton,et al.Chromatin structure and gene expression programsof humanembryonic and induced pluripotent stem cells[J].Cell Stem Cell,2010,7(2):249-257.
[8] Illich DJ,N Demir,et al.Concise review:induced pluripotent stem cells and lineage reprogramming:prospects for bone regeneration [J].Stem Cells,2011,29(4):555-563.
[9] Hunziker,EB,TM Quinn,et al.Quantitative structural organization of normal adult human articular cartilage[J].Osteoarthritis Cartilage,2002,10(7):564-572.
[10]SaintignyY,Cruet-hennequart S,Hamdi D H,et al.Impact of therapeutic irradiation on healthy articular cartilage[J].Radiat Res, 2015,183(2):135-146.
[11]Caldwell K L,Wang J.Cell-based articular cartilage repair:the link between development and regeneration[J].Osteoarthritis Cartilage,2015,239(3):351-362.
[12]Peterson L,T Minas,et al.Treatment of osteochondritis dissecans of the knee with autologous chondrocyte transplantation:results at two to ten years[J].J Bone Joint Surg Am,2003,85-A(Suppl 2):17-24.
[13]Brittberg M,A Lindahl,et al.Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation[J].N Engl J Med,1994,331(14):889-895.
[14]van der Linden,M H,Saris D,et al.Treatment of cartilaginous defects in the knee:recommendations from the Dutch Orthopaedic Association[J].Nederlands tijdschrift voor geneeskunde,2013,157 (3):5719.
[15]Cheng T,NC Maddox,et al.Comparison of gene expression patterns in articular cartilage and dedifferentiated articular chondrocytes[J].J Orthop Res,2012,30(2):234-245.
[16]Diaz-Romero J,JP Gaillard,et al.Immunophenotypic analysis of human articular chondrocytes:changes in surface markers associated with cell expansion in monolayer culture[J].J Cell Physiol, 2005,202(3):731-742.
[17]Cournil-Henrionnet C,C Huselstein,et al.Phenotypic analysis of cell surface markers and gene expression of human mesenchymal stem cells and chondrocytes during monolayer expansion[J].Biorheology,2008,45(3-4):513-526.
[18]Alexander P G,Gottardi R,Lin H,et al.Three-dimensional osteogenic and chondrogenic systems to model osteochondral physiology and degenerative joint diseases[J].Exp Biol Med,2014,239 (9):1080-1095.
[19]Patil A S,Sable R B,Kothari RM.Role of insulin-like growthfactors(IGFs),their receptors and genetic regulation in the chondrogenesis and growth of the mandibular condylar cartilage[J].J Cell Physiol,2012,227(5):1796-1804.
[20]Peterson L,T Minas,et al.Treatment of osteochondritis dissecans of the knee with autologous chondrocyte transplantation:results at two to ten years[J].J Bone Joint Surg Am,2003,85-A(Suppl 2):17-24.
[21]Beris AE,MG Lykissas,et al.Advances in articular cartilage repair [J].Injury,2005,36(Suppl 4):14-23.
[22]Bartlett,W,J Skinner,et al.Autologous chondrocyte implantation versus matrix-induced autologous chondrocyte implantation for osteochondral defects of the knee a prospective,randomised study [J].Journal of Bone and Joint Surgery,British Volume,2005,87 (5):640-645.
[23]Friedenstein AJ,KV Petrakova,et al.Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues[J].Transplantation,1968,6(2):230-247.
[24]Jorgensen C,DNoel.Mesenchymal stemcells in osteoarticular diseases[J].Regen Med,2011,6(6 Suppl):44-51.
[25]Kern S,H Eichler,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24(5):1294-1301.
[26]Hodgkiss-Geere,HM,DJ Argyle,et al.Characterisation and differentiation potential of bone marrow derived canine mesenchymal stem cells[J].Vet J,2012,194(3):361-368.
[27]NothU,LRackwitz,etal.Celldeliverytherapeuticsformusculoskeletal regeneration[J].Adv Drug Deliv Rev,2010,62(7-8):765-783.
[28]Satija NK,VK Singh,et al.Mesenchymal stem cell-based therapy: a new paradigm in regenerative medicine[J].J Cell Mol Med, 2009,13(11-12):4385-4402.
[29]Kuraitis D,M Ruel,et al.Mesenchymal stem cells for cardiovascular regeneration[J].Cardiovasc Drugs Ther,2011,25(4):349-362.
[30]Si YL,YL Zhao,et al.MSCs:Biological characteristics,clinical applications and their outstanding concerns[J].Ageing Res Rev, 2011,10(1):93-103.
[31]Albersen,M,M Kendirci,et al.Multipotent stromal cell therapy for cavernous nerve injury-induced erectile dysfunction[J].J Sex Med,2012,9(2):385-403.
[32]Ricart E.Current status of mesenchymal stem cell therapy and bone marrow transplantation in IBD[J].Dig Dis,2012,30(4):387-391.
[33]HuiJH,HWOuyang,etal.Mesenchymalstemcellsinmusculoskeletaltissueengineering:areviewofrecentadvancesinNationalUniversity of Singapore[J].Ann Acad Med Singapore,2005,34(2):206-212.
[34]Kraus KH,C Kirker-Head.Mesenchymal stem cells and bone regeneration[J].Vet Surg,2006,35(3):232-242.
[35]Mobasheri A,C Csaki,et al.Mesenchymal stem cells in connective tissue engineering and regenerative medicine:applications in cartilage repair and osteoarthritis therapy[J].Histol Histopathol, 2009,24(3):347-366.
[36]SykovaE,PJendelova,et al.Bone marrowstemcells andpolymer hydrogels--two strategies for spinal cord injury repair[J].Cell Mol Neurobiol,2006,26(7-8):1113-1129.
[37]Fouillard L,A Chapel,et al.Infusion of allogeneic-related HLA mismatched mesenchymal stem cells for the treatment of incomplete engraftment following autologous haematopoietic stem cell transplantation[J].Leukemia,2007,21(3):568-570.
[38]Danisovic L,I.Varga,S Polak.Growth factors and chondrogenic differentiation of mesenchymal stem cells[J].Tissue Cell,2012,44 (2):69-73.
[39]Wakitani S,M Nawata,et al.Repair of articular cartilage defects in the patello-femoral joint with autologous bone marrow mesenchymal cell transplantation:three case reports involving nine defects in five knees[J].J Tissue Eng Regen Med,2007,1(1):74-79.
[40]Nejadnik H,JH Hui,et al.Autologous bone marrow-derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study[J].Am J Sports Med,2010,38(6): 1110-1116.
[41]Davatchi F,BS Abdollahi,et al.Mesenchymal stem cell therapy for knee osteoarthritis.Preliminary report of four patients[J].Int J Rheum Dis,2011,14(2):211-215.
[42]Caplan AI.Why are MSCs therapeutic?New data:new insight[J]. J Pathol,2009,217(2):318-324.
[43]Narcisi R,Cleary M A,Brama P A,et al.Long-term expansion,enhanced chondrogenic potential,and suppression of endochondral ossification of adult human MSCs via WNT signaling modulation [J].Stem cell reports,2015,4(3):459-472.
[44]Covas DT,JL Siufi,et al.Isolation and culture of umbilical vein mesenchymal stem cells[J].Braz J Med Biol Res,2003,36(9): 1179-1183.
[45]Sarugaser R,D Lickorish,et al.Human umbilicalcordperivascular (HUCPV)cells:a source of mesenchymal progenitors[J].Stem Cells,2005,23(2):220-229.
[46]Karahuseyinoglu S,O Cinar,et al.Biology of stem cells in human umbilical cord stroma:in situ and in vitro surveys[J].Stem Cells, 2007,25(2):319-331.
[47]RomanovYA,VASvintsitskaya,etal.Searchingforalternativesources ofpostnatalhuman mesenchymalstem cells:candidateMSC-likecells fromumbilical cord[J].Stem Cells,2003,21(1):105-110.
[48]Ishige I,T Nagamura-Inoue,et al.Comparison of mesenchymal stem cellsderivedfromarterial,venous,andWharton'sjellyexplantsofhuman umbilical cord[J].Int J Hematol,2009,90(2):261-269.
[49]WangL,I Tran,et al.Acomparisonof human bonemarrow-derived mesenchymal stem cells and human umbilical cord-derived mesenchymal stromal cells for cartilage tissue engineering[J].Tissue Eng Part A,2009,15(8):2259-2266.
[50]Lee,JS and GI Im.Influence of chondrocytes onthe chondrogenic differentiation of adipose stem cells[J].Tissue Eng Part A,2010, 16(12):3569-3577.
[51]Musumeci G,Mobasheri A,Trovato F M,et al.Biosynthesis of collagen I,II,RUNX2 and lubricin at different time points of chondrogenic differentiation in a 3D in vitro model of human mesenchymal stem cells derived from adipose tissue[J].Acta Histochem,2014,116(8):1407-1417.
[52]Zheng D,Dan Y,Yang S H,et al.Controlled chondrogenesis from adipose-derived stem cells by recombinant transforming growth factor-beta3 fusion protein in peptide scaffolds[J].Acta biomater, 2015,11:191-203.
[53]Pasold J,Zander K,Heskamp B,et al.Positive impact of IGF-1-coupled nanoparticles on the differentiation potential of human chondrocytes cultured on collagen scaffolds[J].Int J Nanomed, 2015,10:1131-1143.
[54]Larsen K H,Andersen T E,Kassem M.Bone and cartilage repair using stem cells][J].Ugeskrift for laeger,2010,172(38):2616-2619.
Reviewed the research progress of cartilage tissue engineering using mesenchymal stem cells
Yu Jizhe,Dong Xuehai,Chen Haidan,et al.Department of Orthopedics,the First Clinical Medical College of Sanxia University(the Central People's Hospital of Yichang),Yichang Hubei,443003,China
In this article,we mainly reviewed the research progress of cartilage tissue engineering using mesenchymal stem cells,and discussed the advantages and disadvantages of autologous chondrocyte implantation and cartilage tissue regeneration based on chondrogenic induction of mesenchymal stem cells respectively,and its application prospect in clinical therapy.
Mesenchymal stem cells;Cartilage;Tissue engineering;Induced differentiation;Scaffold
R318
B
10.3969/j.issn.1672-5972.2015.04.019
swgk2015-03-00055
虞冀哲(1984-)男,医学博士,主治医师。工作方向:骨外科。
2015-03-19)
三峡大学第一临床医学院(宜昌市中心人民医院),湖北宜昌443003

