三维锌配位聚合物的合成、晶体结构及与DNA的作用
石 沛 沈 伟 余玉叶,3 吴小勇 赵国良*,,2
(1浙江师范大学化学与生命科学学院,金华321004)
(2浙江师范大学行知学院,金华321004)
(3浙江金华职业技术学院,金华321007)
三维锌配位聚合物的合成、晶体结构及与DNA的作用
石 沛1沈 伟1余玉叶1,3吴小勇1赵国良*,1,2
(1浙江师范大学化学与生命科学学院,金华321004)
(2浙江师范大学行知学院,金华321004)
(3浙江金华职业技术学院,金华321007)
在水热条件下,由联苯-2,4,4′,6-四甲酸(H4bptc),4,4′-联吡啶(bipy),合成了3种锌配位聚合物[Zn(bptc)0.5]n(1),[Zn2(bptc) (H2O)3]n·nH2O(2),[Zn2(bptc)(H2O)(bipy)1.5]n·nH2O(3),用元素分析、红外光谱等方法对配合物的组成进行了表征,并通过单晶X-射线衍射方法测定了配合物的晶体结构。结果表明:配合物1具有双核结构,八元环金属簇Zn2(COO)22+自组装成具有(6,6)-连接拓扑结构;配合物2具有(4,5,6)-连接拓扑结构;配合物3在辅助配体的构筑下形成三维网络结构。用溴化乙锭荧光探针法测试了配合物对EB-DNA复合体系的荧光猝灭效应,实验结果显示配合物均能使EB-DNA复合体系的荧光发生不同程度的猝灭,由此推测配合物均与DNA发生了不同程度的插入作用,引入具有刚性平面辅助配体之后的配合物3,其作用力又强于不加辅助配体的配合物1和2。
联苯-2,4,4′,6-四甲酸;锌配位聚合物;DNA作用
作为超分子化学的一个分支,配位聚合物结合了有机高分子和配位化合物两者的特点,既不同于一般的有机聚合物,也不同于S-O类的无机聚合物。配位聚合物的研究跨越了无机化学、有机化学、物理化学、配位化学、材料化学、生物化学、超分子化学、晶体工程学和拓扑化学等多个学科领域,它的研究对于发展结构化学、合成化学和材料化学的基本概念及基础理论具有重要的学术意义。同时由于其花样繁多,结构新颖,性能优异,在磁性[1-2],荧光[3-4],非线性光学[5-6],吸附[7-8]、催化[9-10]、分离[11]、主客体化学[12]、生物化学[13-14]和生物制药[15-16]等诸多领域的潜在应用,而倍受国内外化学家和材料学家的关注和重视。然而配位聚合物的结构和功能的体现主要依赖于中心金属离子和桥联配体的调控,而这一设想的体现是利用中心金属离子作为节点,有机配体作为联结体,利用中心金属离子多变的几何结构和有机配体的对称性来构筑多样结构。利用这些特点,人们可以根据自己的设计思想来合成具有各种各样的结构和功能的配位聚合物。
有机羧酸类作为配体构筑配位聚合物吸引了人们极大的研究兴趣,这主要是因为有机羧酸的丰富的配位模式和极强的与金属配位的能力。羧基的配位方式大致归结为三类,即单齿配位、螯合配位和桥连配位;羧基不仅能以多种灵活的配位方式与金属离子配位,而且还可以与金属离子组合形成多核金属离子配合物或者次级结构单元(Secondary Building Units,SBUs),从而构筑结构更加新颖、性质更加独特的配位拓扑结构;除此之外,由于羧基可以全部或者部分去质子化,它可以作为氢键的供体或者受体,协同配位键和金属键等参与超分子的自组装。
芳香羧酸由于其刚性苯环的存在,在形成配合物时,可形成π…π堆积作用。氢键和π…π堆积作用可使得配位聚合物呈现出更加丰富多彩的结构[17-18]以及独特的性质[19-20]。氢键作用和π-π相互作用为配位聚合物的结构稳定起着不可忽视的作用。
近年来,人们对于多元羧酸配合物的研究越来越多,大部分集中于多元芳香羧酸、联苯多元羧酸以及杂环多元羧酸。此类有机物配体易与金属离子形成双核或多核、具有三维网状结构配位聚合物[21-24]。本文选择四元羧酸联苯-2,4,4′,6-四甲酸(H4bptc)为配体,用水热法合成了三种锌配位聚合物[Zn(bptc)0.5]n(1),[Zn2(bptc)(H2O)3]n·nH2O(2),[Zn2(bptc)(H2O)(bipy)1.5]n·nH2O(3);用元素分析、红外光谱等方法对配合物的组成进行了表征,并通过X-射线单晶衍射的方法测定了配合物的晶体结构;用溴化乙锭荧光探针初步研究了它们与DNA作用的强度和模式。
1 实验部分
1.1 试剂与仪器
联苯-2,4,4′,6-四甲酸、无水乙醇、氢氧化钠、硫酸锌、硝酸锌、丙酮、N,N-二甲基甲酰胺等试剂均为市售分析纯试剂,小牛胸腺DNA为生化试剂,将其用0.l mol·L-1的NaCl溶液配成200 μg·mL-1(cDNA=3.72×10-4mol·L-1),经纯度测定A260/A280=1.8~2.0,置4℃保存,在4 d之内使用;Tris-HCl缓冲溶液的pH=7.40,cTris=0.01 mol·L-1。
德国Bruker公司Smart APEX II型X-射线单晶衍射仪;德国Elementar公司Vario ELⅢ型元素分析仪;美国Nicolet公司NEXUS 670型傅立叶变换红外光谱仪(FTIR),KBr压片,测定范围为400~4 000 cm-1;美国Perkin Elmer公司的LS-55型荧光光谱仪。
1.2 配合物的合成
1.2.1 [Zn(bptc)0.5]n(1)的合成
将0.2 mmol ZnSO4·7H2O(0.058 g),0.1 mmol H4bptc(0.033 g),0.4 mmol NaOH(0.016 g)和12 mL蒸馏水置于25 mL的聚四氟乙烯内衬的不锈钢反应釜中,在433 K下恒温晶化3 d后冷却至室温。过滤,得其适宜单晶测试的无色块状晶体,产率约为31%(以ZnSO4·7H2O计)。元素分析(C8H3O4Zn)实验值(%):C,41.67 H,2.29。计算值(%):C,41.69;H,2.19。IR(cm-1):1 601(m),1 585(m),1 533(s),1 455 (m),1 428(s),1 397(m),1 365(s),1 206(m),1 105(m),783(m),763(s),738(s),703(m)。
1.2.2 [Zn2(bptc)(H2O)3]n·nH2O(2)的合成
将0.2 mmol Zn(NO3)2·6H2O(0.059 g),0.1 mmol H4bptc(0.033 g),0.4 mmol NaOH(0.016 g)和12 mL蒸馏水置于25 mL的聚四氟乙烯内衬的不锈钢反应釜中,在433K下恒温晶化3 d后冷却至室温。过滤,得其适宜单晶测试的无色块状晶体,产率约为33%(以Zn(NO3)2·6H2O计)。元素分析(C16H14O12Zn2)实验值(%):C,36.15;H,1.88。计算值(%):C,36.05;H,1.89。IR(cm-1):3 378(w),1 601(m),1 528(m),1 455 (m),1 429(m),1 397(m),1 364(s),1 283(m),1 207(m),1 107(m),785(m),738(s),705(m)。
1.2.3 [Zn2(bptc)(H2O)(bipy)1.5]n·nH2O(3)的合成
将0.2 mmol Zn(NO3)2·6H2O(0.059 g),0.1 mmol H4bptc(0.033 g),0.2 mmol bipy(0.031 g),0.4 mmol NaOH(0.016 g)和12 mL蒸馏水置于25 mL的聚四氟乙烯内衬的不锈钢反应釜中,在433 K下恒温晶化3 d后冷却至室温。过滤,得其适宜单晶测试的无色块状晶体,产率约为28%(以Zn(NO3)2·6H2O计)。元素分析,实验值(%):C,51.18;H,3.05;N,5.82。计算值(%):C,50.91;H,3.03;N,5.75。IR(cm-1):3 382 (w),1 601(m),1 583(m),1 528(s),1 457(m),1 429(s),1 396(m),1 364(s),1 203(m),1 103(m),783(m),767 (s),736(s),705(m)。
1.3 配合物与DNA作用的荧光光谱
将小牛胸腺DNA(ct-DNA)用0.1 mol·L-1的NaCl溶液配成200 μg·mL-1(cDNA=3.72×10-4mol·L-1),经纯度测定A260/A280=1.8~2.0,符合实验测试要求[25],置于4℃温度下保存,在4 d之内使用;Tris-HCl缓冲溶液(5 mmol·L-1Tris-HCl/50 mmol·L-1NaCl)按常规方法配制,其中cTris-HCl=0.01 mol·L-1,pH=7.40。
在10 mL比色管中加入1.0 mL 200 μg·mL-1的DNA溶液、1.0 mL 200 μg·mL-1EB溶液以及2.0 mL pH=7.40的Tris-HCl缓冲溶液,在室温下放置2 h。然后向混合溶液中依次加入不同量的c化合物=5× 10-4mol·L-1化合物溶液,用Tris缓冲溶液定容,在4℃下反应4 h后,在美国Perkin Elmer公司的LS-55型荧光光谱仪上,激发波长λex为251 nm,扫描混合溶液在λem为520~700 nm范围的荧光发射强度。
1.4 晶体结构分析方法
选用晶体大小适宜的配合物单晶,在德国Bruker SMART APEXⅡCCD单晶衍射仪上上进行衍射实验。用辐射Mo Kα射线(λ=0.071 073 nm),在设定的2θ范围内收集衍射数据,衍射数据用程序SADABS[26]进行经验吸收校正,晶体结构用SHELXS-97[27]软件由直接法解出,精修采用SHELXL-97[28],所有非氢原子的坐标及各向异性温度因子用全矩阵最小二乘法进行修正。除水上的氢原子外,其余氢原子均为理论加氢,水上的氢原子通过差值Fourier合成得到。主要晶体学数据列于表1,主要的键长和键角列于表2,表3,表4。Symmetry codes:#1:-x+1/2,-y-1/2,-z;#2:-x+1/2,-y+1/2,-z;#3:x,-y,z-1/2;#5:x,-y,z+1/2.
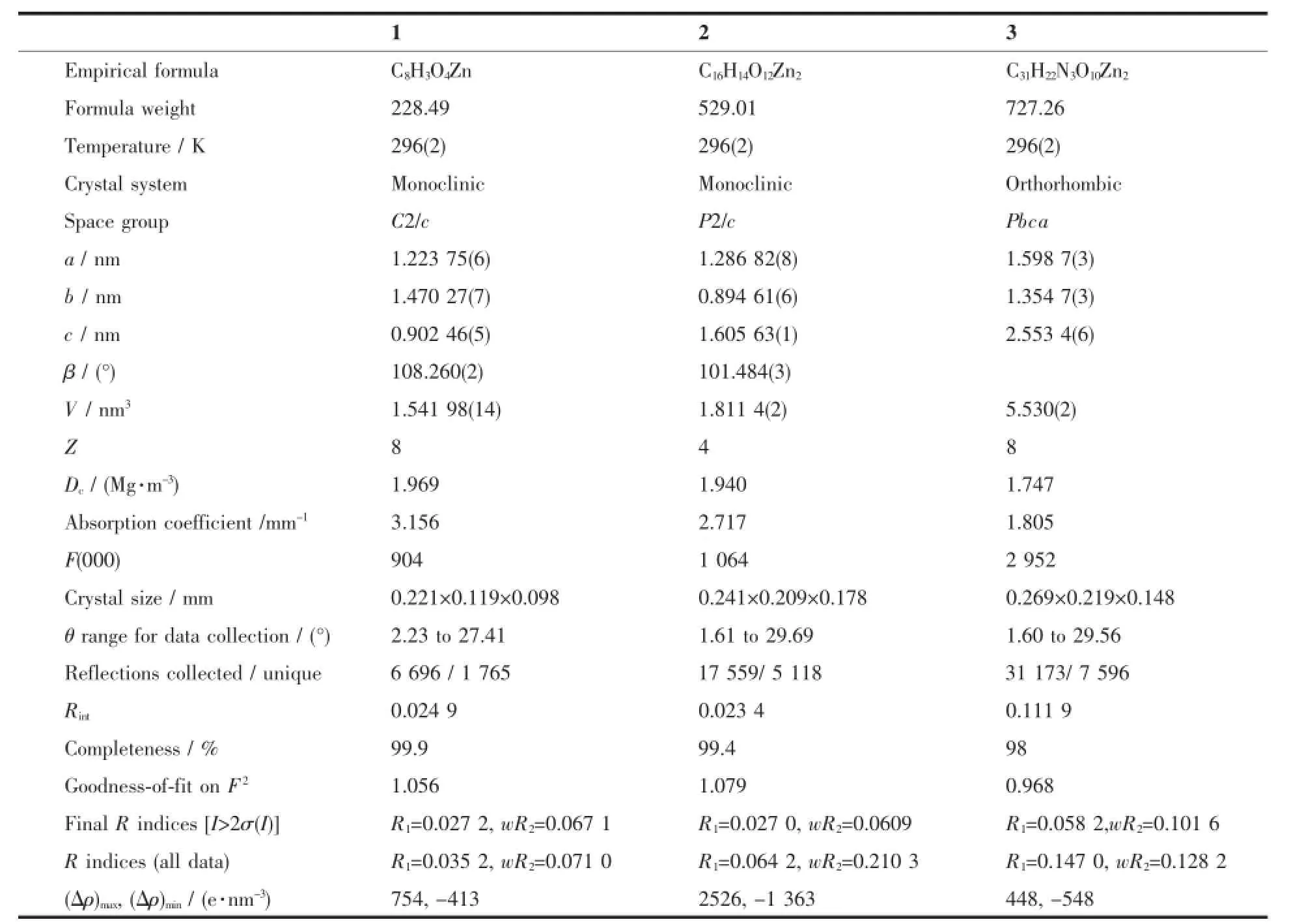
表1 配合物1~3的晶体学数据Table1 Crystallographic data for complexes 1~3
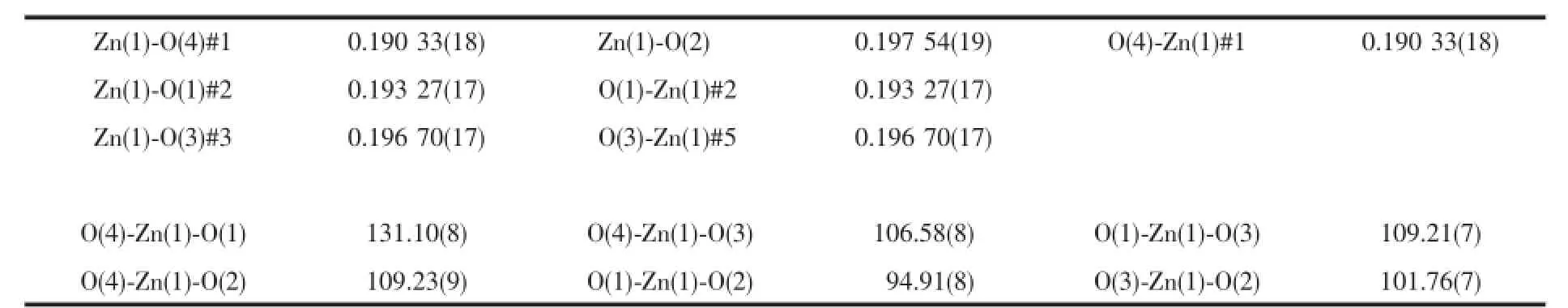
表2 配合物1的主要键长和键角Table2 Selected bond lengths(nm)and angles(°)of the complex 1
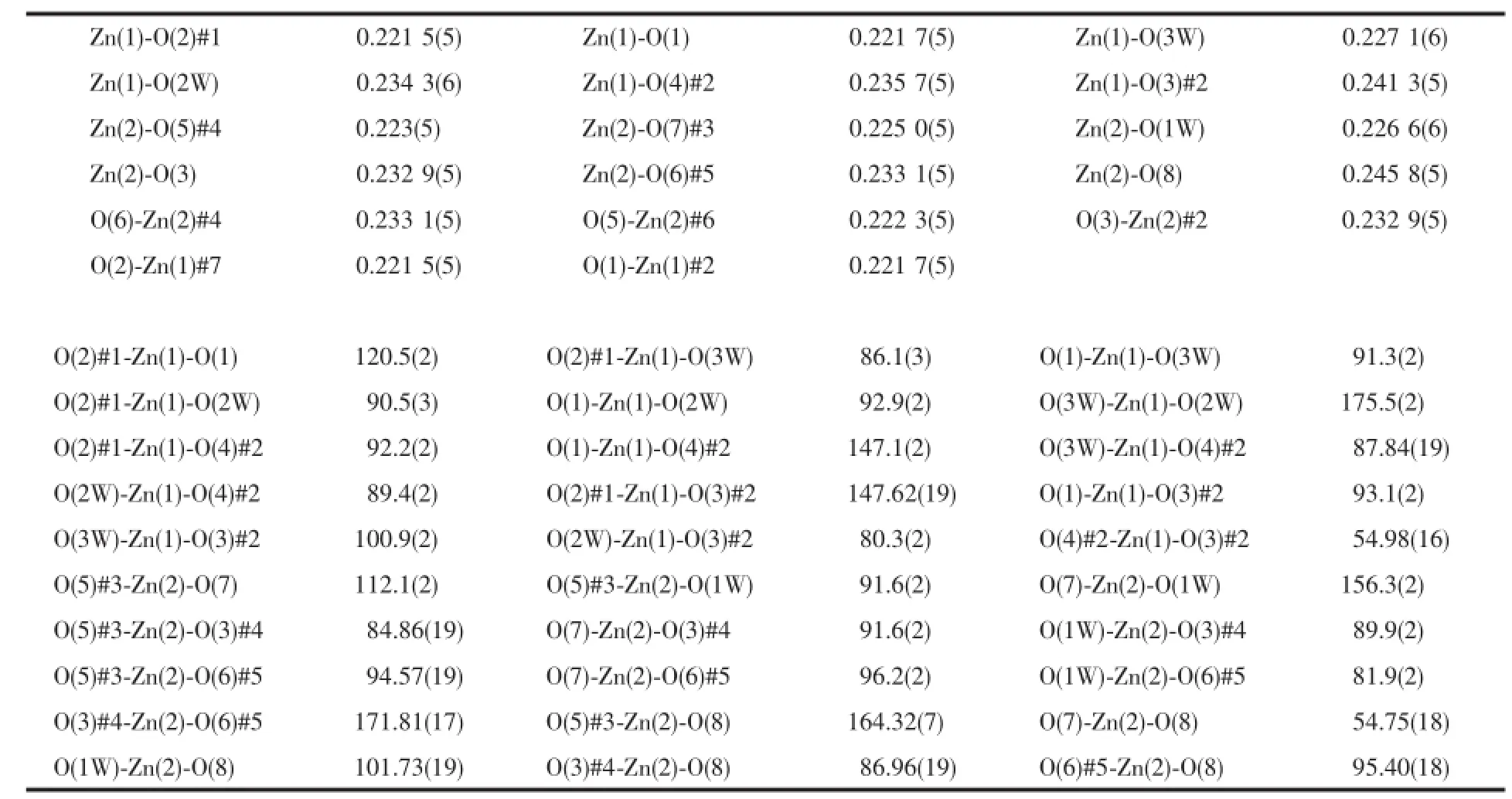
表3 配合物2的主要键长和键角Table3 Selected bond lengths(nm)and angles(°)of the complex 2
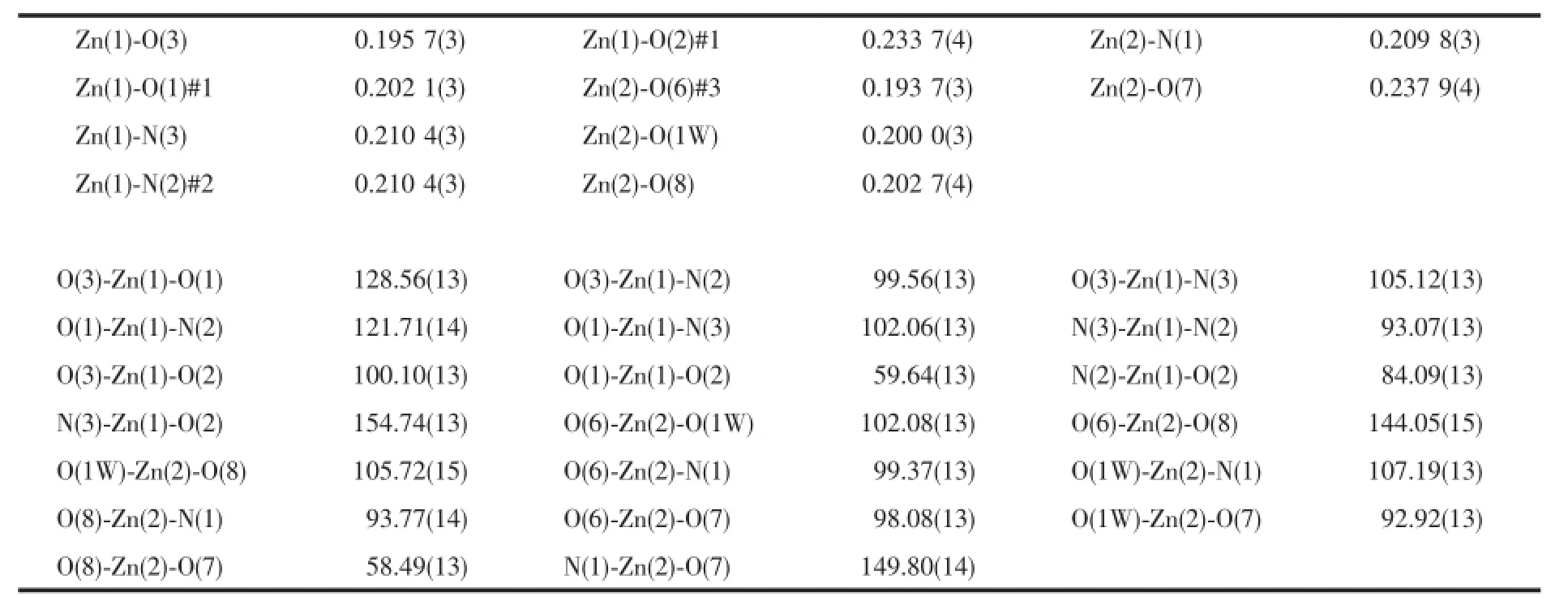
表4 配合物3的主要键长和键角Table4 Selected bond lengths(nm)and angles(°)of the complex 3
2 结果与讨论
2.1 晶体结构分析
2.1.1 [Zn(bptc)0.5]n(1)的晶体结构
单晶X-射线分析显示,配合物1具有三维网状超分子结构。在配合物1中,其最小不对称单元是由1个Zn离子,0.5个bptc4-阴离子构成(图1)。Zn金属中心分别与来自4个配体H4bptc阴离子中的羧基氧原子配位,形成略有畸变的四面体几何结构。配体H4bptc中的羧基均是去质子化的,羧基氧原子与Zn成单齿配位模式,Zn-O的键长范围为0.190 33(18)~0.197 54(19)nm,O-Zn-O键角范围在94.91(8)°~131.10(8)°之间。这与四配位的锌羧酸配合物类似[29-30]。O1,O2,O4位于赤道平面,Zn1,O3占据了轴向位置。同一配体上的2个苯环之间的扭转角度为46.896(7)°。
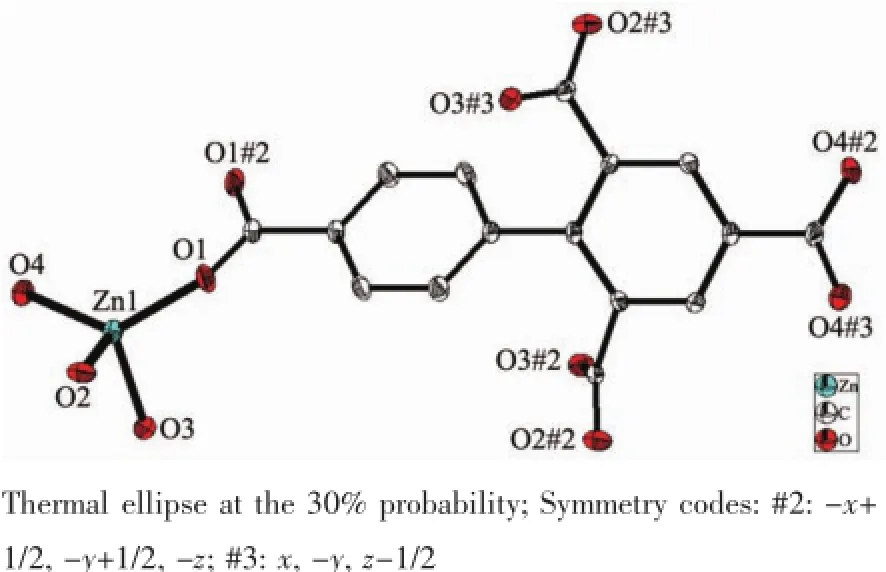
图1 配合物1的分子结构Fig.1 Molecular structure of complex 1
值得注意的是,配合物的次级结构单元(SBU)是由相互对称的2个Zn离子和2个双齿桥式羧基构筑的一个八元环Zn2(COO)22+。相邻的连续SBUs在ab面上构成了二维网状面(图2);配体的羧基氧原子又将这些二维平面串联成三维网络结构;八元环金属簇Zn2(COO)22+自组装[31]成具有(6,6)-连接拓扑结构(图3)。
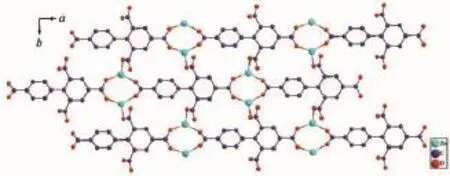
图2 配合物1的二维结构Fig.2 2D structure of complex 1
2.1.2 [Zn2(bptc)(H2O)3]n·nH2O(2)的晶体结构
单晶X-射线分析表明配合物2属于单斜晶系,空间群为P2/c。该配合物具有双核Zn结构,其最小不对称单元包含2个Zn离子,1个去质子化的配体H4bptc和4个水分子,其中3个为配位水分子,另外1个为游离水分子,结构单元如图4所示。Zn中心离子同为六配位,其中Zn1与配体H4bptc羧基上的4个氧原子和2个来自于配位水上的氧原子配位,形成一个略有畸变的八面体结构。其中4个氧原子O1#2,O3,O4,O2#2位于赤道平面上,而O3W,O2W占据轴向位置,O3W-Zn1-O2W键角为175.5(2)°。Zn2与配体上的羧基5个氧原子和1个配位水上的氧原子配位,同样形成了略有畸变的八面体结构,其中O7,O8,O1W,O5#2位于赤道平面上,O7-Zn2-O8,O1W-Zn2-O8,O1W-Zn2-O5#2,O7-Zn2 -O5#2之间的夹角之和为360.18°。配合物中Zn-O的键长范围在0.221 5(5)~0.245 8(5)nm之间,与文献中报道的六配位的Zn羧酸配合物相类似[32-33]。参与配位的同一个配体上苯环之间的扭转角为57.016(2)°,而配体H4bptc以桥式和螯合的形式参与配位。配体H4bptc以单齿和螯合的形式参与配位。配合物的次级结构单元(SBU)是由相互对称的2个Zn离子和2个双齿桥式羧基构筑的1个八元环Zn2(COO)22+。相邻的连续SBUs在ab面上构成了二维网状面(图5)。配体的羧基氧原子又将这些二维平面串联成(4,6)连接三维拓扑网络结构。
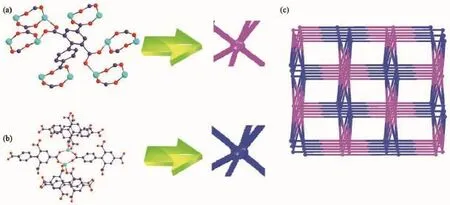
图3 配合物1的(6,6)-连接拓扑结构Fig.3 (6,6)-connected topological structure of complex 1
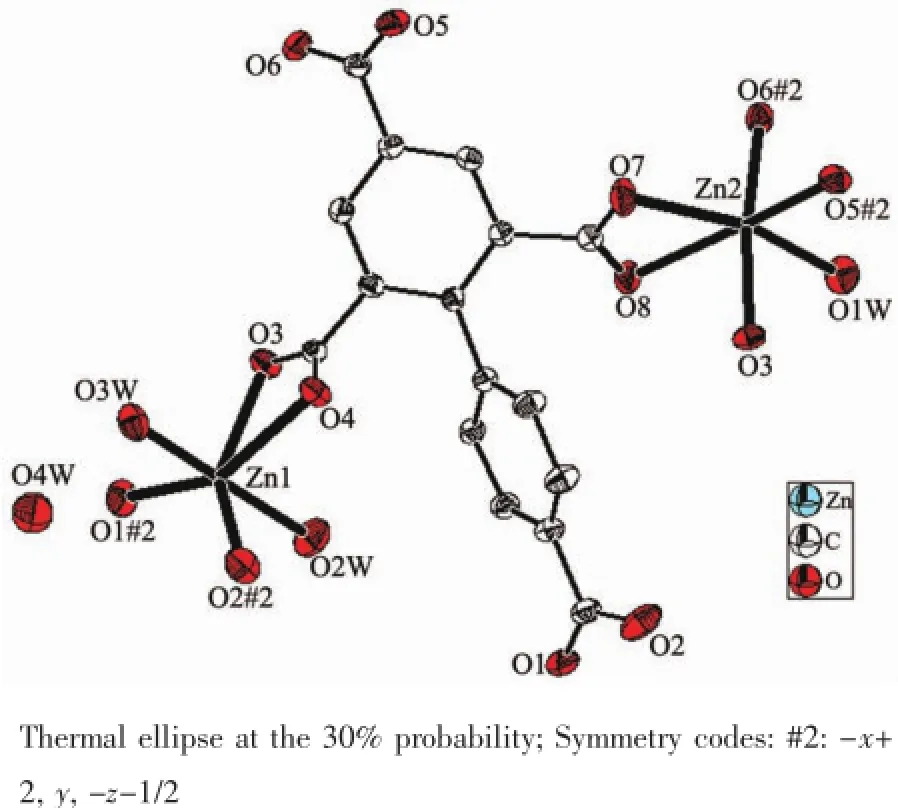
图4 配合物2的分子结构Fig.4 Molecular structure of complex 2
我们对配合物进行了拓扑分析,以双核Zn1组成的SBU周围连接有4个配体H4bptc,故该SBU可视为拓扑结构网络中的1个四连接点。而以双核Zn2组成的SBU周围连接有6个配体H4bptc,可看作六连接点。同一个配体H4bptc周围又连着5个相同的Zn2(COO)22+,同样的可看作1个五连接点,该配合物具有(4,5,6)-连接拓扑结构(图6)。
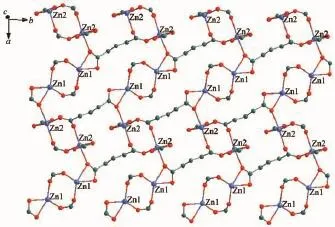
图5 配合物2的二维超分子结构Fig.5 2D super framework structure of complex 2
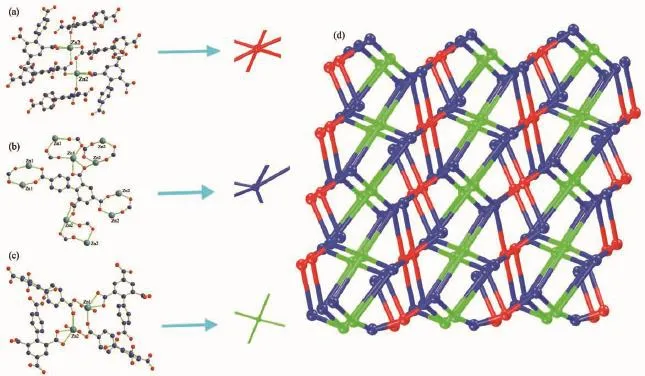
图6 (a)配合物2以双核Zn2为节点连接6个配体结构;(b)以配体为节点连有5个双核Zn单元;(c)以双核Zn1为节点连接4个配体结构;(d)配合物的(4,5,6)-连接拓扑Fig.6 (a)Linkage of{Zn22}subunits 6-connected with six bptc4-ligands;(b)bptc4-ligand regarded as an organic 5-connected node linked with five{Zn2}subunits;(c)Linkage of{Zn12}subunits 4-connected with four bptc4-ligands;(d)3D (4,5,6)-connected topological
2.1.3 [Zn2(bptc)(H2O)(bipy)1.5]n·nH2O(3)的晶体结构
单晶X-射线衍射分析表明配合物3属于正交晶系,空间群为Pbca主要键长键角列于表4。配合物3具有双核结构,其结构单元如图7所示,不对称单元中包含2个Zn离子,1个配体bptc4-离子,1.5个bipy分子,1个配位水和1个游离水分子。2个Zn离子配位环境并不相同,Zn1分别与来自配体2个bptc4-离子上的3个氧原子(Zn-O=0.195 7(3)~0.233 7(4)nm),2个bipy分子上的氮原子配位(Zn-N=0.210 4 nm),构成了1个三角双锥几何结构,键长、键角与文献报道的一致[34-35]。Zn2与分别来自配体bptc4-离子的3个氧原子,bpp分子上的1个氮原子和1个水分子上的氧原子配位,相邻的Zn1,Zn2之间的距离为0.951 2(1)nm。在配合物中,配体以单齿和螯合的配位模式与Zn离子进行配位。配体上的2个苯环之间的二面角为72.728(1)°,辅助配体bipy上2个苯环二面角有两种情况,角度分别为0°和34.053°。此外,在配体羧基和bipy的连接下,将配合物的二维面(图8a)组装成一个网状的三维结构(图8b)。
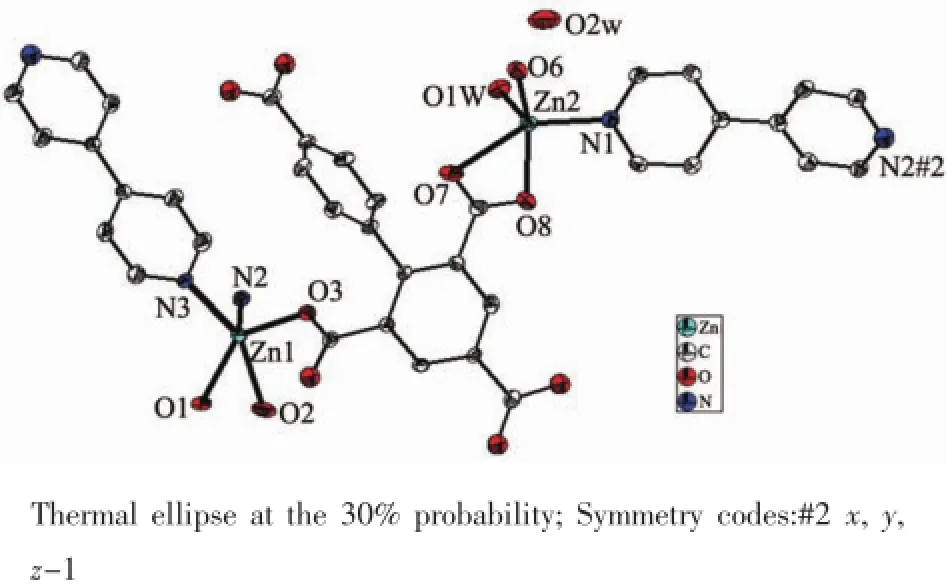
图7 配合物3的分子结构Fig.7 Molecular structure of complex 3
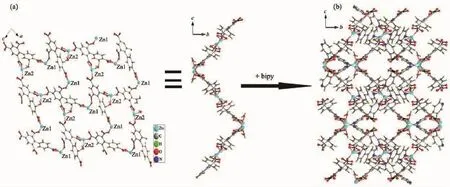
图8 (a)配合物3的二维结构图;(b)配合物3的三维结构图Fig.8 (a)2D structure of complex 3;(b)3D structure of complex 3
2.2 红外光谱分析
由配体和配合物的红外光谱图可知,游离配体的羧基特征吸收峰出现在1 698 cm-1处,当形成配合物后,此峰均消失,而随之出现了羧基的不对称伸缩振动和对称伸缩振动峰,其中的不对称伸缩振动νas(COO-)出现在1 590~1 610 cm-1处,对称伸缩振动νs(COO-)出现在1 420~1 450 cm-1,说明了羧基参与了配位。配合物2,3在3 400 cm-1到3 167 cm-1范围内均出现宽的吸收带,归属于水分子的O-H伸缩振动,而配合物3在1 450~1 550 cm-1和750~800 cm-1处的吸收峰可归属为参与配位的吡啶杂环中C=N与C-H的伸缩振动。这与单晶结构分析结果相吻合。
2.3 与DNA作用
溴化乙锭(EB)为一共轭平面分子,其本身的荧光很弱,但能专一性地插入DNA双螺旋内部的碱基对之间使荧光显著增强。如果共存于EB-DNA复合体系中的药物分子也能与DNA发生类似于EB的插入作用,这些小分子就会竞争EB与DNA的结合位点,使EB-DNA复合体系的荧光猝灭,且EBDNA复合体系荧光猝灭的程度可以说明化合物分子与DNA插入作用的强弱。
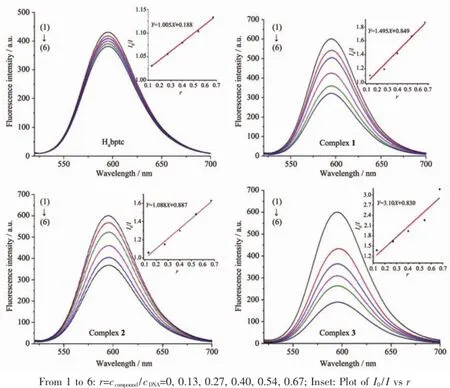
图9配合物与配体H4bptc对EB-DNA复合体系的荧光猝灭图Fig.9 Emission spectra of EB-DNA system in the absence and presence of the H4bptc ligand and complexes 1~3
图9 为不同浓度的3种配合物和配体H4bptc对EB-DNA复合体系的荧光猝灭图,从图可看出,EB-DNA复合体系在592 nm处发出强烈的荧光,随着不同浓度的配合物的加入,EB-DNA复合体系的荧光发生了不同程度的猝灭,由此可以推测配合物均与DNA发生了不同程度的插入作用.为了较为定量地研究配合物与DNA的结合能力。根据Stem-Volmer公式求得配合物对EB-DNA体系的荧光淬灭常数[36]:
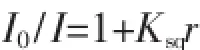
其中I0和I分别为EB-DNA复合体系和不同浓度的配合物加EB-DNA复合体系的荧光强度,r为配合物与DNA浓度之比,Ksq为线性Stem-Volmer淬灭常数(1inear Stern-Volmer quench constant)。以I0/I对r作图(图9插图),直线的斜率即为Ksq。计算得出配体和3种配合物与DNA作用的结合常数Ksq分别对应为1.005,1.495,1.694,2.257,可见配合物的插入作用明显强于配体。加入辅助配体之后的配合物3,其作用力又强于不加辅助配体的配合物1,2,其原因是辅助配体的引入,增大了配合物的刚性平面,使得配合物更有利于与DNA的结合。
3 结论
以联苯-2,4,4′,6-四甲酸为有机配体,合成了3种锌的配位聚合物。用元素分析、红外光谱等方法对配合物的组成及结构进行了表征,并通过X-射线单晶衍射的方法测定了配合物的晶体结构。配合物1具有双核结构,八元环金属簇Zn2(COO)22+自组装成具有(6,6)-连接拓扑结构;配合物2具有(4,5,6)-连接拓扑结构。配合物3在辅助配体的构筑下形成三维网络结构。值得注意的是配体在形成配合物后,两苯环的扭转角度明显发生改变,分别为46.896(7)°,56.893(6)°,72.728(1)°,可见形成的配合物结构越复杂,苯环的扭转角度就越大。根据配合物与DNA作用的结合常数大小比较,3种锌的配合物与DNA都具有较强的插入作用。
[1]Chang X H,Qin J H,Ma L F,et al.Cryst.Growth Des., 2012,12(9):4649-4657
[2]Wang H L,Zhang D P,Sun D F,et al.CrystEngComm, 2010,12:1096-1102
[3]Guo H D,Guo X M,Batten S R,et al.Cryst.Growth Des., 2009,9(3):1394-1401
[4]Zhao J,Wang X L,Shi X,et al.Inorg.Chem.,2011,50(8): 3198-3205
[5]Yu W H,Wang X Z,Sui Y X,et al.Inorg.Chem.Commun., 2008,11(7):799-801
[6]Shan X C,Zhou Y F,Zhang H B,et al.Inorg.Chem.Commun., 2012,22:149-153
[7]Choi H S,Suh M P.Angew.Chem.Int.Ed.,2009,48(37): 6865-6869
[8]Wong-Foy A G,Lebel O,Matzger A J.J.Am.Chem.Soc., 2007,129(51):15740-15741
[9]Hwang I H,Jo Y D,Kim H Y,et al.Polyhedron,2012,42 (1):282-290
[10]Li Q Y,Chen D Y,He M H,et al.J.Solid State Chem., 2012,190:196-201
[11]Semerci F,Yesilel O Z,Soylu M S,et al.Polyhedron,2013, 50(1):314-320
[12]Beckmann J,Dakternieks D,Duthie A,et al.J.Organomet. Chem.,2003,688(1-2):56-61
[13]Okamoto K,Matsumoto K,Hille R,et al.Biochemistry, 2004,101(21):7931-7936
[14]Pinto L D,Puppin P A L,Behring V M,et al.Inorg.Chim. Acta,2010,363(11):2624-2630
[15]Ma Z B,Moulton B.Coord.Chem.Rev.,2011,255(15-16): 1623-1641
[16]Efthimiadou E K,Karaliota A,Psomas G.J.Inorg.Biochem., 2010,104(4):455-466
[17]Li X H,Yang S Z,Xiao H P.Cryst.Growth Des.,2006,6 (10):2392-2397
[18]Liu Y,Qi Y,Lu Y Y,et al.Cryst.Growth Des.,2009,9(11): 4797-4801
[19]Liao S Y,Gu W,Yang L Y,et al.Cryst.Growth Des.,2012, 12(8):3927-3936
[20]Qin L,Hu J S,Zhang M D,et al.Cryst.Growth Des.,2012, 12(10):4911-4918
[21]Li B,Zang S Q,Ji C,et al.Cryst.Growth Des.,2012,12(3): 1443-1451
[22]Wang X L,Qin C,Wang E B,et al.Eur.J.Inorg.Chem., 2005(17):3418-3421
[23]Lin X,Jia J H,Zhao X B,et al.Angew.Chem.Int.Ed., 2006,45(44):7358-7364
[24]Liu T F,Lu J,Guo Z G,et al.Cryst.Growth Des.,2012,10 (4):1489-1491
[25]Marmur J A.J.Mol.Biol.,1961,3:208
[26]Scheldrick G M.SADABS,University of Göttingen,Göttingen, Germany,1996.
[27]Sheldrick G M.SHELXS 97,Program for the Solution of CrystalStructure,UniversityofGöttingen,Göttingen, Germany,1997.
[28]Sheldrick G M.SHELXS 97,Program for the Refinement of CrystalStructure,UniversityofGöttingen,Göttingen, Germany,1997.
[29]Long L S,Ren Y P,Ma L H,et al.Inorg.Chem.Commun., 2003,6(6):690-693
[30]Wang X Z,Zhu D R,Xu Y,et al.Cryst.Growth Des.,2010, 10(2):887-894
[31]Lou X H,Xu C,Li H M,et al.CrystEngComm,2013,15: 4606
[32]TAO Wu(陶武),LIU Jie-Min(刘杰民),SUN Chang-Yan(孙长艳),et al.Chinese J.Inorg.Chem.(无机化学学报),2011, 27(12):2419-2424
[33]Guo H D,Guo X M,Zhang H J,et al.Cryst.Growth Des., 2009,9(3):1394-1401
[34]Jia J,Shao M,Jia T T,et al.CrystEngComm,2010,12:1548-1561
[35]He Y H,Feng Y L,Lan Y Z,et al.Cryst Growth Des., 2008,8(10):3586-3594
[36]Lakowicz J R,Webber G.Biochemistry,1973,12(21):4161-4170
A Series of Zinc Polymer with 3D Construction:Syntheses,Structures and DNA-Binding
SHI Pei1SHEN Wei1YU Yu-Ye1,3WU Xiao-Yong1ZHAO Guo-Liang*,1,2
(1College of Chemistry and Life Science,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
(2Xingzhi College,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
(3Jinhua Polytechnic,Jinhua,Zhejiang 321004,China)
Three zinc complexes[Zn(bptc)0.5]n(1),[Zn2(bptc)(H2O)3]n·nH2O(2),[Zn2(bptc)(H2O)(bipy)1.5]n·nH2O(3), were synthesized under hydrothermal reactions by using biphenyl-2,4,4′,6-tetracarboxylic acid(H4bptc)and 4,4′-Bipyridine(bipy).They were characterized by elemental analysis,IR spectra.Crystal structures of the complexes were determined by single crystal X-ray diffraction method.Complex 1 is binuclear structure,eight ring metal clusters with(4,4)topology.Complex 2 is a(4,5,6)topology construction.Complex 3 is a 3D network structure formed by ligand and auxiliary ligand.The interaction between three complexes and DNA were studied by EtBr fluorescence probe.Add the rigid auxiliary ligand,the interaction of complex 3 to the DNA is stronger than complex 1 and 2.CCDC:952957,1;952958,2;952959,3.
biphenyl-2,4,4′,6-tetracarboxylic acid;zinc polymer;DNA-binding
O614.24+1
A
1001-4861(2015)01-0045-09
10.11862/CJIC.2015.012
2014-05-07。收修改稿日期:2014-09-09。
浙江省自然科学基金(No.LY12B01003)资助项目。
*通讯联系人。E-mail:sky53@zjnu.cn

