可控纳米银胶体的稳定性
李 鑫 魏先福 杨 力,2
(1北京印刷学院,印刷与包装工程学院,北京102600)
(2Innventia,Drottning Kristinas väg 61,11486 Stockholm(斯德哥尔摩),Sweden(瑞典))
可控纳米银胶体的稳定性
李 鑫*,1魏先福1杨 力1,2
(1北京印刷学院,印刷与包装工程学院,北京102600)
(2Innventia,Drottning Kristinas väg 61,11486 Stockholm(斯德哥尔摩),Sweden(瑞典))
纳米银胶体(AgNPs)长期储存不稳定性问题是本研究的中心,着重考察了不同前驱体对纳米银胶体的稳定性影响。分别以银氨([Ag(NH3)2]OH)溶液和AgNO3溶液为前驱体制备了多份纳米银胶体样品并通过UV-Vis、FE-SEM、EDS、ZETA电位仪等现代分析测试手段研究了纳米银胶的形貌、粒径大小以及稳定性。对比分析发现,以[Ag(NH3)2]OH溶液为前驱体,制备的纳米银胶体具有粒径可控,尺寸均一,分散性良好等特点;而且经过一个月的常温储存,表现出比用AgNO3溶液为前驱体制备的纳米银胶体具有更高的储存稳定性。
纳米银;银氨;胶体稳定性;晶体生长机理;导电墨水
0 引言
纳米银具有优良的导电性能、比表面积和表面活性高等特点,在催化材料、防静电材料、低温超导材料、电子元器件和抗菌材料等领域拥有广阔的应用前景[1]。如何合成稳定的纳米银胶体对纳米银在微电子领域的应用具有重要的意义。纳米银的导电性能与其结构、形貌、粒径、粒径分布以及稳定性等有着密切的联系。采用不同的合成技术和反应条件可以实现调控纳米银粒径的大小和形貌的目的[2-4]。
已经报道的制备纳米银胶体的方法有很多[5],比如,廖学红等报道了在配位剂EDTA存在下,以AgNO3溶液为前驱体,采用超声电化学方法成功制备了两种不同粒径的类球形和树枝状的纳米银[6];Lu等探索了AgNO3溶液在超枝化聚氨酯辅助下,利用光化学还原法制取纳米银晶体的方法[7];Gorup等用[Ag(NH3)2]OH为前驱体,采用液相还原法,制备出粒径在1.6 nm左右的稳定性、分散性良好的纳米银颗粒[8];Yin等用[Ag(NH3)2]OH采用无电沉积的方法制备了粒径在20~50 nm、可以稳定均一的分散在水溶液中的纳米银胶体[9]。据文献报道,以AgNO3为前驱体制备的纳米银胶体,因为具有高表面能导致团聚和在静置过程中沉降等弱点,限制了其应用[10-12]。基于上述报道,本文在合成条件相同的情况下,对以AgNO3溶液和[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体进行稳定性对比。本项工作通过实验和理论相结合分析了以AgNO3溶液为前驱体制备的纳米银胶体在溶液状态下团聚的原因;并发现以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体的粒径可以通过调节其浓度加以控制。
1 实验
1.1 材料和设备
硝酸银(分析纯),NaOH(分析纯),葡萄糖(分析纯),聚乙烯吡咯烷酮(PVP)(分析纯)。上述材料均由北京化学试剂有限公司提供。
紫外/可见光分光光度计(UV-2501PC,日本),采用热辐射光源和气体放电光源在“光谱模式”下测量;场发射透射电子显微镜(FE-TEM,配有EDS能谱仪,TEcnai G2 F20,美国),在电压100 kV、高度真空、束流密度105A·cm-2下测量;ZETA电位仪(Zetasizer Nano S,英国),采用532 nm绿色激光器在常温下测量;XRD(X′ProMPD,荷兰),扫描速度8°· min-1下测量。
1.2 纳米银的制备
(1)制备[Ag(NH3)2]OH溶液:将一定量的硝酸银粉末(AgNO3)溶于蒸馏水中,逐渐滴加适量的NaOH,产生黑色沉淀。随后,快速逐滴加入稀氨水至不溶物完全溶解。制备出Ag+浓度分别为200、50、25、10、5 mmol·L-1的[Ag(NH3)2]OH溶液;
(2)制备AgNO3溶液:将一定量的硝酸银粉末溶于蒸馏水中,配制成Ag+浓度分别为200、50、25、10、5 mmol·L-1的AgNO3溶液;
(3)在上述溶液中,分别加入过量的葡萄糖(Ag+浓度的10倍)以及适量PVP(Ag+浓度的2倍),在油浴温度90℃的条件下反应15 min(转子速度120 r· min-1),制备出纳米银胶体。
2 结果讨论
2.1 X射线衍射(XRD)分析
分别将浓度为200 mmol·L-1的[Ag(NH3)2]OH溶液和AgNO3溶液制备的纳米银胶体静置4周后把样品置于离心机在6 000 r·min-1离心,用乙醇洗涤数次,得到纯净的纳米银粉末。利用XRD对固体粉末表征,实验结果如图1、图2所示。
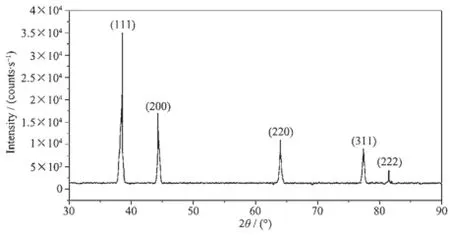
图1 以[Ag(NH3)2]OH为前驱体(浓度为200 mmol·L-1)制备的纳米银XRD图Fig.1 XRD pattern of AgNPs prepared from[Ag(NH3)2]OH (200 mmol·L-1)
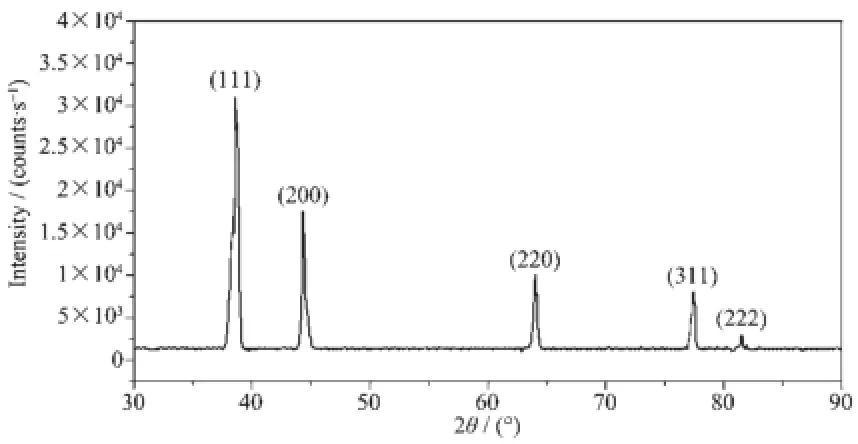
图2以AgNO3为前驱体(浓度为200 mmol·L-1)制备的纳米银XRD图Fig.2 XRD pattern of AgNPs prepared from AgNO3(200 mmol·L-1)
图1 、图2展示了2种前驱体制备的纳米银的X射线衍射图,样品的特征衍射峰的二倍衍射角2θ值依次为38.120°、44.241°、64.505°、77.421°、81.536°。它们分别对应于标准晶态银卡片JCPDS (04-0783)上的(111)、(200)、(220)、(311)(222)面,说明两种产品均为面心立方晶系单质Ag[13]。与图2中的衍射峰结构相比,图1衍射峰曲线结构更加清晰,无杂峰,衍射峰峰形尖且对称。说明用[Ag(NH3)2]OH制备的纳米银比用AgNO3制备的纳米银具有更好的结晶性能。
2.2 稳定性分析
为了测试2种前驱体制备的纳米银胶体在长期储存中的稳定性,在实验室条件下,连续4周进行样品分析。在每周同一段时间取等量的上层样品,利用紫外-可见分光光度仪,测量样品对紫外-可见光的吸收率。结果反映了纳米银胶体的稳定性,图3每行从左至右Ag+浓度分别为200、25、5 mmol·L-1的实验测量结果。3A、3B、3C展示的3组数据为以AgNO3溶液为前驱体制备的纳米银胶体紫外吸收曲线;3D、3E、3F展示的3组数据为以[Ag (NH3)2]OH溶液为前驱体制备的纳米银胶体紫外吸收曲线。(其余浓度的紫外吸收曲线见支撑材料1)。
图3的A、B、C中,以AgNO3溶液为前驱体制备出的纳米银胶体,室温下静置4周,不同浓度下制备的纳米银样品的最大吸收峰均出现下降,聚集特征明显,说明在样品在静置过程中纳米银胶体出现了沉降,导致溶液中的纳米银浓度降低;而以[Ag(NH3)2]OH溶液为前驱体制备出的纳米银胶体(图3的D、E、F),不同样品静置4周,最大吸收峰均无明显变化,说明这种纳米银胶体在长期静置中表现出极高的稳定性。另外,对比发现,随着前驱体的浓度变小,从左至右,由2种前驱体制备的纳米银最大吸收峰均出现蓝移现象。以AgNO3溶液为前驱体制备出的纳米银胶体从455 nm移到了392 nm;以[Ag(NH3)2]OH溶液为前驱体制备的纳米银的最大吸收峰从429 nm移到了395 nm。这说明不同浓度的前驱体制备出的纳米银胶体的粒径也不相同[14-18],即随着前驱体的浓度下降,纳米银胶体的粒径减小。此外,我们注意到,以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体最大吸收峰的峰宽明显地比AgNO3溶液制备出的纳米银胶体要窄。因此以[Ag(NH3)2]OH溶液为前驱体有助于提高纳米银胶体的单分散性[19-20]。
另外,我们检测了2种纳米银胶体在特殊环境下的稳定性。先将相同体积的纳米银胶体稀释到原来的2倍体积,再通过加热(100℃)蒸发的方法还原到初始体积。分别对稀释之后和加热还原之后的样品用紫外可见光分光光度计进行测试。Ag+浓度分别为200、25、5 mmol·L-1的紫外吸收曲线如图4所示,4A、4B、4C为AgNO3溶液为前驱体的紫外吸收曲线;4D、4E、4F为[Ag(NH3)2]OH溶液为前驱体的紫外吸收曲线。(其余浓度的紫外吸收曲线见支撑材料2)。
由图4可知,在稀释和加热还原之后,以AgNO3为前驱体制备的纳米银胶体最大吸收峰出现了下降以及红移,表明这种纳米银胶体在加热的过程中出现了团聚的现象;相反,以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体在加热还原后其紫外吸收峰基本无明显的变化,表明以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体在加热的条件下表现出极高的稳定性。由上述紫外吸收曲线对两种纳米银胶体的分析可知,相对于AgNO3为前驱体制备的纳米银胶体,以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体表现出更高的稳定性。因此,本论文中将深入地讨论以[Ag(NH3)2]OH溶液为前驱体制备的纳米银胶体更稳定的原因。

图3 每行从左至右,Ag+浓度分别为200、25、5 mmol·L-1制备的纳米银胶体连续静置1~4周后的紫外-可见光吸收曲线Fig.3 UV spectra of AgNPs hydrocolloid prepared by 2 precursors with 200,25,5 mmol·L-1in 4 consecutive week′s storage
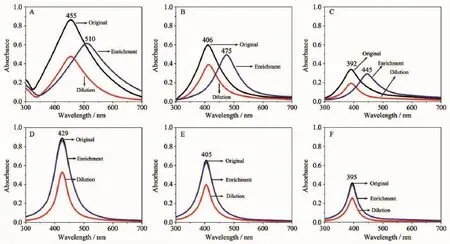
图4 2种前驱体Ag+浓度分别为200、25、5 mmol·L-1制备的纳米银胶体稀释之后和加热还原之后的紫外吸收曲线Fig.4 UV spectra of AgNPs hydrocolloid prepared by 2 different precursors with 200,25,5 mmol·L-1
在相同的实验条件下,用[Ag(NH3)2]OH溶液作为前驱体制备出的纳米银胶体比AgNO3溶液制备出的纳米银胶体有更好的稳定性及分散性。为了从理论的层面解释这种现象,我们做了一个基于晶体成核现象和晶体生长机理的纳米银粒子构成过程的理论分析。根据经典的成核理论[21],成核过程的驱动力是由于单体浓度变化而引起的吉布斯函数自由能变化(ΔG)。它等于相变的吉布斯函数自由能变化(ΔGv)和构成固体表面所需的吉布斯函数自由能变化(ΔGs)的总和:
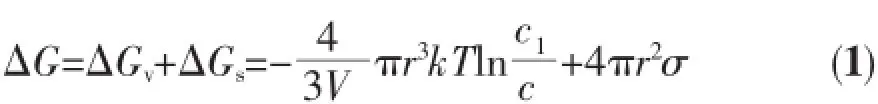
其中,c是饱和度;c1是过饱和度;T是绝对温度;k是玻耳兹曼常数;r是晶核的半径;V是析出银单质单一分子的体积;σ是单位表面积自由能。公式中第一项是体自由能的减小,第二项为新相形成伴随的表面自由能的增加。体自由能的减少有利于新相的形成,但表面能的存在不利于晶相的转变。因此,结晶分子只有通过克服形成临界尺寸晶核所需的势垒,才能实现晶体的成核,进一步生长。在此过程中,随着晶核半径增长ΔGv成立方次减小而ΔGs成平方次增加。因此晶体的成核依赖于ΔGv和ΔGs的竞争。如图5所示为体系自由能与晶核半径的关系,当r<r*(临界半径)时,ΔGs在ΔG中占主导地位,随着r的增加ΔG值增加。ΔG值增加会导致小晶核的溶解。只有当ΔGv占主导地位时,ΔG才出现下降。结晶驱动力也就较大,晶核容易形成并增长。
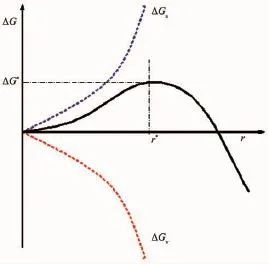
图5 体系自由能与晶核半径的关系Fig.5 Relationship between the system free energy and the nucleus radius
当单体浓度c达到临界值时,晶核半径r就会增大到一个临界形核半径r*。当r=r*,ΔG达到其最大值ΔG*,由

可以得到临界形核半径r*和最大值ΔG*的表达式,

当r>r*时,ΔG随r增加而降低,晶核尺寸呈现稳定的趋势。ΔG值越低成核增长越容易。一旦进入过饱和状态,过饱和程度越高(即越大),则|ΔGv|也就越大,结晶驱动力也就越大。相应地r*也越小。因此,r就会迅速超过r*,ΔG值出现下降。系统就具有结晶成核并增长的条件。在实验过程中,过量的还原剂葡萄糖将Ag+持续的转变为Ag0,直至Ag+被完全消耗。单体浓度的增加会使水溶液饱和,从而析出物质,Ag0凝结成晶核。
基于上述的自由能讨论结果,我们知道银呈现出一种自发的生长趋势。如果Ag0可持续供应,Ag0凝结晶核将持续成长。否则,该系统将进入奥斯特瓦尔德熟化过程[22],即较小的结晶核逐渐溶解并释放单体。因为体系的动力学特征利于较大的晶体核继续增长,释放出的单体Ag0将并入较大的晶体核。以上所说的2种过程都会导致纳米银粒子的无限增殖,从而引起纳米银胶体的团聚。因此需要用表面活性剂通过表面自由能调整机制来平衡总的自由能,并防止银纳米粒子过度生长。本实验中,PVP作为表面活性剂,其分子中的每一个杂五环中的N原子和相邻羰基可以和Ag配位形成四元环,使晶核的表面能趋于各向同性;此外,PVP分子中乙烯长链可以和Ag形成含2个氮原子的六元环(如图6)。PVP分子在Ag表面上形成类似螯合物的厚的吸附保护层,吸附有表面保护剂分子的银晶核由于位阻效应,也可抑制晶核间相互碰撞聚集长大,从而得到球型或类球型的纳米银颗粒[23-24]。

图6 Ag被PVP分子包覆的分子结构示意图Fig.6 Structure of the Ag coated by PVP molecules
合成高稳定性纳米银胶体的关键是Ag0能够成核生长并被保护剂迅速包覆,保护剂可以抑制银颗粒体积的进一步增长、聚集趋势。从而形成稳定的纳米银胶体。在以AgNO3为前驱体制备纳米银的过程中,AgNO3在溶液状态下完全电离Ag+,并迅速被还原为Ag0,在过饱和溶液中,凝结成晶核,由于过饱和程度很大,核增长驱动力较强,形核速率和核增长速率都较强,以至于晶核很快达到临界晶核半径r*,同时ΔG迅速达到一个较低的值,导致r值较大,以致早期形成的晶核迅速生长成体积更大的晶体,不利于PVP分子迅速的包覆。通过这种方式产生出来的纳米银粒子可能会表现为具有不稳定的自由能ΔG,导致晶核缺陷,进而影响晶体的固态形貌和尺寸。随后的过程中,它们很容易吸收较小纳米银颗粒,直到胶状的纳米银出现团聚现象。与AgNO3相比,[Ag(NH3)2]OH前驱体在水溶液中以[Ag(NH3)2]+的形式存在,其在水溶液中存在电离平衡,公式如下:

随着Ag+的逐渐被消耗,电离平衡向右移动,从而顺利释放出Ag+,溶液的过饱和程度不是很大,这时晶核的增长较为稳定,纳米银粒子会表现为具有比较稳定的自由能ΔG,因而[Ag(NH3)2]OH前驱体表现出了在单体供应过程中的缓冲效果,Ag+逐渐释放出来,保证了一定的成核驱动力,晶核可以很好的被保护剂所包覆以产生稳定且分散性良好的银纳米粒子。
2.3 纳米银胶体的EDS能谱分析
为了进一步确认[Ag(NH3)2]OH为前驱体制备的纳米银胶体中是否被PVP包覆,将[Ag(NH3)2]OH浓度为200 mmol·L-1制备的纳米银胶体样品放在铜网上进行EDS分析,结果表明:样品中主要元素成分为Ag、C、O、N元素,如图7所示,说明纳米银胶体中包含一定量的PVP分子。
2.4 纳米银胶体的形貌分析

图7 [Ag(NH3)2]OH浓度为200 mmol·L-1制备的纳米银EDS点分析能谱图Fig.7 Energy spectrum diagram of EDS analysis for AgNPs hydrocolloid from[Ag(NH3)2]OH precursor(200 mmol·L-1)
为了证明以[Ag(NH3)2]OH为前驱体制备的纳米银胶体被PVP完美包覆,对[Ag(NH3)2]OH浓度为200、50、25、10、5 mmol·L-1制备出的样品静置4周后用TEM分析,结果如图8中A、B、C、D、E所示。
TEM结果表明:5种不同Ag+浓度制备的纳米银胶体被PVP完美包覆且分布均匀,尺寸均一,纳米颗粒排列有序。随着[Ag(NH3)2]OH浓度的减少,纳米银颗粒的大小也随之减少。说明纳米银胶体的大小可以通过控制[Ag(NH3)2]OH浓度而实现。对于上述实验现象,依然可以利用银晶体的成核与生长机理进行解释。通常情况,银晶体的形成包括成核和晶体生长两个过程。在成核过程中,需要一定的过饱和度克服表面能位垒;晶核的生长过程主要是在前期成核的基础之上,新还原出来的银单质吸附在原有晶核的表面而生长的过程。这两个过程都将发生液相还原反应,但前期以成核为主,后期则以核生长为主。在成核过程中,Ag0浓度超过临界浓度值,体系达到过饱和状态,Ag0能够从反应体系中析出。在Ag+浓度较低时,Ag0浓度过饱和程度相对较低。晶体的形成以成核为主,相对而言生成的银晶核增多,不利于晶体生长。此过程成核大于晶体生长,生成的纳米银粒径较小。随着Ag+浓度进一步增加,过饱和度不断增大,维持在较高的水平,使得银颗粒的结晶速度大于成核速率,生成的纳米银颗粒的粒径较大。此实验中,Ag(NH3)2]OH将逐步的释放Ag+,进而被葡萄糖还原,先期还原的Ag0将形成晶核,后期的Ag0在晶核表面生长,形成粒径较大的纳米银胶体。高浓度的前驱体有助于形成大粒径的纳米银颗粒,低浓度的前驱体则形成的纳米银颗粒较小。通过这种方法,控制前驱体的浓度,达到调控粒径的最终目的。
2.5 ZETA电位仪粒径分析以及粒径控制
用ZETA电位仪对[Ag(NH3)2]OH前驱体制备的纳米银胶体的粒径进行测试,不同浓度下以[Ag(NH3)2]OH为前驱体制备纳米银胶体的粒径分布以及平均粒径如图9、表1所示。
观察发现,随着前驱体浓度变稀(200 mmol·L-1→5 mmol·L-1),制备的纳米银胶体的粒径呈现减少的趋势,平均粒径由45.5 nm下降到15.6 nm。在前驱体浓度为200 mmol·L-1时,粒径主要分布在40~50 nm(占72%);在前驱体浓度为50 mmol·L-1时,粒径主要分布在25~35 nm(占75%);在前驱体浓度为25 mmol·L-1时,粒径主要分布在20~30 nm(占77%);在前驱体浓度为10 mmol·L-1时,粒径主要分布在15~25 nm(占86%);当前驱体浓度为5 mmol· L-1时,纳米银的粒径分布在10~20 nm(占86%)。
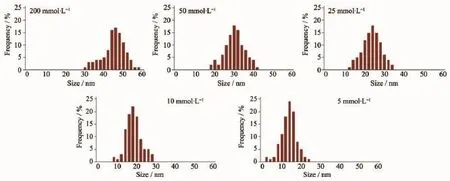
图9 [Ag(NH3)2]OH为前驱体制备的纳米银胶体粒径分布Fig.9 Particle size distribution of the AgNPs hydrocolloid from[Ag(NH3)2]OH precursor

表1 [Ag(NH3)2]OH为前驱体制备的纳米银胶体平均粒径Table1 Particle size distribution and average particle size of the AgNPs hydrocolloid from [Ag(NH3)2]OH precursor
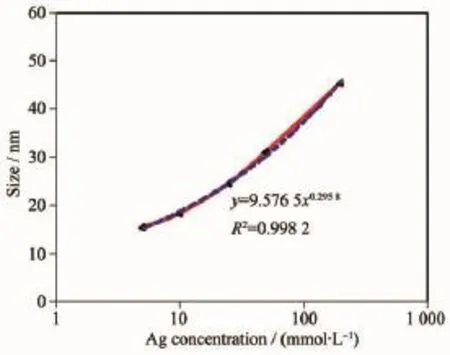
图10 [Ag(NH3)2]OH浓度与纳米银胶体平均粒径的关系曲线Fig.1 0Curve of the relationship between the average particle size of AgNPs hydrocolloid and the concentration of[Ag(NH3)2]OH
根据前驱体中Ag+浓度与纳米银胶体平均粒径数关系进行拟合。如图10所示,以[Ag(NH3)2]OH的浓度为x轴,纳米银胶体的平均粒径为y轴,获得拟合曲线方程为y=9.576 5x0.2958(R2=0.998 2)的曲线。数据分析表明:制备的纳米银胶体的粒径与前驱体[Ag(NH3)2]OH的浓度密切相关,保持实验条件不变,可以通过控制[Ag(NH3)2]OH浓度来实现调控纳米银粒径的大小。
3 结论
本文对比了以AgNO3/[Ag(NH3)2]OH为前驱体制备的纳米银胶体的稳定性。X-射线衍射(XRD)和UV-Vis吸收率分析结果表明:以银氨溶液为前驱体合成出的纳米银胶体具有更高稳定性。用EDS和TEM分析手段进一步证实以银氨溶液为前驱体合成出的纳米银胶体具有更高稳定性和更好的分散性。并从晶体生长原理和吉布斯自由能变化出发分析了纳米银团聚的原因和发生条件。实验分析结果表明,通过控制前驱体银氨溶液的浓度可以有效地调控纳米银的粒径;并通过数据拟合得到纳米银胶体粒径和银氨溶液浓度之间的定量关系。
[1]YANG Yu-Wang(杨玉旺),LIU Jing-Li(刘敬利).Ind.Catal. (工业催化),2003,11(12):7-11
[2]Tan Y W,Li Y F,Zhu D B.J.Colloid Interface Sci.,2003, 258:244-251
[3]Ishizu K J,Furukawa T,Yamada H.Eur.Polym.J.,2005,41: 2853-2860
[4]Luo C,Zhang Y H,Zeng X W.J.Colloid Interface Sci.,2005,288:444-448
[5]Zhang Q,Liu S,Yu S.J.Mater.Chem.,2009,19(2):191-207
[6]LIAO Xue-Hong(廖学红),ZHU Jun-Jie(朱俊杰),QIU Xiao-Feng(邱晓峰).J.Nanjing University(南京大学学报),2002, 38(l):119-123
[7]Lu H W,Liu S H,Qian X L.Mater.Chem.Phys.,2003,81: 104-107
[8]Luiz F G,Elson L,Edson R L,et al.J.Colloid Interface Sci., 2011,04:355-358
[9]Yin Y D,Li Z Y,Zhong Z Y,et al.J.Mater.Chem.,2002, 12:522-527
[10]Li S,Zhang Y,Xu X,et al.Biomacromolecules,2011,12(8): 2864-2871
[11]Bankura K P,Maity D,Mollick M,et al.Carbohydr.Polym., 2012,89(4):1159-1165
[12]Janardhanan R,Karuppaiah M,Hebalkar N,et al.Polyhedron, 2009,28(12):2522-2530
[13]ZHU Wan-Bo(朱万博).Thesis for the Master of Northeastern University(东北大学硕士论文).2008.
[14]Lun L,Jie S,Xiao R L,et al.Biomaterials,2012,33:1714-1721
[15]CHENDa-Peng(陈大鹏).ThesisfortheDoctorateofHuazhong University of Science and Technology(华中科技大学博士论文).2010.
[16]Vijayaraghavan K,Nalini S P K,Prakash N U,et al.Colloids Surf.,2012,94:114-117
[17]Mathew T V,Kuriakose S.Colloids Surf.,2012,101:14-18
[18]Gautam S,Dubey P,Cupta M N.Colloids Surf.,2013,102: 879-883
[19]Asmathunisha N,Kathiresan K.Colloids Surf.,2013,103: 283-287
[20]Singh S,Saikia J P,Buragohain A K.Colloids Surf.,2013, 102:83-85
[21]LaMer V K,Dinegar R H.J.Am.Chem.Soc.,1950,72(11): 4847-4854
[22]Zaheer Z,Rafiuddin.Colloids Surf.,2012,90:48-52
[23]ZHU Ji-Chun(朱纪春),ZHANG Xin-An(张新安),BAI Ying (白莹).J.Henan University(河南大学学报),2004,34(2):20-23
[24]ZHU Ji-Chun(朱纪春).Thesis for the Doctorate of Henan University(河南大学博士论文).2005.
On the Long-Term Stability of Silver Nanoparticle Hydrocolloid
LI Xin*,1WEI Xian-Fu1YANG Li1,2
(1Beijing Institute of Graphic Communication,School of Printing and Packaging,Beijing 102600,China)
(2Innventia,Drottning Kristinas väg 61,11486 Stockholm,Sweden)
This paper focuses on the long-term storage(in-shelf)stability issues of controllable silver nanoparticle hydrocolloids(AgNPs).Two controllable AgNPs were prepared from two different precursors:silver nitrate (AgNO3)and silver diamminohydroxide([Ag(NH3)2]OH).The important characteristics of the AgNPs were measured by means of UV-Vis,SEM,EDS,ZETA electric potential techniques as well as mathematical simulations.The comparative studies show that the AgNPs obtained from the[Ag(NH3)2]OH precursor exhibited superior controllability in particle size,size-distribution and dispensability in one month storage,compared to those obtained from AgNO3.
silver nanoparticle(AgNPs);silver ammonia;hydrocolloid stability;crystal growth mechanism;conductive ink
O614.122
A
1001-4861(2015)01-0037-08
10.11862/CJIC.2015.013
2014-06-04。收修改稿日期:2014-09-20。
国家自然科学基金面上项目(No.61474144)资助。
*通讯联系人。E-mail:lixinxioanei@126.com

