水曲柳SOC1基因表达载体的构建及生物信息学分析
付德山朱 珠崔丽婷詹亚光,2齐凤慧
(1.东北林业大学生命科学学院,黑龙江哈尔滨150040;
2.林木遗传育种国家重点实验室(东北林业大学),黑龙江哈尔滨150040)
水曲柳SOC1基因表达载体的构建及生物信息学分析
付德山1朱 珠1崔丽婷1詹亚光1,2齐凤慧1
(1.东北林业大学生命科学学院,黑龙江哈尔滨150040;
2.林木遗传育种国家重点实验室(东北林业大学),黑龙江哈尔滨150040)
为研究SOC1开花调控关键节点基因在水曲柳花时调控中的作用,从水曲柳中克隆获得了SOC1的编码区全长,序列分析表明:SOC1基因长654 bp,编码218个氨基酸,与金鱼草MADS-box转录因子DEFH68基因序列相似性最高,核苷酸相似性为78%;水曲柳SOC1具有MADS-box结构域和K-结构域,同时具有DNA结合位点和磷酸化作用位点,属于MADS家族转录因子。同时利用双酶切法成功构建了水曲柳SOC1基因植物表达载体pROKⅡ-35S∶∶SOC1。
水曲柳;SOC1;生物信息学;表达载体构建
SOC1(suppressor of overexpression of constans 1)基因属于MADS-box转录因子家族,广泛存在于单子叶和双子叶植物中[1-3],其编码蛋白属于典型的MIKC型蛋白,包括MADS(M-),Intervening(I-),Keratin-like(K-)和C-terminal(C-)4个蛋白结构域,是植物开花途径中的整合子基因之一,和成花诱导关系密切,植物成花途径中的光周期途径、春化途径、自主途径、赤霉素途径均能激活SOC1基因,最终导致花原基的形成[4]。目前在多种植物中都已鉴定出了属于该支系的MADS-box基因并克隆得到了其同源基因,其中包括拟南芥(Arabidopsis thaliana)[5]、水稻(Oryza sativa)[6]、玉米(Zea mays)[7]、小麦(Triticum aestivum)[8]、大豆(Glycinemax)[9]、白桦(Betula platyphylla)[10]、烟草(Nicotiana tabacum)[11]、甘菊(Dendranthema lavandulifolium)[12]等,但它们在植物中表现出不同的功能。SOC1基因通过与其他开花调控基因相互作用,整合开花调控路径中的信号,调节开花时间、花类型和花分生组织形成[13]。
水曲柳(Fraxinusmandshurica)以其材质优良而著称,是珍贵的用材树种。由于采伐历史较早,水曲柳的分布范围和数量明显减少,目前大树已不多见,属于国家渐危三级保护树种。水曲柳3~5 a才会开花结实1~2次,花期较短,且种子种皮坚韧、腊质层厚、含油量高和休眠期较长,因此,这给育苗生产带来一定困难。目前对水曲柳的研究主要集中在立地造林、病理木材科学等方面,对开花调控相关基因的研究还没有报道。因此,为了探究SOC1基因在水曲柳中的功能,从水曲柳花中克隆得到SOC1基因编码区全长,并将其构建到植物表达载体pROKⅡ-35S∶∶SOC1中,为后续遗传转化及SOC1基因在水曲柳中的功能研究奠定基础。
1 材料与方法
1.1 研究材料
1.1.1 植物材料 本研究取材于东北林业大学试验林场中的水曲柳,取水曲柳雌雄花序,液氮速冻后使用。1.1.2 试剂与载体 本研究使用的植物表达载体pROKⅡ由东北林业大学森林生物工程实验室提供;反转录酶、DNA聚合酶及RNA提取试剂盒购自TaKaRa公司;DNA琼脂糖凝胶电泳回收试剂盒购自OMEGA公司和TaKaRa公司;限制性内切酶购自Thermo公司;T4DNA连接酶购自Promega公司;pEASYTM-T1克隆载体及质粒提取试剂盒购自北京全式金生物技术公司;引物合成和DNA测序由生工生物工程股份有限公司、华大基因科技股份有限公司和金唯智生物科技有限公司完成。
1.2 试验方法
1.2.1 水曲柳SOC1基因编码区全长的克隆及pEASYTM-T1载体的构建 提取水曲柳雌雄花序总RNA,利用TaKaRa RNA PCR试剂盒进行反转录和PCR扩增,根据水曲柳转录组SOC1编码区全长和pROKⅡ载体上的酶切位点设计特异性引物,上游引物为SOC1-F∶5′-GC TCTAGAATGGTGAGAGGAAAAAC-3′(划线部分为XbaⅠ酶切位点),下游引物为SOC1-R∶5′-GCC GAGCTC TTTCTGCAGAGAATTAC-3′(划线部分为SacⅠ酶切位点)。以反转录的cDNA为模板进行PCR扩增,程序为:94℃预变性2min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸7min。PCR产物经1.0%琼脂糖凝胶电泳检测,切胶回收,与pEASYTM-T1载体连接,重组质粒转入DH5α,蓝白斑筛选阳性克隆送测序。
1.2.2 水曲柳SOC1同源基因cDNA序列的获得及生物信息学分析 将测序结果与NCBI数据库中的同源序列及实验室现有的水曲柳转录组中获得的SOC1序列进行比对,并对水曲柳SOC1蛋白结构域进行预测。同时,利用protparam[14]在线计算氨基酸理化性质,各项指标包括:氨基酸数目、分子量、理论等电点、分子式、脂溶指数和不稳度指数;通过在线proscale[15]分析并预测蛋白亲/疏水性;通过SignalP[16]软件进行信号肽预测;PSORT[17]进行亚细胞定位分析;GOR4[18]分析二级结构;通过Swiss-Model[19]建立蛋白质空间结构模型。在NCBI数据库中查找不同物种中SOC1基因的同源序列,利用MEGA 5.0软件邻接算法,自检举1 000次,构建系统进化树[20]。
1.2.3 水曲柳SOC1基因pROKⅡ表达载体的构建 选择测序正确的pEASYTM-T1质粒(浓度减半)为模板,PCR扩增目的基因,所用引物及PCR程序同pEASYTM-T1载体构建时一致。对目的基因和pROKⅡ载体双酶切,酶切程序:37℃温育15 min,65℃酶失活20 min。纯化回收后T4连接酶16℃连接过夜。产物转入DH5α感受态细胞,在含有50μg/mL卡那抗生素的LB培养基上37℃过夜培养。挑取白色菌斑进行PCR验证,将获得目的条带的菌液送公司测序。构建成功的表达载体命名为pROKⅡ-35S∶∶SOC1(图1)。

2 结果与分析
2.1 水曲柳SOC1基因编码区全长的克隆及pEASYTM-T1载体的构建
电泳检测水曲柳雌雄花序总RNA,28 S和18 S条带清晰可见(图2)。

反转录和PCR扩增目的基因,其结果见图3。从图3可看出:目的条带经电泳检测处于750 bp和500 bp,与理论一致,初步认定扩增得到了目的基因。目的片段切胶回收,与pEASYTM-T1载体连接,重组质粒转入DH5α,蓝白斑筛选,挑取白色菌落PCR鉴定,电泳检测扩增片段大小在750 bp和500 bp之间。

2.2 水曲柳SOC1基因序列及蛋白的生物信息学分析
2.2.1 水曲柳SOC1基因及其蛋白序列分析 测序结果表明,获得的序列长度为654 bp,与水曲柳转录组中的SOC1序列比对后发现,核苷酸一致性为93%,编码218个氨基酸,氨基酸一致性为92%(图4)。在NCBI上进行BLAST分析发现该基因的氨基酸序列有MADS结构域(图5),说明获得的片段属于MADS超家族。


2.2.2 水曲柳SOC1基因编码蛋白一级结构分析
1)氨基酸序列理化性质分析。利用在线分析软件Protparam对SOC1基因的氨基酸序列的理化性质进行分析。SOC1蛋白p I 9.40不稳定系数61.33,为不稳定蛋白(不稳定系数小于40时,预测蛋白质稳定,反之则不稳定);总平均疏水性为-0.780,该蛋白为亲水性蛋白。
2)疏水区域/亲水区域预测。蛋白质亲/疏水性氨基酸的组成是蛋白质折叠的主要驱动力,通过亲/疏水性预测可以反映蛋白质的折叠情况。利用在线分析软件ProtScale的Kyte and Doolittle算法对SOC1蛋白进行亲水/疏水性分析(>0.5的区域为疏水区,<-0.5的区域为亲水区,介于+0.5~-0.5之间主要为两性区域)。结果表明,SOC1蛋白的氨基酸序列中亲水性、疏水性氨基酸均匀分布于整个肽链中,有13个亲水区和7个疏水区,因此可认为该蛋白为亲水性蛋白(图6)。

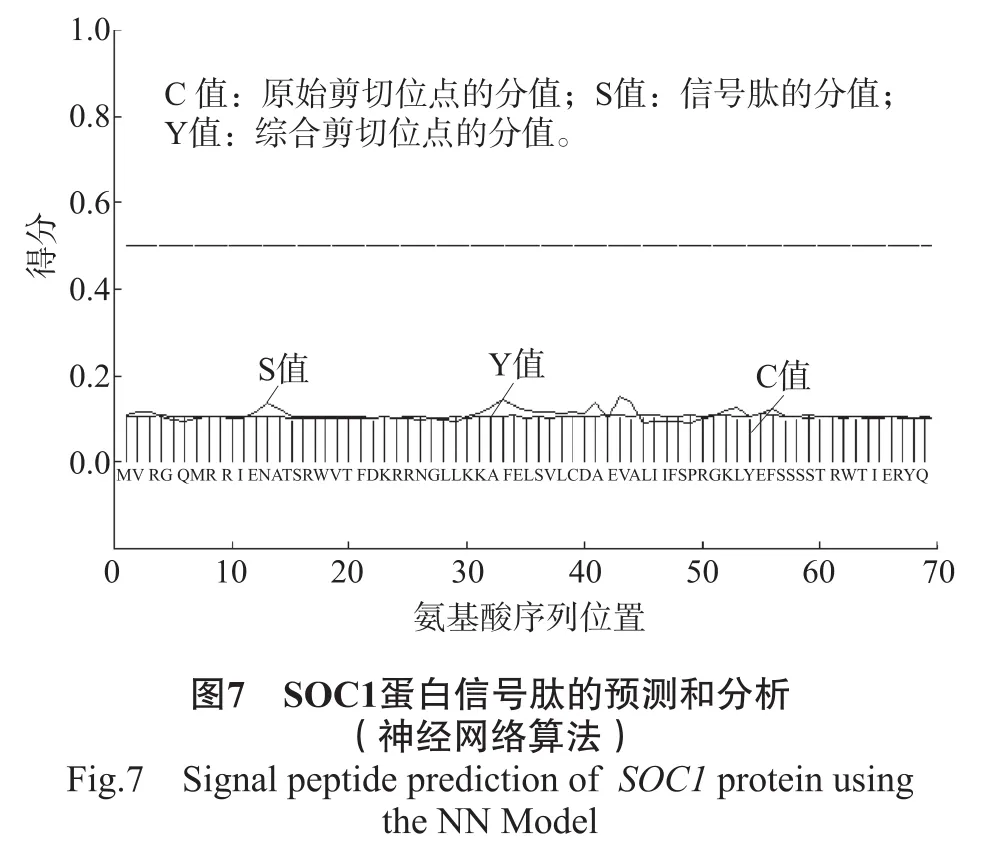
3)信号肽、亚细胞定位的预测和分析。在跨膜蛋白的N端,有一段疏水性氨基酸序列,这个氨基酸残基称为信号肽,新合成的蛋白质通过该信号肽进入正常的分选途径。信号肽在蛋白质合成结束之前被切除,信号肽位于蛋白质的N端,一般由16~26个氨基酸残基组成,其中,包括疏水核心区、信号肽的C端和N端[21]。利用在线分析工具SignalP的神经网络算法对SOC1蛋白进行预测。结果表明,SOC1蛋白可能不存在信号肽(图7)。利用在线工具WoLF PSORT对SOC1蛋白进行亚细胞定位分析,SOC1蛋白在细胞核中得分为8。
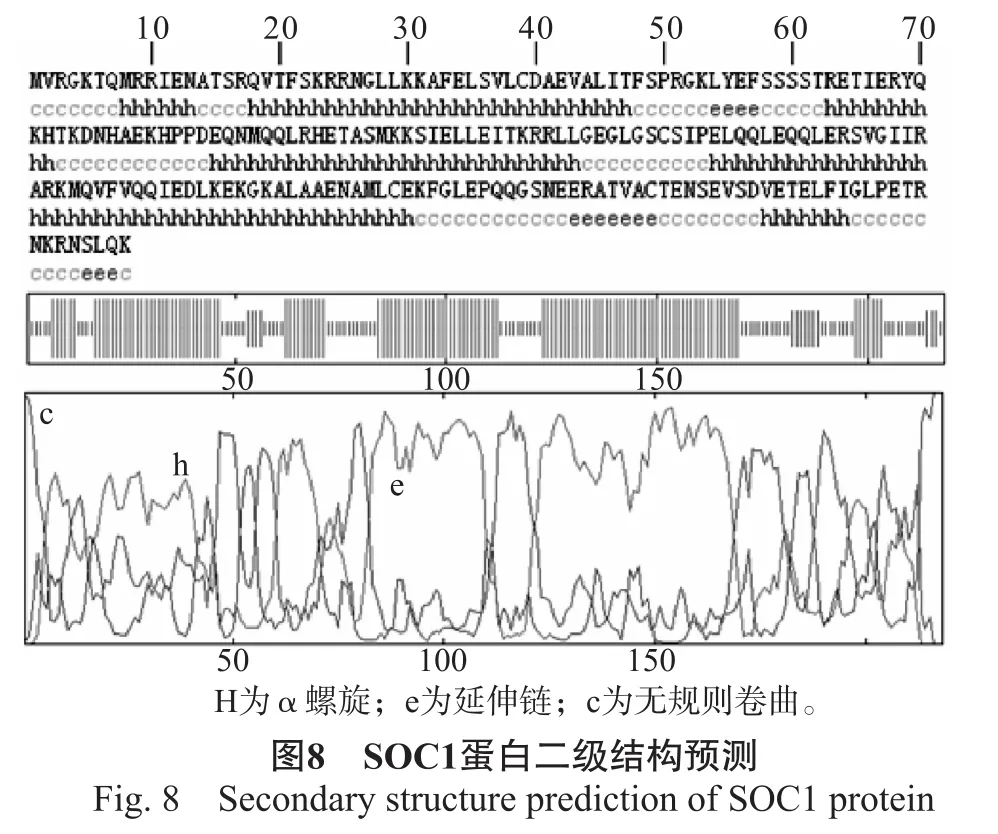
2.2.3 水曲柳SOC1蛋白质二级结构的预测和分析应用GOR4对SOC1蛋白的二级结构进行分析。SOC1蛋白由59.17%的α螺旋、34.40%的无规则卷曲和6.42%延伸链组成(图8),并且分布于整个蛋白。
2.2.4 水曲柳SOC1蛋白质三维结构的预测 利用在线分析工具Swiss-Model对水曲柳SOC1蛋白进行三维结构同源建模,以Myocyte-specific enhancer factor 2A(3mu6.1.A)为同源目标模板,SOC1蛋白同源建模结果如下(图9)。SOC1蛋白并未形成繁复的三级结构。

2.2.5 水曲柳SOC1蛋白氨基酸序列同源性比对及系统进化树构建 利用NCBI数据库中Blastx对水曲柳SOC1基因序列以及推测编码蛋白进行同源序列比对,经比对分析筛选出其他植物中已命名的SOC1同源蛋白,这些蛋白主要存在于葡萄(Vitis vinifera)、杨树(Populus tremuloide)、烟草(Nicotiana tabacum)、橡胶树(Hevea brasiliensis)、金鱼草(Antirrhinum majus)等中。这些蛋白同水曲柳SOC1蛋白序列一致性达70%以上;同时也挑选了一些序列一致性在65%~70%的蛋白序列,如甜橙(Citrus sinensis)、大豆(Glycinemax)、桦树(Betula platyphylla)、马铃薯(Solanum tuberosum)等中的同源序列,利用MEGA软件进行系统发育树构建,算法为Neighbor-Joining。结果如图10所示,水曲柳SOC1蛋白跟芝麻(Sesamum indicum)、宽叶车前(Plantago major)和金鱼草中的SCO1同源蛋白亲缘关系最近,同木本植物杨树、桦树中的同源蛋白亲缘关系较远。

2.3 水曲柳SOC1基因pROKⅡ表达载体的构建
经双酶切连接后的重组质粒转入DH5α,菌液PCR验证目的基因,结果表明存在阳性克隆。
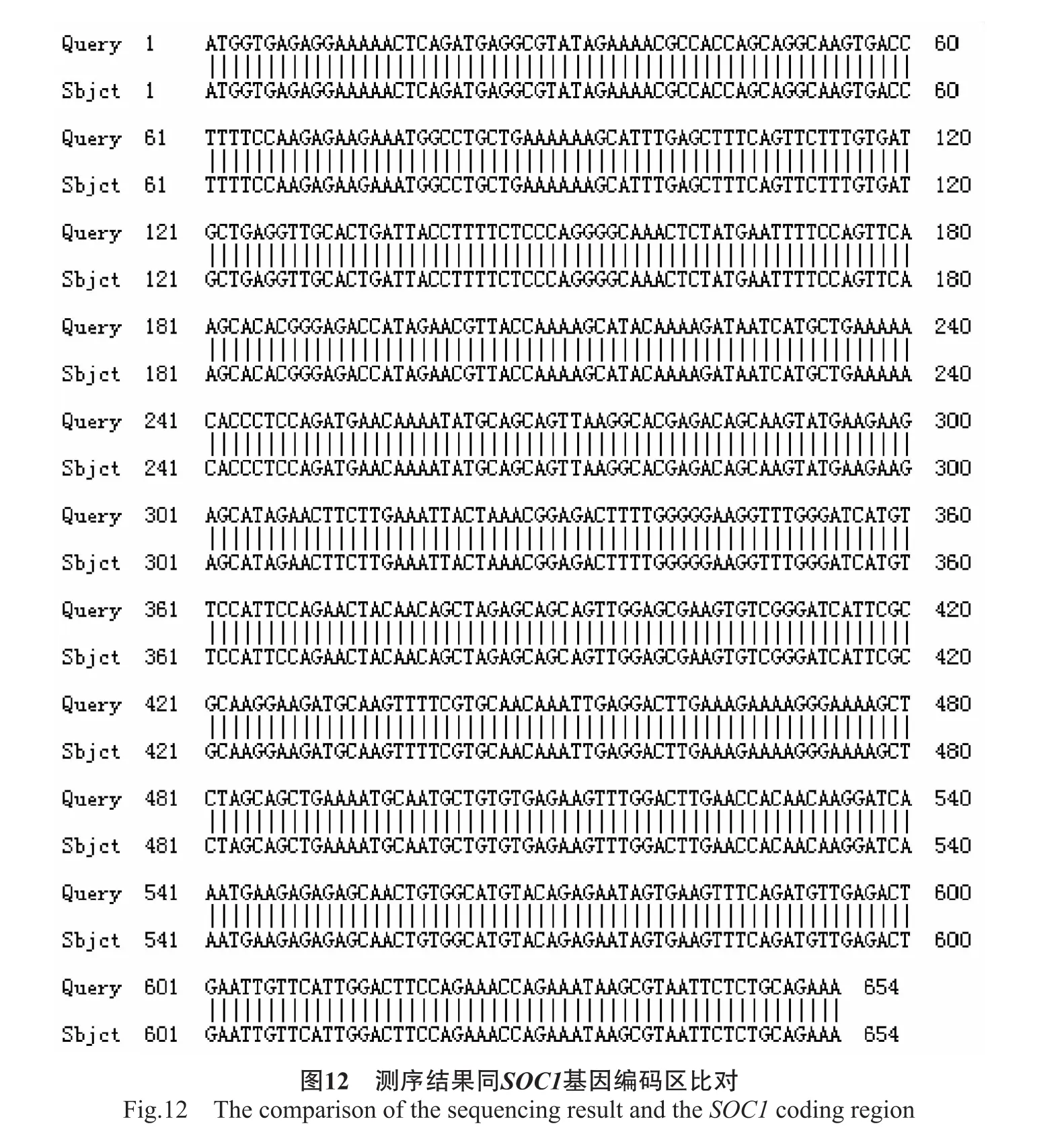
将菌液送公司测序,测序结果如图11所示(划线部分表示酶切位点),同时将测序结果同SOC1基因编码区进行比对,序列完全一致(图12),结果表明表达载体pROKⅡ-35S∶∶SOC1构建成功。

3 讨 论
MADS-box基因参与花发育各个阶段的调节过程,其中最重要的功能是花形态建成和开花时间调节[22]。SOC1作为一个MADS-box转录因子,属于SOC1/Tomato MADS-box gene 3(TM3)分支,目前已经在多种植物中鉴定出了SOC1同源基因,且该类基因大都参与了植物的成花转变和花发育,是植物从营养生长向生殖生长转变过程中重要的调控基因[23]。同时最近的研究表明SOC1是一个多功能蛋白,不光调节开花时间,也包括调控开花模式和花分生组织确定,这些特性在其他物种中也有报道。因此,SOC1在植物发育的器官发生中可能扮演一个调节器的角色[24]。对SOC1基因功能的研究,首先是分析该基因的序列结构特征。以模式植物拟南芥为例,拟南芥AtSOC1属于MADS-box家族一员,具有6个内含子和7个外显子,编码的MADS-box转录因子主要由MADS盒、K盒、I盒、C末端等部位组成[25-26]。SOC1基因在被子植物中的单子叶和双子叶中都较保守[27-29]。本研究在水曲柳中获得SOC1基因,蛋白结构预测表明,水曲柳SOC1具有典型的MADS-box结构域和K-结构域,同时具有DNA结合位点和磷酸化作用位点。其中MADS-box域是转录因子N端高度保守结构域,大约60个氨基酸[30],使基因能通过该结构域识别并结合在下游目的基因特定位点,从而调控目的基因表达。K结构域能够折叠成3个两性α螺旋,使得MADS-box蛋白间能够形成二聚体通过介导蛋白之间的相互作用来调控目标基因的表达[31]。结果表明,水曲柳SOC1属于MADS-box转录因子家族,在花发育的过程中具有调控功能。
本研究利用传统的同步双酶切连接方法构建植物表达载体,相对于单酶切,双酶切是一种省时省力的方法,保证目的基因定向插入表达载体同时避免载体自连形成空载。当然传统构建方法在构建多片段拼接的复杂载体时,其路线设计和实际操作往往比较麻烦,通常需要构建多个中间载体,工作量较大。但在没有更便捷的方法之前或者构建的载体较简单时,采用传统构建方法还是一种比较安全、稳妥的选择,并且能够获得预期的结果[32]。
本研究以带有35S启动子的载体pROKⅡ为基础,成功构建了水曲柳SOC1基因植物表达载体pROKⅡ-35S∶∶SOC1,并对SOC1蛋白进行了功能预测和生物信息学分析,为后续遗传转化及研究SOC1基因在水曲柳开花过程中的功能奠定了基础。
[1] Cseke L J,Zheng J,Podila G K.Characterization of PTM5 in aspen trees:a MADS-box gene expressed during woody vascular development[J].Gene,2003,318:55-67.
[2] Ferrario S,Busscher J,Franken J,et al.Ectopic expression of the petunia MADS-box gene UNSHAVEN accelerates flowering and confers leaflike characteristics to floral organs in a dominant-negative manner[J].The Plant Cell,2004,16:1490-1505.
[3] Nakamura T,Song I J,Fukuda T,et al.Characterization of TrcMADS1 gene of Trillium camtschatcense(Trilliaceae)reveals functional evolution of the SOC1/TM3-like gene family[J].Journal of Plant Research,2005,118:229-234.
[4] Lee J,Lee I.Regulation and function of SOC1,a flowering pathway integrator[J].J Exp Bot,2010,61(9):2247-2254.
[5] Corbesier L,Coupland G.The quest for florigen:a review of recent progress[J].JExp Bot,2006,57(13):3395-3403.
[6] Tadege M,Sheldon C C,Helliwell C A,et al.Reciprocal control of flowering time by OsSOC1 in transgenic Arabidopsis and by FLC in transgenic rice[J].Plant Biotechnol J,2003,1(5):361-369.
[7] Heuer S,Hansen S,Bantin J,et al.The maize MADS Box gene ZmMADS3 affects node number and spikelet development and is co-expressed with ZmMADS1 during flower development,in egg cells,and early embryogenesis[J].Plant Physiol,2001,127(1):33-45.
[8] Shitsukawa N,Ikari C,Mitsuya T,et al.Wheat SOC1 functions independently of WAP1/VRN1,an integrator of vernalization and photoperid flowering promotion pathways[J].Physiol Plant,2007,1(4):627-636.
[9] Zhong X F,Dai X L,Xu JH,et al.Cloning and expression analysis of GmGAL1,SOC1 homolog gene in soybean[J].MolBiol Rep,2012,39(6):6967-6974.
[10] 刘菲菲,李慧玉,王姗,等.白桦BpSOC1基因的克隆及时序表达分析[J].东北林业大学学报,2011,39(4):1-4.
[11] 石永春,杨永银,刘卫群.烟草SOC1基因的克隆和表达分析[J].中国烟草学报,2014,20(2):99-103.
[12] 付建新,杨立文,亓帅,等.甘菊SOC1同源基因ClSOC1-a和ClSOC1-b功能研究[C]//中国观赏园艺研究进展(2013),2013.
[13] Parcy F.Flowering:a time for integration.[J].International Journalof Developmental Biology,2005,49(5/6):585-593.
[14] Burge C B,Karlin S.Finding the genes in genomic DNA[J].Curr Opin Struct Biol,1998,8:346-354.
[15] John M W.The Proteomics Protocols Handbook[M].Humana Press,2005:571-607.
[16] Thomas N P,Soren B,Gunnar H,et al.SignalP 4.0:discriminating signal peptides from transmembrane regions.[J].Nature Methods,2011,8(10):785-786.
[17] Horton P,Park K,Obayashi T,et al.WoLF PSORT:protein localization predictor[J].Nucleic Acids Research,2007,35:585-587.
[18] Sen T Z,Jernigan R L,Garnier J,etal.GOR V server for protein secondary structure prediction.[J].Bioinformatics,2005,21(11):2787-2788.
[19] 邵龙婷,郑唐春,臧丽娜,等.毛果杨Eukaryotic translation initiation factor 5A(eIF5A)同源基因的生物信息学分析[J].安徽农业大学学报,2014,41(1):141-149.
[20] Tamura K,Dudley J,Kumar M N A S,etal.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)Software Version 4.[J].分子生物学进展医学期刊,2007,24(8):1596-1599.
[21] 翟中和,王喜忠,丁明孝.细胞生物学[M].北京:高等教育出版社,2000:191.
[22] Kaufmann K,Melzer R,Theissen G.MIKC-type MADS-domain proteins:Structural modularity,protein interactions and network evolution in land plants[J].Gene,2005,347:183-198.
[23] Lee H,Suh S S,Park E,et al.Theagamous-like 20 MADS domain protein integrates floral inductive pathways in Arabidopsis[J].Gene&Develop,2000,14:2366-2376.
[24] Lee J,Lee I.Regulation and function of SOC1,a flowering pathway integrator[J].Journal of Experimental Botany,2010,61(9):2247-2254.
[25] Corbesier L,Coupland G.The quest for florigen:a review of recent progress[J].Journal of Experimental Botany,2006,57(13):3395-3403.
[26] 丁峰,彭宏祥,李鸿莉,等.植物AP1基因研究进展[J].亚热带植物科学,2011,40(1):85-89.
[28] Lee S,Kim J,Han J,et al.Functional analyses of the flowering time gene OsMADS50,the putative suppressor of overexpression of co1/agamous-like 20(SOC1/AGL20)ortholog in rice[J].Plant Journal,2004,38(5):754-764.
[29] Lee J,Oh M,Park H,et al.SOC1 translocated to the nucleus by interaction with AGL24 directly regulates LEAFY[J].Plant J,2008,55(5):832-843.
[30] Melzer R,Wang Y Q,Theissen G.The naked and the dead:the ABCs of gymnosperm reproduction and the origin of the angiosperm flower[J].Semin Cell Dev Biol,2010,21(1):118-128.
[31] Pollock R,Treisman R.Human SRF-related proteins:DNA-binding properties and potential regulatory targets[J].Gen Dev,1991,5:2327-2341.
[32] 林春晶,韦正乙,蔡勤安,等.几种植物转基因表达载体的构建方法[J].生物技术,2008,18(5):84-87.
(责任编辑 张 坤)
Construction of SOC1 Gene Expression Vector and Bioinformatic Analysis in Fraxinusmandschurica
Fu Deshan1,Zhu Zhu1,Cui Liting1,Zhan Yaguang1,2,Qi Fenghui1
(1.College of Life Sciences,Northeast Forestry University,Harbin Heilongjiang 150040,China;2.State Key Laboratory of Tree Genetics and Breeding(Northeast Forestry University),Harbin Heilongjiang 150040,China)
To study the role of flowering regulation gene SOC1 in Fraxinusmandschurica,We cloned the fulllength coding region sequence of SOC1 from Fraxinusmandschurica.Sequence analysis showed that the gene is654 bp in length,encoding a protein of 218 amino acid.The gene has the highest similarity with Antirrhinum majus MADS-box transcription factor DEFH68 gene,the nucleotide similarity is 78%.The gene has MADS-box domain,K-domains,multiple DNA binding sites and phosphorylation sites,so it is a transcription factor of MADS-box family.In this study,we successfully constructed a Fraxinusmandschurica SOC1 gene plant expression vector pROKⅡ-35S∶∶SOC1 with the use of double digestion method,laying a solid foundation for the further genetic transformation in Fraxinusmandschurica.
Fraxinusmandschurica;SOC1;bioinformatics;expression vector construction
S722.3
:A
:2095-1914(2015)06-0006-08
10.11929/j.issn.2095-1914.2015.06.002
2015-03-21
国家“十二五”科技支撑项目(2012BAD21B0201-08)资助。
第1作者:付德山(1990—),男,硕士生。研究方向:水曲柳开花相关基因。Email:994877455@qq.com。
齐凤慧(1976—),女,博士,硕士生导师,高级工程师。研究方向:基因工程、植物细胞工程。Email:qifenghui2001@126.com。

