乳腺X线相衬成像
王升平 综述 彭卫军 审校
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
(收稿日期:2015-08-30 修回日期:2015-12-02)
·综述·
乳腺X线相衬成像
王升平 综述 彭卫军 审校
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺癌发病率占女性所有癌症的25%左右,是女性癌症死亡的首因。为降低乳腺癌死亡率,很多国家实施了乳腺X线筛查方案。然而,因检查相关的辐射暴露和诊断精度需改进等原因,乳腺X线筛查的可行性仍存在争议。X线相衬成像是一种新的成像技术,对X线穿过物体后的折射敏感,具有很好的软组织对比度,并能显著改善癌组织结构的显示,特别适合弱吸收物质成像。因此,乳腺X线相衬成像有望改善早期乳腺癌的诊断。已有研究表明,乳腺相衬CT成像能清楚显示乳腺组织的微细结构,而这些结构通常只能通过组织病理学检查观察到,这意味着乳腺X线相衬成像可能引领新的影像学应用趋势。本综述简要概述了相衬成像的主要理论和几种成像技术,介绍了乳腺相衬成像的最新发展及其临床应用情况。
乳腺;X线;相衬成像
乳腺癌是女性最常见的恶性肿瘤之一,发病率居女性恶性肿瘤的第2位,死亡率居女性恶性肿瘤的第1 位[1]。 全 视 野 数 字 乳 腺 X线摄影(full-field digital mammography,FFDM)是目前广泛应用的简单有效的乳腺癌筛查手段,但存在微钙化检出能力弱、肿瘤与正常组织分辨差的不足。近年来数字乳腺X线断层摄影(digital breast tomosynthesis,DBT)、双能对比增强减影乳腺摄影(dual-energy contrast-enhanced subtracted mammography,DE-CESM)和乳腺CT成像成为研究热点。DBT通过对乳腺多角度快速采集低剂量投影数据重建断层图像,可减少腺体、肿瘤等结构的掩蔽,显示三维信息,提高病变的检出率和准确率[2-3]。DE-CESM是在数字乳腺X线摄影(digital mammograpy,DM)的基础上使用对比剂以增加软组织对比度的一种成像技术,诊断乳腺癌的灵敏度较高[4]。乳腺CT成像具有三维可视化、组织密度定量分析、高度各向同性、可再现性等特点,可作为乳腺成像的补充技术。然而,这些技术仍有待改进和完善。如FFDM、DBT和乳腺CT成像均存在软组织对比分辨率不足的固有缺点;DE-CESM提高了软组织对比度,但需使用造影剂;DBT、DE-CESM和乳腺CT辐射剂量较高。
MRI诊断乳腺疾病的灵敏度很高,但特异度变化很大,其检测微钙化的能力有限。MRI筛查可早期发现家族性乳腺癌[5],对高风险乳腺癌人群尤其是已知的BRCA基因突变携带者有益[6],但其长期生存获益尚需谨慎评估。动态增强MRI需使用造影剂,其检查相关禁忌证也较多。基于以上原因,虽然过去10年间应用MRI进行乳腺癌筛查从0.03%增加至0.3%,但其仍难以广泛应用于乳腺癌筛查[7]。乳腺超声具有简便、无创、无辐射、可反复使用等特点,但存在检查时间长、操作者依赖性、微小钙化显示不佳的局限。
因此,研发可靠的、便捷的乳腺癌成像新技术仍是当前面临的挑战。X线相衬成像(phase contrast imaging,PCI)是近几十年来发展的新成像技术,具有出色的软组织对比度[8-9],有望成为未来检测乳腺癌的新手段。现就PCI的物理基础、成像信息的采集方法及乳腺进展进行综述。
1 PCI
1.1 概述
X线穿过物体时,在其传播路径上会发生相位变化(即相位移动,简称相移),探测并记录这种相移信息并将之转换为探测器可接收到的光强信息便会得到相位衬度成像,简称PCI。X线与物质的整体相互作用可用复折射率n来表示(图1)[10]:n=1-δ+iβ。
式中实部δ对应相位的变化,称为相位因子,与物质的相移截面p有关;虚部β对应吸收的变化,称为衰减因子,与物质的X线线性衰减系数μ有关[11]。传统X线成像的空间分辨率在毫米量级,密度分辨率约0.01 g/cm3,而PCI的密度分辨率为0.002~0.000 3 g/cm3,轻元素构成的物质引起X线的相移是其对X线衰减的1 000倍[12]。因此,对于弱吸收物质,探测其相移信息比探测其衰减信息要更加有效。PCI能提供更好的软组织对比度,显示出传统X线衰减成像无法显示的细微结构,具有传统X线成像无法比拟的优势。此外,相位衬度取决于X线的相干散射而不是吸收,可减少组织的潜在辐射损伤[13]。现代乳腺影像学正由宏观影像学向微观影像学发展,提高软组织成像的衬度和空间分辨率成为乳腺成像的重要研究课题。PCI以全新的成像机制解决了软组织成像的衬度问题,一旦PCI成功转化为临床技术使用,将会给乳腺癌的诊断和治疗带来重大影响。
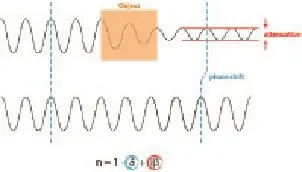
图1 X线穿过物体时的强度和相位变化
1.2 PCI技术
根据相位信息提取方法的不同,PCI有4种成像方法:晶体干涉仪成像法(analyser-based imaging,ABI)、衍射增强成像法(diffraction enhanced imaging,DEI)、相位传播成像法(propagation-based imaging,PBI)和光栅干涉仪成像法(grating interferometer,GI)。
1.2.1 ABI
ABI简称干涉法,最早由Bonse和Hart于1965年提出。其成像系统由3块平行的完美晶体(Si)组成,如图2A所示[10]。根据Bragg衍射效应,第1块晶体将入射X线分为两束,经过第2块晶体再次分束后,在第3块晶体前两束X线相干叠加,形成干涉条纹。在其中一束X线的路径上放置物体后会形成X线相移,探测器记录并解析这个相移便可得到相衬图像。干涉法的相位测量灵敏度极高,尤其适用于尺寸很小的软组织样品成像。1995年日本Momose研究小组[14]采用ABI对一份兔肝癌样品进行断层扫描并三维重建,获得的相衬CT图像能清楚分辨肿瘤组织与正常组织;此外,还能清楚显示变性肿瘤组织和纤维组织的精细结构。ABI对晶体的自对准、系统的稳定性及X线方向和能量的选择性等要求极其苛刻,应用受到限制。
1.2.2 PBI
1995 年 法国 科 学 家Snigirev等[15]首 次提 出PBI并在欧洲同步辐射光源(European Synchrotron Radiation Facility,ESRF)上实现。PBI的成像装置仅由光源和探测器组成,不需引入其他任何光学器件,是最简单的PCI方法。通过增大探测器与物体之间的距离,利用相干X线在位相突变处的边界发生菲涅尔衍射获得X线的二阶相移信息进行成像(图2B)[10]。因其成像方法类似于同轴全息成像,故又名同轴相衬成像方法(in-line phase contrast imaging,IL-PCI)。该方法除装置简单、系统稳定性高外,对X线的单色性要求较低,常规的X线光机就能满足要求。然而,PBI对光源的空间相干性要求很高,因此要采用同步辐射光源或微焦点X线光机。Wilkins等[16]于1996年首次在微焦点X线光源上实现了同轴成像,并于2002年基于扫描电子显微镜建立了一套高分辨率的同轴成像系统,空间分辨率达0.2 μm。中国科学院上海应用物理研究所的肖体乔研究员在上海光源(Shanghai Synchrotron Radiation Facility,SSRF)的BL13W1线站进行了大量生物医学成像研究,取得卓有成效的成果。相比常规X线成像,PBI成像装置只是增大了传播距离,很容易做到快速CT扫描,被认为是最有可能应用于临床医学的PCI方法。目前为止开展的人体乳腺PCI的相关临床试验均应用PBI,其临床应用前景广阔。
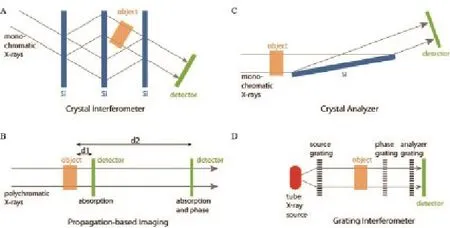
图2 4种相衬成像方法示意图A:晶体干涉仪成像法;B:相位传播成像法;C:衍射增强成像法;D:光栅干涉仪成像法
1.2.3 DEI
DEI最早由Davis等[17]提出,其装置由光源、两块晶体(单色晶体、分析晶体)和探测器组成(图2C)[10]。入射X线经过单色晶体获得单色光,经物体调制后到达分析晶体,满足布拉格反射条件的射线被探测器记录。分析晶体起角度过滤器的作用,旋转两块晶体,就可获得一条角度-强度曲线,即反射率曲线,又名扭摆曲线,解析摇摆曲线便可从中分离出一阶相位信息(折射角)、衰减信息和散射信息。扭摆曲线的半高宽在微弧度量级,因此DEI具有较高的灵敏度。摇摆曲线峰值附近获取的图像对比度最高,这种成像机制在乳腺纤维组织成像中发挥重要作用。DEI需单色性强、高准直的X线,因此常用在同步辐射装置上。
1.2.4 GI
GI分别由David等[18]在2002年和Momose[19]在2003年提出。其系统需入射的X线具有足够高的空间相干性,因此最初的GI实验均在同步辐射装置上完成,期间受光源和成像视野范围的限制而进展缓慢,没有得到广泛应用。2006年,Preiffer等[20-21]通过引入一块源光栅产生的Lau效应,在常规X线光机上实现了基于Talbot-Lau效应的光栅成像,开创性地完成了常规X线机的光栅PCI,迈出了其应用实际的第一步。Preiffer等[20,22]使用的光栅成像系统组成如图2D所示[10],共有3个光栅:源光栅(G0)、相位光栅(G1)和分析光栅(G2)。G0的作用是将入射的多色X线分成一系列相干的线光源阵列。G1的作用是相位调制,基于Talbot效应,线光源阵列入射G1光栅后,会在其后的Talbot距离处产生干涉条纹,将G2放在探测器前用于解析这些干涉条纹。当G2沿x方向做步进运动(phase stepping,PS)[23]时,探测器像素上每个PS周期的平均光强都会呈正弦波式的周期振荡,形成一条随着步进数变化的光强曲线,称为强度-位移曲线。解析强度-位移曲线即可到图像。GI的优势在于,不但可获得衰减和相衬信息,还能同时获得第三种成像信息,即反映物体内部微细结构的暗场信息[9,24]。利用GI还可定量分析[24-27]。基于以上优点,GI有望最早应用于临床。
2 乳腺PCI
鉴于PCI能提供更好的软组织对比度,该技术可提高目前乳腺影像学技术的诊断效能,发展出新的乳腺癌影像学诊断模式。近几年该领域的研究工作大致分为3个方向,一是旨在改善软组织对比度而增强临床诊断效能的乳腺相衬X线摄影(phase contrast mammography,PCM)研究,二是用乳腺相衬CT(phase contrast computed tomography,PC-CT)对离体乳腺癌标本的细微结构特征进行可视化研究,三是乳腺暗场成像研究。
2.1 PCM
早在1998年,Ingal等[28]就开始在同步辐射光源上使用DEI技术对44例离体乳腺标本成像,结果显示DEI的图像质量优于常规DM,具有很高的分辨率,能显示50 μm的细微结构和微钙化。Keyrilainen等[29]、Fernandez等[30]使用基于同步辐射的ABI技术对离体乳腺癌标本进行PCI,发现PCM能更好地显示常规X线摄影无法识别的乳腺结构细节,清楚显示胶原纤维束,还能将腺体和脂肪组织的边界精细地勾画出来。Fernandez等通过ABI发现乳腺肿瘤组织对比度的变化与肿瘤生长过程中的胶原重塑相关。Williams等[31]应用常规微焦点X线对72例切除乳房标本成像以评价PCM性能,结果显示基于IL-PCI技术的相衬图像质量优于以吸收为基础的衰减图像。Stampanoni等[32]基于常规X线用GI技术对5份乳房标本进行成像,GI一次采集同时获得携带3种不同物理信息(吸收、相衬和散射)的图像,3种图像有效互补,综合分析3种图像提高了诊断能力,另外相衬图像较好地显示小肿瘤和肿瘤边界等细微结构。
PCM已在离体乳腺标本显像中显示出了明显优势,但体外研究与体内研究有根本区别,因此需临床试验来评估其可行性和临床获益情况。第1项PCM临床试验[33-34]已完成,此项研究前瞻性评价了基于同步辐射的PCM技术对乳腺可疑病变的诊断贡献。该试验共纳入49例可疑乳腺异常病例,这些病变均经常规DM和(或)超声检查证实,以及两位放射科医师根据乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)阅片,以BI-RADS评分1~3分为阴性结果,BI-RADS评分4~5分为阳性结果。结果显示,PCM的灵敏度为81%(13/16;95% CI:54%~95%)、特异度为94%(29/31;95%CI:77%~99%),均优于DM的灵敏度(69%)和特异度(52%)[34]。对每例患者,以穿刺活检或1年随访结果作为参照标准,结果表明PCM能增加真阴性率(29/31),特别适合作为DM的二级检查手段,从而减少侵袭性检查。然而,将PCM应用于低患病率人群还要采取更加仔细的临床评价措施,如独立阅片、受试者工作特征(receiver operating characteristic,ROC)曲线分析等,以充分判断该技术的附加价值。此外,本研究中PCM图像质量的改善部分归因于良好的X线束特性的改进,如单色性、非发散性和空间相干性的提高,而不仅归因于相衬效应本身[34]。
PCM技术在离体标本成像中图像质量的改善已得到证实,其能否提高临床诊断性能尚存疑问。Tanaka等[35]于2005年基于常规X线的商用PCI系统(KONICA MINOLTA公司)用PBI技术对38例患者进行乳腺PCM,由3位医师采用盲法独立评价屏-片(screen-film,SF)和PCM图。通过ROC曲线分析发现PCM更易检出乳腺肿块和微钙化。PCM对微钙化、肿瘤及致密型乳腺中细微密度变化和异常纤维结构的显示优于SF[36-37]。然而,当筛查的患者样本量大于3 000时,PCM并没有在召回率或癌症检出率中表现出优势[37]。因此,评估不依赖同步辐射的PCM技术的诊断性能可能更具有意义。2005年,日本爱知县Chunichi医院开展了一项比较商用数字PCM系统与SF系统的乳腺癌筛查性能的临床研究[32],3 835人用PCM系统筛查,4 338人用SF系统筛查。结果显示,PCM的召回率、阳性预测值、乳腺癌检出率分别是5.53%、5.16%和0.287%,SF的召回率、阳性预测值、乳腺癌检出率分别是5.00%、4.89%和0.254%,两种系统的筛查性能无统计学差异。但乳腺异常如结构扭曲、微钙化和肿块等的检出率,PCM(13.74%)高于PS(8.90%)。研究者认为,PCM能帮助放射科医师提高乳腺诊断分类的准确率。上述商用系统采用的都是PBI技术,GI技术结合使用编码孔径检测技术的成像样机正在开发中,有望在未来临床试验中应用[38]。
PCM可用于乳腺切缘评估。有报道乳腺癌手术不完全切除后,再切除率达40%。肿瘤累及切缘是局部复发的高风险因素,因此术中需冷冻切片对切缘快速评估。然而,冷冻切片的诊断准确率低于组织切片。有研究表明,组织病理学结合micro-CT评价乳腺癌术中切缘会略微高估切缘阳性率。相衬CT提高了软组织对比度,并能清楚显示乳腺组织的细微结构,将会对切缘评估提供有用的额外信息。除对比度提高和细微结构可视化的改善外,PCI还有定量分析能力。Wang等[39]用PCI测量乳腺标本的密度,其能提供更准确的乳腺密度定量信息,从而消除当前成像方法的主观性。
2.2 PC-CT
乳腺组织越厚,基于投影的图像特征信息就越少,三维CT成像能解决这个问题。基于同步辐射的PCI能提供出色的图像质量观察病变的细微结构。与以吸收为基础的CT图像相比,基于同步辐射的离体荷瘤乳房组织的相衬CT图像具有出色的软组织对比度。与常规成像方式相比,PCI技术改善了乳腺组织形态和胶原蛋白束的显示,获得与组织病理检查良好匹配的图像,不但能更加深入了解乳腺的微细结构,还能区分不同类型乳腺肿瘤的细微差别。Schleede等[40]基于同步辐射光源采用GI技术对同时含有浸润性导管癌和导管内原位癌的1份离体人乳腺标本(2 cm× 2 cm×2 cm)进行CT成像,发现浸润性导管癌和导管内原位癌的相衬CT特征具有显著差异。导管内原位癌因为含有扩张的导管而表现为较强的相衬信号,与浸润性导管癌及周围正常乳腺结构差异明显,与组织病理切片具有很好的一致性;而吸收CT上胶原纤维、导管壁与导管内肿瘤没有明显的对比度差异或差异很小。该研究显示,基于GI技术的PC-CT可成功区分浸润性导管癌与导管内原位癌,从而证实了以上推断。
Grandl等[41]选取2份离体乳腺癌标本,基于常规X线用GI技术进行PC-CT成像,并与病理切片对照。结果显示,相衬CT能清晰显示扩张的导管、肿瘤浸润的边缘、表皮、皮下及纤维组织层等结构。由于扩张导管周围紧凑排列着伴有区域性坏死的肿瘤细胞,坏死区域周围是疏松的纤维组织,造成以扩张导管为中心的局部区域不均匀,因而具有很强的相位衬度,PC-CT可很容易地将表现为明亮环形结构的导管从较暗的背景上识别出来。纤维组织区域相位衬度更高,在PC-CT上表现得比肿瘤更明亮。导管、肿瘤细胞与纤维束的密度差异非常小,吸收成像依赖组织的密度,因此吸收CT难以清晰显示这些细微结构。PCI依赖组织不同结构的相位梯度,因此对边界更加敏感,这对肿瘤组织的边界辨识具有重要意义。如果PC-CT能成功转化为临床应用,它就能提供精准的癌细胞和肿瘤之间的形态和分化情况,有助于鉴别乳腺癌与正常组织。
事实上,PCI-CT成像已迈出临床应用的第一步。Pani等[42]在 意大利同 步辐射光 源 (Elettra Synchrotron Radiation Facility)上对取自新鲜尸体的整个乳房样本进行相衬CT成像,表明乳腺相衬CT能在临床可接受的辐射剂量范围内实现。Sztrókay等[43]报道在欧洲同步辐射光源上可在高达70 keV的能量下利用PCI对整个乳腺样本进行PCI, 提高了X线 能量利用 率。Grandl等[44]发 表的第1个基于常规X线的PC-CT研究结果令人鼓舞,他们成功应用常规X线管对选择过的乳腺样本进行光栅CT成像,但其辐射剂量远远超过临床上限值。Zhao等[45]提出等斜率断层扫描(equally sloped tomography,EST)采集和重建数据,可减少投影数量,从而显著减少CT数据采集时间并降低约70%的辐射剂量,且不损失图像质量。其辐射剂量已接近临床常规乳腺X线摄影的剂量水平。
2.3 乳腺暗场成像
如上文所介绍,GI在一次数据采集可同时获得3种信息的图像,除吸收图像和相衬图像,还有暗场图像[22]。暗场图像表现的是物体小角度X线散射和超小角度X线散射(ultra small angle X-ray scattering,USAXS)的能力,与物体内部结构的不均匀性、比表面积及样品厚度等有关。物体内部结构越不均匀、比表面积越大,散射能力就越强。事实上乳腺癌切除标本的高对比度暗场信号已被证明与肿瘤区域中的微钙化相关[26]。在某些情况下,暗场成像能显示微米大小的钙化,吸收成像、相衬图像及临床X线摄影却不能显示。暗场信号还与乳腺肿瘤的生长有关。Fernandez等[30]在2005年基于同步辐射对离体乳腺癌样本进行小角度X线散射成像,发现肿瘤浸润的胶原纤维与正常胶原纤维的晶面间距(d-spacing)及信号强度有明显差异。原因是肿瘤浸润导致乳腺胶原纤维降解,胶原降解是产生小角度散射的关键,使胶原纤维结构发生变化,比表面积增加,散射增强,表现为肿瘤浸润的胶原纤维信号强度增加。这个发现非常重要,表明PCI可显示乳腺癌胶原纤维结构深层次上的变化,提供了反映肿瘤生长的重要信息,而以往这些信息只能从组织切片上获得。
暗场成像对微钙化较敏感。Grandl等[44]对3份乳腺癌新鲜标本基于常规X线进行暗场乳腺X线摄影(dark-field mammography,DFM),发现DFM能显著提高肿瘤特征的可视化,优于常规DM;且DFM对散在的钙化颗粒敏感,可用来分析乳腺微钙化的构成。乳腺微钙化按化学成分可分为Ⅰ型和Ⅱ型[46-47],Ⅰ型多见于良性病变,Ⅱ型常见于恶性肿瘤,微钙化的化学构成与肿瘤的关系非常密切[48]。Wang等[49]通过对两种钙化模型进行基于常规X线的光栅PCI,发现微钙化的吸收信号和暗场信号具有互补的特点。即:Ⅰ型微钙化吸收信号弱而散射信号强,Ⅱ型微钙化吸收信号强而散射信号弱。暗场信息除以吸收信息获得的R值鉴别两型微钙化,其灵敏度和特异度皆为100%,具有完美的鉴别诊断能力,并在离体乳腺标本中得到了很好的验证。
2.4 存在的问题和解决方法
问题之一,现有的PCI尤其是PC-CT成像,扫描时间长、辐射剂量大,严重阻碍了其在临床上的应用。Zhu等[50]利用正反向投影间的共辄特性,提出了一种与CT兼容的快速低剂量简便信息分离方法——正反投影方法,该方法使用两幅图像即实现了吸收信号与折射信号的分离,减少了扫描时间,并降低了辐射剂量。未来随着整个成像系统的改进和相位信息提取算法的优化[45,51]、 高 分 辨率和高探测量子 效 率 (detective quantum efficiency,DQE)X线光子探测器[13]的研发和使用,相信PCI会逐步减少扫描时长和降低辐射剂量,达到临床应用标准。
问题之二,DEI和GI为获得相位信息,降低了X线的转化利用率,而这对其临床应用转化非常重要。Olivo等[52]开发一种调 整的“边缘 照明”(edge-illumination)技术,结合常规X线摄影系统,搭建了一个PCI样机。PCI样机获得的离体乳腺标本图像质量优于常规DM图像质量,特别是在显示微钙化方面更具有优势。PCM上钙化的对比度是DM的5~9倍,PCM还能显示DM上未能显示的乳腺结构和微钙化,而其辐射剂量与常规摄影相当。Olivo等使用“边缘照明”技术能很容易地将PCI技术转化为临床应用,为PCI技术的临床转化应用创建了一个直捷通路。随着新的紧凑型高亮度X线源如液态金属X线源、基于等离子体的X线激光器、准单色光可调逆康普顿散射X线源等的研发成功和使用,有望突破X线能量利用效率低的瓶颈,加快PCI临床应用转化的进程。
问题之三,早期发现乳腺癌对放射科医师来说仍是一个很大的挑战。理想情况下,为显著降低乳腺癌的死亡率,应在原位癌阶段检出肿瘤[53]。然而,即使对导管内原位癌最敏感的MRI也无法足够可靠地诊断导管内原位癌[54-55],使部分患者不得不接受活检等有创操作[56],即使术前MRI检查也未能改善手术疗效[57]及降低局部复发率和远期复发率[58]。基于GI的PC-CT成像能清楚显示导管内原位癌的特异征象——扩张的乳腺导管。暗场图像还能检出早期的微钙化并能区分良恶性。综合其多种信息成像和三维成像的能力,基于GI的乳腺PCI有望作为一种新的补充诊断技术,提高导管内原位癌的检出率和诊断准确率,并减少创伤性操作。
3 结语
乳腺PCI的可行性和潜在价值已被很多研究证明。PCM具有较好的灵敏度和特异度,优于常规DM;PC-CT能清楚显示肿瘤边界、胶原纤维及扩张导管等常规吸收CT无法显示的细微结构,其软组织对比度也远远超出常规吸收CT。GI一次成像能同时获得3种信息的图像,为现有乳腺成像技术提供额外的丰富诊断信息,尤其是在现有影像学检查结果不够明确时能提供帮助。迄今乳腺PCI技术的临床研究[33-34]是在同步辐射光源上完成的,而同步辐射受很多条件的限制,难以在大规模筛查中开展。因此,未来的研究将聚焦在基于常规X线的PCI技术应用于乳腺癌筛查的可行性和临床获益等方面的研究。与所有临床新技术一样,引入临床应用也将是PCI面临的挑战。未来应着眼于PCI的临床转化研究,通过研发高效X线源、改进成像装置、优化信息提取方法和重建算法、提高探测器DQE等措施,不断改进和完善PCI,尽快从实验室走向临床。
[1]TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2]SECHOPOULOS I. A review of breast tomosynthesis. Part II. Image reconstruction, processing and analysis, and advanced applications [J]. Med Phys, 2013, 40(1): 14302.
[3]SECHOPOULOS I. A review of breast tomosynthesis. Part I. The image acquisition process [J]. Med Phys, 2013, 40(1): 14301.
[4]CHEUNG Y C, LIN Y C, WAN Y L, et al. Diagnostic performance of dual-energy contrast-enhanced subtracted mammography in dense breasts compared to mammography alone: interobserver blind-reading analysis [J]. Eur Radiol, 2014, 24(10): 2394-2403.
[5]RIEDL C C, LUFT N, BERNHART C, et al. Triplemodality screening trial for familial breast cancer underlines the importance of magnetic resonance imaging and questions the role of mammography and ultrasound regardless of patient mutation status, age, and breast density [J]. J Clin Oncol, 2015, 33(10): 1128-1135.
[6]EHSANI S, STRIGEL RM, PETTKE E, et al. Screening magnetic resonance imaging recommendations and outcomes in ratients at high risk for breast cancer [J]. Breast J, 2015, 21(3): 246-253.
[7]KILLELEA B K, LONG J B, CHAGPARET A B, et al. Evolution of breast cancer screening in the Medicare population: clinical and economic implications [J]. J Natl Cancer Inst, 2014, 106(8): 42-48.
[8]PFEIFFER F, HERZEN J, WILLNER M, et al. Grating-based X-ray phase contrast for biomedical imaging applications [J]. Z Med Phys, 2013, 23(3): 176-185.
[9]MOMOSE A, YASHIRO W, KIDO K, et al. X-ray phase imaging: from synchrotron to hospital [J]. Philos Trans A Math Phys Eng Sci, 2014, 372(2010): 20130023.
[10]AUWETER S D, HERZEN J, WILLER M, et al. X-ray phase-contrast imaging of the breast-advanced towards clinical implementation [J]. Br J Radiol, 2014, 87(1034): 20130606
[11]STAMPANONI M, WANG Z, THÜRING T, et al. The first analysis and clinical evaluation of native breast tissue using differential phase-contrast mammography [J]. Investig Radiol, 2011, 46(12): 801-806.
[12]MOMOSEA A, TAKEDA T, YONEYAMAET A, et al. Wide-area phase-contrast X-ray imaging using large X-ray interferometers [J]. Nucl Instr Meth Phys Res A, 2001, 467-468, Part 2: 917-920.
[13]ZHOU S A, BRAHME A. Development of phasecontrast X-ray imaging techniques and potential medical applications [J]. Phys Med, 2008, 24(3): 129-148.
[14]MOMOSE A, TAKEDA T, ITAI Y, et al. Phase-contrast X-ray computed tomography for observing biological soft tissues [J]. Nat Med, 1996, 2(4): 473-475.
[15]SNIGIREV A, SNIGIREVA I, KOHN V, et al. On the possibilities of X-ray phase contrast microimaging by coherent high-energy synchrotron radiation [J]. Rev Sci Instr, 1995, 66(12): 5486-5492.
[16]WILKINS S W, GUREYEV S W, GAOET D, et al. Phase-contrast imaging using polychromatic hard X-rays [J]. Nature, 1996, 384(6607): 335-338.
[17]DAVIS T J, GAO D, GUREYEV T E, et al. Phasecontrast imaging of weakly absorbing materials using hard X-rays [J]. Nature, 1995, 373(6515): 595-598.
[18]DAVID C, NOHAMMER B, SOLAKET H H, et al. Differential X-ray phase contrast imaging using a shearing interferometer [J]. Appl Phys Lett, 2002, 81(17): 3287-3289.
[19]MOMOSE A. Phase-contrast X-ray imaging based on interferometry [J]. J Synchrotron Radiat, 2002, 9(Pt 3): 136-142.
[20]PFEIFFER A, WEITKAMP T, BUNKET O, et al. Phase retrieval and differential phase-contrast imaging withlow-brilliance X-ray sources [J]. Nat Phys, 2006, 2(4): 258-261.
[21]PFEIFFER F, KOTTLER C, BUNK O, et al. Hard X-ray phase tomography with low-brilliance sources [J]. Phys Rev Lett, 2007, 98(10): 1178-1196.
[22]PFEIFFER F, BECH M, BUNKET O, et al. Hard-X-ray dark-field imaging using a grating interferometer [J]. Nat Mater, 2008, 7(2): 134-137.
[23]WEITKAMP T. X-ray phase imaging with a grating interferometer [J]. Opt Express, 2005, 13(16): 6296-6304.
[24]PFEIFFER F, BECH M, BUNKET O, et al. Hard-X-ray dark-field imaging using a grating interferometer [J]. Nat Mater 2008, 7(2): 134-137.
[25]SARAPATA A, WILLNER M, WALTERET M, et al. Quantitative imaging using high-energy X-ray phase-contrast CT with a 70 kVp polychromatic X-ray spectrum [J]. Opt Express, 2015, 23(1): 523-535.
[26]WILLNER M, HERZEN J, GRANDLET S, et al. Quantitative breast tissue characterization using gratingbased X-ray phase-contrast imaging [J]. Phys Med Biol, 2014, 59(7): 1557-1571.
[27]WANG Z, STAMPANONI M. Quantitative x-ray radiography using grating interferometry: a feasibility study [J]. Phys Med Biol, 2013, 58(19): 6815-6826.
[28]INGAL V N, BELIAEVSKAYA E A, BRIANSKAYAET A P, et al. Phase mammography-a new technique for breast investigation [J]. Phys Med Biol, 1998, 43(9): 2555-2567.
[29]KEYRILAINEN J, FERNANDEZ M, FIEDLERET S, et al. Visualisation of calcifications and thin collagen strands in human breast tumour specimens by the diffraction-enhanced imaging technique: a comparison with conventional mammography and histology [J]. Eur J Radiol, 2005, 53(2): 226-237.
[30]FERNANDEZ M, KEYRILAINEN J, SERIMAAET R, et al. Human breast cancer in vitro: matching histopathology with small-angle x-ray scattering and diffraction enhanced x-ray imaging [J]. Phys Med Biol, 2005, 50(13): 2991-3006.
[31]WILLIAMS I M, SIU K K W, RUNXUANET G, et al. Towards the clinical application of X-ray phase contrast imaging [J]. Euro J Rad, 2008, 68(3): S73-S77.
[32]STAMPANONI M, WANG Z, THURINGET T, et al. The first analysis and clinical evaluation of native breast tissue using differential phase-contrast mammography [J]. Invest Radiol, 2011, 46(12): 801-806.
[33]LONGO R, TONUTTI M, RIGONET L, et al. Clinical study in phase-contrast mammography: image-quality analysis [J]. Philos Trans A Math Phys Eng Sci, 2014, 372(2010): 20130025.
[34]E CASTELLIE, TONUTTIM, ARFELLIETF, et al. Mammography with synchrotron radiation: first clinical experience with phase-detection technique [J]. Radiology, 2011, 259(3): 684-694.
[35]TANAKA T, HONDA C, MATSUOET S, et al. The first trial of phase contrast imaging for digital full-field mammography using a practical molybdenum x-ray tube [J]. Invest Radiol, 2005, 40(7): 385-396.
[36]MORITA T, YAMADA M, KANO A, et al. Subtle abnormalities in highly dense breasts detected by use of a digital phase contrast mammography system: a report of three invasive cancer cases in the early stage [J]. Lect Notes Comput Sci, 2008: 228-234.
[37]MORITA T, YAMADA M, KANO A, et al. A comparison between film-screen mammography and full-field digital mammography utilizing phase contrast technology in breast cancer screening programs [J]. Lect Notes Comput Sci, 2008: 48-54.
[38]MUNRO P R T, IGNATYEV K, SPELLERET R D, et al. Design of a novel phase contrast X-ray imaging system for mammography [J]. Phys Med Biol, 2010, 55(14): 4169-4185.
[39]WANG Z T, HAUSER N, KUBIK-HUCH R A, et al. Quantitative volumetric breast density estimation using phase contrast mammography [J]. Phys Med Biol, 2015, 60(10): 4123-4135.
[40]SCHLEEDE S, BECH M, GRANDLET S, et al. X-ray phase-contrast tomosynthesis for improved breast tissue discrimination [J]. Euro J Radiol, 2014, 83(3): 531-536.
[41]GRANDL S, WILLNER M, HERZEN J, et al. Evaluation of phase-contrast CT of breast tissue at conventional X-ray sources-presentation of selected findings [J]. Z Med Phys, 2013, 23(3): 212-221.
[42]PANI S, LONGO R, DREOSSIET D, et al. Breast tomography with synchrotron radiation: preliminary results [J]. Phys Med Biol, 2004, 49(9): 1739-1754.
[43]SZTRóKAY A, DIEMOZ P C, SCHLOSSBAUERET T, et al. High-resolution breast tomography at high energy: a feasibility study of phase contrast imaging on a whole breast [J]. Phys Med Biol, 2012, 57(10): 2931-2942.
[44]GRANDL, SCHERER K, SZTROKAY-GAULET A, et al. Improved visualization of breast cancer features in multifocal carcinoma using phase-contrast and dark-field mammography: an ex vivo study [J]. Eur Radiol, 2015, 89(5): 745-750.
[45]ZHAO Y Z, BRUN E, COAN P, et al. High-resolution,low-dose phase contrast X-ray tomography for 3D diagnosis of human breast cancers [J]. Proc Natl Acad Sci USA, 2012, 109(45): 18290-18294
[46]HAKA A S, SHAFER-PELTIER K E, FITZMAURICE MET, et al. Identifying microcalcifications in benign and malignant breast lesions by probing differences in their chemical composition using Raman spectroscopy [J]. Cancer Res, 2002, 62(18): 5375-5380.
[47]FRAPPART L, REMY I, LINET H C, et al. Different types of microcalcifications observed in breast pathology. Correlations with histopathological diagnosis and radiological examination of operative specimens [J]. Virchows Arch A Pathol Anat Histopathol, 1986, 410(3): 179-187.
[48]BAKER R, ROGERS K D, SHEPHERDET N, et al. New relationships between breast microcalcifications and cancer [J]. Br J Cancer, 2010, 103(7): 1034-1039.
[49]WANG Z, HAUSER N, SINGER G, et al. Noninvasive classification of microcalcifications with phasecontrast X-ray mammography [J]. Nat Commun, 2014, 55(4): 456-459.
[50]ZHU P P, ZHANG K, WANG Z L, et al. Low-dose, simple, and fast grating-based X-ray phase-contrast imaging [J]. Proc Natl Acad Sci USA, 2010, 107(31): 13576-13581.
[51]MARATHE S, ASSOUFID L, XIAO X, et al. Improved algorithm for processing grating-based phase contrast interferometry image sets [J]. Rev Sci Instr, 2014, 85(1): 13704.
[52]OLIVO A, GKOUMAS S, ENDRIZZIET M, et al. Low-dose phase contrast mammography with conventional x-ray sources [J]. Med Phys, 2013, 40(9): 90701.
[53]SOHN E. Screening: Don’t look now [J]. Nature, 2015, 527(7578): S118-S119.
[54]FANCELLU A, TURNER R M, DIXONET J M, et al. Meta-analysis of the effect of preoperative breast MRI on the surgical management of ductal carcinoma in situ [J]. Br J Surg, 2015, 102(8): 883-893.
[55]VAN GOETHEM M, TJALMA W, SCHELFOUTET K, et al. Magnetic resonance imaging in breast cancer [J]. Eur J Surg Onco, 2006, 32(9): 901-910.
[56]GURPREET S D, BELL N, GINAT D T, et al. Breast MR imaging: what the radiologist needs to know [J]. J Clin Imaging Sci, 2011, 16(3): 45-52.
[57]MARGENTHALER J A. Magnetic resonance imaging in patients with ductal carcinoma in situ: routine, selective, or not at all? [J]. Ann Surg Oncol, 2014, 21(5): 1510-1511.
[58]HOUSSAMI N, TURNER R, MACASKILLET P, et al. An individual person data meta-analysis of preoperative magnetic resonance imaging and breast cancer recurrence [J]. J Clin Oncol, 2014, 32(5): 392-401.
Breast X-ray phase contrast imaging
WANG Shengping, PENG Weijun (Department of Radiology, Fudan UniversityShanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
PENG Weijun E-mail: cjr.pengweijun@vip.163.com
Breast cancer constitutes about 25% of all cancers and is the leading cause of cancer death among females. In order to reduce breast cancer mortality, mammography screening programmes have been implemented in many countries. However, these programmes are still controversial, due to the radiation exposure and the unsatisfactory diagnostic accuracy related to mammography. X-ray phase contrast imaging technology is a new imaging method sensitive to refraction generated by X-ray transmitted through the object. Phase contrast imaging has been shown to have excellent soft tissue contrast and can significantly improve cancerous tissue visualization, especially for weak absorbing material. Therefore, breast X-ray phase contrast imaging may significantly promote the early diagnosis of breast cancer. Studies have shown that breast phase contrast CT can clearly show the fine structures of breast tissue, which can often only be observed by histological examination. This implies that the breast X-ray phase contrast imaging may lead the development trend of the new imaging applications. In this review, we briefly overview the phase contrast imaging on the physical theory and several information acquisition methods, and introduce the recent development of breast X-ray phase contrast imaging and its clinical application.
Breast; X-ray; Phase contrast imaging
(收稿日期:2015-08-30 修回日期:2015-12-02)
R445.4
A
1008-617X(2015)04-0308-09
彭卫军 E-mail:cjr.pengweijun@vip.163.com

