紫山药花色苷生物酶法提取工艺优化研究
霍艳荣 高前欣 王振宇

摘要 [目的]优化紫山药花色苷生物酶法提取工艺。[方法]选择纤维素酶及果胶酶对紫山药花色苷的提取效果进行对比分析,对纤维素酶法提取紫山药花色苷的工艺进行优化,选用酶用量、时间、温度、料液比进行4因素3水平的正交试验。[结果]试验表明,纤维素酶能显著提高花色苷得率。正交试验结果表明,最佳提取方案为:提取温度50 ℃,提取时间60 min,酶用量2.0%,料液比1∶15 g/ml。[结论]研究可为紫山药花色苷的提取应用提供参考依据。
关键词:紫山药;花色苷;提取工艺;生物酶法
中图分类号:S632.1 文献标识码 A 文章编号 0517-6611(2015)08-253-02
紫山药富含多糖、黏液质、蛋白质、淀粉、多种氨基酸及矿物元素,具有多种功能性组分如薯蓣皂苷、尿囊素、多酚、植物固醇、花青素等[1-3]。紫山药的营养成分及主要功能组分含量与怀山药基本一致[4-5]。
花色苷是花色素与各种糖结合而形成的黄酮多酚类化合物。花色苷具有抗氧化活性,这种活性使其在预防一些神经性心血管方面疾病以及癌症、糖尿病等方面具有非常关键的作用[6-7]。花色苷在食品工业中应用较多,它是水溶性的物质,可以从葡萄、紫甘蓝、红萝卜、郁金香等果蔬及植物中提取获得。因为花色苷是具有维管束植物中的最重要的色素,而这些色素使一些果蔬和植物展现出鲜亮的橘色、红色及蓝色等,易与水溶性介质混合,因此可以作为天然的水溶性色素应用于食品中。
1 材料与方法
1.1 材料
1.1.1 原料。紫山药,收获于浙江农林大学实验基地。
1.1.2 试剂。纤维素酶(6万U/g)、果胶酶(80万U/g),购于张家港市金源生物化工有限公司;柠檬酸、氢氧化钠、缓冲溶液,均为分析纯。
1.1.3 仪器与设备。
紫外可见分光光度计,北京普析通用仪器有限责任公司;pHS-2C型精密酸度计,上海精密科学仪器有限公司;大容量低速离心机,上海安亭科学仪器厂;HH-4数显恒温水浴锅,国华电器有限公司;JJ300型精密电子天平,美国双杰兄弟(集团)有限公司;精密电子分析天平,梅特勒-托利多仪器(上海)有限公司;DGG-9053AD型电热恒温鼓风干燥箱,上海森信实验仪器有限公司。
1.2 方法
1.2.1 紫山药花色苷酶法提取工艺流程。
新鲜紫山药样品→清洗→去皮→切片→护色(1%柠檬酸溶液)→干燥→粉碎→加酶→溶剂浸提→离心→测吸光度值。
1.2.2 紫山药预处理。
将新鲜紫山药洗净,去皮,切片,护色,烘干,粉碎,过80目筛,紫山药粉末装入自封袋中密封避光保存。
1.2.3 酶法提取紫山药花色苷的单因素试验。
在其他条件不变的情况下,分别考察酶解提取加酶量、酶解时间、酶解温度、料液比及pH对提取效果的影响,根据提取液色价大小确定最佳提取条件。
1.2.3.1 酶用量对提取效果的影响。
称取紫山药粉末2.0 g,加入30 ml蒸馏水摇匀,分别加入0、0.5%、1.0%、1.5%、2.0%、2.5%的2种酶,45 ℃浸提45 min,离心15 min,取上清液测定吸光度,并计算花色苷溶液的色价,根据色价大小确定最佳酶用量。
1.2.3.2 酶解时间对提取效果的影响。
称取紫山药粉末2.0 g,加入30 ml蒸馏水摇匀,分别加入30 mg 2种酶,45 ℃分别浸提15、30、45、60、75、90 min,离心15 min,取上清液测定吸光度,计算花色苷溶液的色价,根据色价大小确定最佳提取时间。
1.2.3.3 酶解温度对提取效果的影响。称取紫山药粉末2.0 g,加入30 ml蒸馏水摇匀,分别加入30 mg 2种酶,分别于25、30、35、40、45、50 ℃浸提45 min,离心15 min,取上清液,测定吸光度,并计算花色苷溶液的色价,根据色价大小确定最佳提取温度。
1.2.3.4 料液比对提取效果的影响。
称取紫山药粉末2.0 g,按料液比1∶10、1∶15、1∶20、1∶25、1∶30 g/ml与蒸馏水摇匀,分别加入30 mg 2种酶,45 ℃浸提45 min,离心15 min,取上清液测定吸光度,并计算花色苷溶液的色价,根据色价大小确定最佳料液比。
1.2.3.5 pH对提取效果的影响。
称取紫山药粉末2.0 g,加入30 ml蒸馏水摇匀,调pH至3.5、4.0、4.5、5.0、5.5、6.0、6.5,分别加入30 mg 2种酶,45 ℃的恒温水浴锅中浸提45 min,离心15 min,取上清液测定吸光度,并计算花色苷溶液的色价,根据色价大小确定最佳pH。
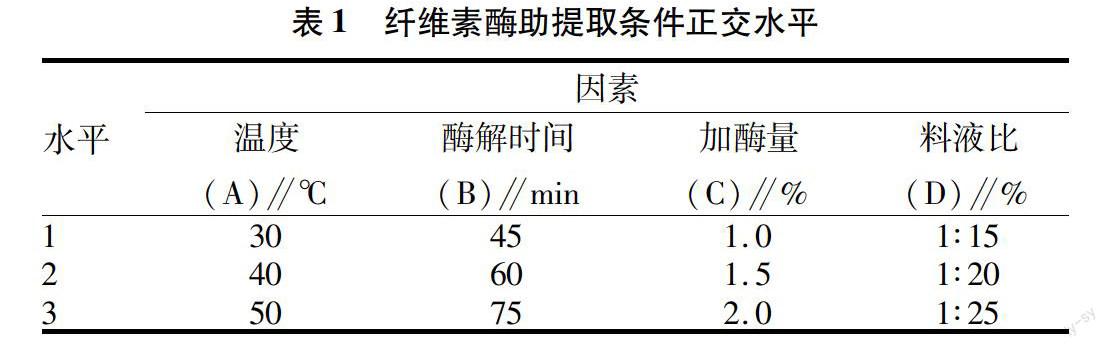
1.2.4 纤维素酶对紫山药花色苷最佳提取条件的确定。根据单因素的结果,以酶用量、提取时间、提取温度和料液比为影响因素,设计L9(34)正交试验,试验安排如表1所示。
1.2.5 紫山药含量的检测。
在波长535 nm下对花色苷溶液进行吸光度检测(以蒸馏水做空白),并计算色价。色价计算式:
E1%1cm=AV/W
式中,E1%1cm,色价;A,提取液吸光度;V,提取液的总体积(ml);W,固体样品的质量(g)。当V=100 ml,W=1 g时,将公式简化为E1%1cm=A。
2 结果与分析
2.1 酶用量对紫山药花色苷提取效果的影响 由图1可知,在一定酶用量范围内,随着酶用量的增加,吸光度值也随着升高,这主要是由于底物浓度一定时,酶的浓度较低时,酶解进行的不完全,酶促反应速度与酶的初始浓度成正比,即随着酶用量的增加而增加。当酶用量与底物结合达到平衡时,吸光度值达到最大,酶用量继续增加时,吸光度值有所降低。得率最大时纤维素酶的用量比果胶酶少,且纤维素酶的得率比果胶酶大。
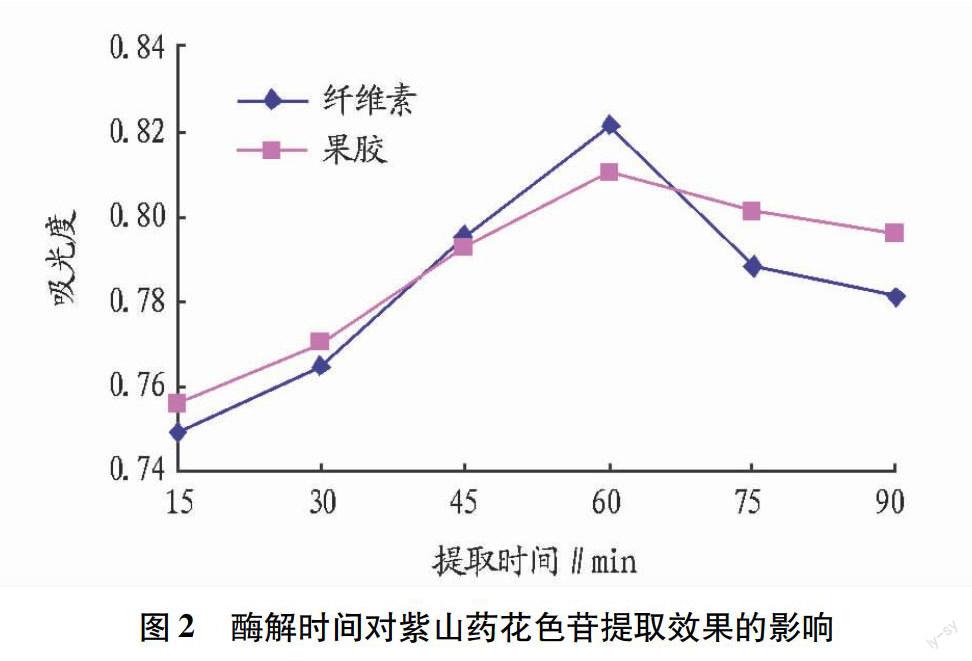
2.2 酶解时间对紫山药花色苷提取效果的影响 由图2可知,随着提取时间的延长,吸光度值增大,说明提取的得率增加,当达到60 min时,吸光度达到最大值,且纤维素酶的得率比果胶酶大。60 min以后,吸光度值开始降低,这可能是由于时间延长使得色素有所分解。
2.3 酶解温度对紫山药花色苷提取效果的影响 由图3可知,在一定温度范围内,随着温度的升高,吸光度增大,这主要是因为温度升高使酶的活性增强,从而促进细胞壁的分解,加速可溶性物质的扩散和溶出,促进色素的浸出。当温度分别达到40、50 ℃时,纤维素酶、果胶酶分别达到酶的最适反应温度,因此吸光度达到最大值;温度继续升高,吸光度值开始降低,主要原因是由于酶的活性有所降低,并且温度升高会导致紫山药花色苷的分解。取得最大值时,纤维素酶的温度比果胶酶低,且纤维素酶的最大值比果胶酶大。
2.4 料液比对紫山药花色苷提取效果的影响 由图4可知,随着料液比中溶剂用量的增加,吸光度值下降,花色苷的提取量降低,这主要是因为料液比中溶剂用量增加,酶的浓度随之降低,提取率下降。
2.5 pH对紫山药花色苷提取效果的影响 由图5可知,在酸性条件下,随着pH的增大,吸光度值也增大,这主要是因为色素在不同的pH条件下会发生颜色的改变,pH在3.5时,颜色为偏粉红色,pH为5.0时,颜色为紫红色,pH到达6.5时,颜色为紫色。因此吸光度值的增大主要是色素色泽的影响,无法辨别得率的大小。
2.6 纤维素酶法提取紫山药花色苷的正交试验结果与分析 由正交试验结果可知(表2),影响紫山药花色苷提取效果因素顺序为:C>B>A>D,即先后顺序为酶用量、提取时间、提取温度、料液比。纤维素酶助提取最佳条件为:A3B2C3D1,即酶解提取温度为50 ℃,提取时间为60 min,酶用量为2.0%,料液比为1∶15 g/ml。
3 结论
紫山药中淀粉及果胶的存在会影响花色苷的溶出,因此选用纤维素酶和果胶酶进行研究。试验结果表明,纤维素酶对花色苷的提取效果较显著。通过正交试验得出,纤维素酶酶解提取紫山药花色苷最佳提取条件为:酶用量2.0%,提取时间60 min,提取温度50 ℃,料液比1∶15 g/ml。
参考文献
[1] 梁小娟,杜伟锋,张云,等.参薯研究进展[J].中华中医药学刊,2011,28(5):1085-1087.
[2] 杭悦宇.我国山药类药材对动物降血糖和降血脂的作用[J].植物资源与环境,1994(3):59-60.
[3] 刘影,史姗姗,汪财生.浙江紫山药营养成分及薯蓣皂苷元含量测定[J].安徽农业科学,2010,38(9):4563-4564,4567.
[4] 于东,林跃伟,陈桂星,等.紫山药营养成分分析研究[J].营养学报,2010,32(2):190-192.
[5] 周新勇,宋曙辉,王文琪,等.紫参薯及其同属植物铁杆山药中营养成分分析[J].安徽农业科学,2010,38(35):20005-20007.
[6] KONCZAK I,ZHANG W.Anthocyanins-more than natures colours[J].Journal of Biomedicine and Biotechnology, 2004(5):239-240.
[7] YEH Y H,LEE Y T,HWANG D F.Yam(Dioscoreaalata) inhibits hyperterglyceri-demia and liver enlargement in rats with hypercholesterol diet[J].J Chin Med,2007, 18(1/2): 65-74.

