兔骨关节炎模型中Wnt/β—catenin信号通路研究
刘洪彦 郑毅

【摘 要】目的:探讨兔骨关节炎软骨细胞中Wnt/β-catenin信号通路的表达情况及其在骨关节炎中的作用。方法:采用改良伸直位固定法制作兔骨关节炎模型,分阶段酶消化法分离正常软骨细胞和骨关节炎软骨细胞。采用ELISA法检测正常软骨细胞和骨关节炎软骨细胞中β连环蛋白(β-catenin)、基质金属蛋白酶-3(MMP-3)、基质金属蛋白酶-13(MMP-13)、带有血小板凝血酶敏感蛋白样模体的解整链蛋白金属蛋白酶-4(ADAMTS-4)、Ⅱ型胶原、蛋白聚糖、白细胞介素(IL)-1β、IL-18和IL-33的水平。結果:与正常对照组比较,骨关节炎组β-catenin、MMP-3、MMP-13、ADAMTS-4的蛋白水平均明显升高,
Ⅱ型胶原和蛋白聚糖基因的蛋白水平均明显下降,差异有统计学意义(P < 0.05)。与正常对照组比较,骨关节炎组IL-1β、IL-18和IL-33蛋白水平差异无统计学意义(P > 0.05)。结论:兔骨关节炎中Wnt/β-catenin信号通路明显激活,介导软骨细胞外基质分解代谢、促进软骨破坏,而炎性因子IL-1β、IL-18和IL-33可能在此过程中并未起到关键作用。
【关键词】 骨关节炎;Wnt/β-catenin信号通路;基质代谢;基质金属蛋白酶;白细胞介素;兔
doi:10.3969/j.issn.2095-4174.2015.09.001
A Study on Wnt/β-catenin Signal Pathway in Rabbit Models with Osteoarthritis
LIU Hong-yan,ZHENG Yi
【ABSTRACT】Objective:To investigate the expression of Wnt/ β-catenin pathway and its role in rabbits with osteoarthritis.Methods:Rabbit models with osteoarthritis were established with Modified Extension-fixation Method,and normal and osteoarthritis chondrocytes were isolated by enzyme digestion.ELISA method was used to detect the levels of β-catenin,MMP-3,MMP-13,ADAMTS-4,type II collagen,proteoglycan,IL-1β,IL-18 and IL-33
in normal and osteoarthritis chondrocytes.Results:Compared with the normal control group,the protein levels of β-catenin,MMP-3,MMP-13 and ADAMTS-4 in the osteoarthritis were significantly increased,while the protein levels of type II collagen and proteoglycan were significantly decreased,the difference being statistically significant (P < 0.05).Compared with the normal control group,the differences of the protein levels of IL-1β,IL-18 and IL-33 had no significant difference (P > 0.05).Conclusion:The Wnt/β-catenin signal pathway in rabbits with osteoarthritis has been activated,which can mediate cartilage matrix and promote cartilage destruction,while the inflammatory factor IL-1β,IL-18 and IL-33 may not play a key role in the process.
【Keywords】osteoarthritis;Wnt/β-catenin signal pathway;matrix metabolism;matrix metalloproteinases;interleukin;rabbit
骨关节炎(osteoarthritis,OA)作为最常见的骨关节疾病,是导致中老年人慢性肌肉骨骼疼痛和活动障碍的最主要原因,但其发病机制仍不清楚。通过基因敲除的OA动物模型证实,主要由滑膜细胞分泌的促炎细胞因子如前列腺素、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1、IL-6、一氧化氮(NO)等在OA的病理过程中并未起到关键作用[1]。而一些动物实验研究则表明,基质金属蛋白酶(MMPs)、聚蛋白多糖酶(aggrecanases)等蛋白酶对关节软骨主要基质成分Ⅱ型胶原以及蛋白多糖的降解,是导致OA 产生的主要原因[2]。但是,这些蛋白酶的特异抑制剂在治疗OA过程中的疗效却并不尽如人意,且具有较为严重的不良反应[3]。
因此,对软骨细胞中这些蛋白酶的上游信号通路——Wnt 信号通路的研究,已成为新的热点。
1 实验材料
1.1 实验动物 6月龄健康普通级新西兰大耳兔16只,雄性,体质量2~2.5 kg,复合饲料喂养,北京房山动物养殖厂提供,动物合格证号SYZK(京)2012-0016。
1.2 实验试剂 DMEM-F12细胞培养液(美国Hyclone公司);胎牛血清(哈尔滨元亨生物药业有限公司);兔β-catenin、MMP-3、MMP-13、ADAMTS-4、Ⅱ型胶原、蛋白聚糖、IL-1β、IL-18、
IL-33 ELISA试剂盒(武汉华美生物工程有限公
司);抗Ⅱ型胶原抗体(北京博奥森生物有限
公司)。
2 方 法
2.1 造模及模型鉴定 适应性喂养1周后,随机分为OA组和正常对照组,每组8只。正常对照组不做处理。OA组参照文献[4]方法并进行改良造模,具体方法如下:将兔毛剪短至0.5 cm左右,左后肢膝关节完全屈曲,用管型石膏将其固定于过屈位,长度从髋关节远端约2 cm至踝关节上缘
2 cm,石膏干硬前在石膏外面缠以细铁丝,待石膏干硬后放回兔笼。造模过程中观察家兔一般状态、双腿的活动情况、造模肢体改变等。若发现有肢端明显肿胀、张力性水泡或溃烂感染及石膏松脱、咬损严重等现象,则立即卸掉重打。造模7周后通过膝关节X线摄影进行影像学成模鉴定。同时处死家兔,无菌条件下取造模膝关节软骨组织,制作石蜡标本进行甲苯胺蓝染色,进行病理学成模鉴定。
2.2 软骨细胞分离培养及鉴定 正常对照组和OA组家兔处死后,无菌条件下分别取膝关节软骨细胞,采用分阶段酶消化法分离软骨细胞,用质量分数为20%FBS的DMEM-F12,37 ℃,体积分数为5%的CO2进行原代培養及传代培养。取二代软骨细胞进行爬片,行甲苯胺蓝染色和Ⅱ型胶原免疫组织化学染色鉴定软骨细胞。
2.3 蛋白水平检测 取二代正常软骨细胞和OA软骨细胞进行培养,48 h后取细胞上清液进行ELISA法检测Wnt/β-catenin信号通路相关因子(β-catenin、MMP-3、MMP-13、ADAMTS-4)、软骨基质成分(Ⅱ型胶原、蛋白聚糖),以及炎性介质(IL-1β、IL-18、IL-33)等蛋白水平。具体方法参照ELISA试剂盒要求。
2.4 统计学方法 采用SPSS 17.0软件进行统计分析。计量资料以表示,采用t检验。以
P < 0.05为差异有统计学意义。
3 结 果
3.1 模型鉴定
3.1.1 影像学鉴定 正常对照组关节表面光滑,无骨赘形成,关节间隙正常。OA组可见表面模糊,有骨赘形成,关节间隙狭窄。见图1。
(1)正常对照组 (2)OA组
图1 正常对照组及OA组膝关节影像学特点
3.1.2 病理学鉴定 正常对照组膝关节软骨切片显示关节面平整,潮线完好,细胞形态正常、排列整齐,基质均匀。OA组可见潮线消失、软骨细胞聚集、变形、基质失染等。见图2。
(1)正常对照组 (2)OA组
图2 兔膝关节软骨病理学特点(甲苯胺蓝染色×200)
3.2 软骨细胞鉴定
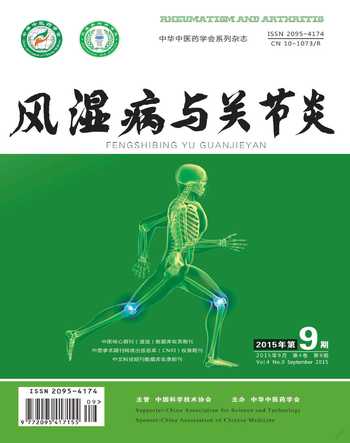
3.2.1 甲苯胺蓝染色 软骨细胞经甲苯胺蓝染色后,细胞质染成浅蓝色,细胞核染成深蓝色,可见1~2个核仁。见图3。
图3 软骨细胞甲苯胺蓝染色(×200)
3.2.2 Ⅱ型胶原免疫组化染色 软骨细胞的胞浆内出现黄染颗粒或被染成棕黄色,胞核不着色,细胞外区域也可见到棕色。见图4。
图4 软骨细胞II型胶原免疫组化染色(×100)
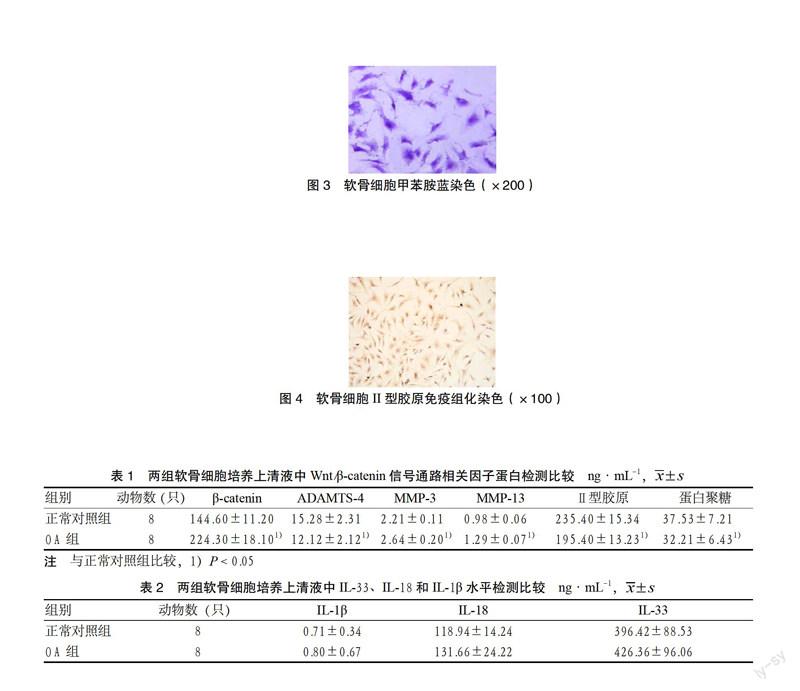
3.3 两组软骨细胞培养上清液中Wnt/β-catenin信号通路相关因子蛋白检测比较 与正常对照组比较,OA组细胞培养上清液中β-catenin、MMP-3、MMP-13、ADAMTS-4的蛋白水平均明显升高,差异有统计学意义(P < 0.05);Ⅱ型胶原和蛋白聚糖基因的蛋白水平均明显下降,差异有统计学意义(P < 0.05)。见表1。
3.4 两组软骨细胞培养上清液中IL-33、IL-18和IL-1β水平检测比较 与正常对照组比较,OA组细胞培养上清液中IL-1β和IL-18、IL-33蛋白水平差异无统计学意义(P > 0.05)。见表2。
4 讨 论
Wnt信号转导途径作为一个庞大而复杂的信号转导系统,与骨骼发育有关,还与骨组织细胞分化、生长、凋亡、死亡、骨量调节等多个病理生理过程有关。近年研究发现,Wnt信号通路的异常使骨骼系统代谢失衡,可导致OA的发生[4]。Wnt信号途径有3条胞内转导途径,分别是Wnt/β-catenin通路、Wnt/Ca2+通路、Wnt/PCP通路。Wnt/β-catenin信号通路是最经典且研究较多的信号通路。
目前认为,Wnt/β-catenin信号通路主要途径如下:Wnt蛋白结合受体复合物,受体复合物包括低密度脂蛋白受体相关蛋白和Frizzled蛋白。它们结合后通过G蛋白偶联受体信号转导方式将信号导入胞内,抑制糖原合成酶-3β。在没有Wnt信号的情况下,糖原合成酶-3β磷酸化β-catenin降解。β-catenin表达主要位于细胞膜,胞浆内很少。存在Wnt信号时,β-catenin在细胞浆中积累,累积到一定量即进入核内与Lef/Tcf结合激活靶基因转录。且认为,Wnt/β-catenin信号通路的靶基因包括参与细胞增殖、凋亡、炎症和基质代谢的基因,其中包括MMPs(如MMP-3、MMP-13)和aggrecanases(如ADAMTS-4)等。
OA被公认为是机械性和生物性因素作用的结果,破坏了关节软骨、细胞外基质和软骨下骨正常合成和降解偶联的结果。关节软骨退变的一个重要表现是细胞外基质(包括II型胶原和蛋白聚糖)代谢功能障碍。Ⅱ型胶原的代谢平衡是通过MMPs和金属蛋白酶组织抑制剂(TIMPs)的调节来实现的,而蛋白聚糖主要依靠aggrecanases来实现,
aggrecanases屬于ADAMTS家族。MMPs能够降解软骨基质的所有成分,MMP-1、MMP-2、MMP-3、
MMP-7、MMP-9、MMP-13均发挥此作用;研究发现,MMP-1、MMP-8、MMP-13能够高效降解胶原纤维Ⅰ、Ⅱ、Ⅲ,其中MMP-13是促进基质降解的关键酶,由于其对Ⅱ型胶原有优先消化作用,而ADAMTS-4和ADAMTS-5可促进蛋白聚糖的分解代谢。
研究发现,Wnt/β-catenin信号通路可通过调控MMPs发挥对软骨基质的作用。Zhu等[5]发现,β-catenin的激活可导致MMPs的明显增加,引起软骨细胞外基质降解、软骨破坏。Shortkroff等[6]在体外培养软骨细胞并激活其中Wnt/β-catenin信号通路的表达,发现氨基葡聚糖含量显著降低,仅为对照组的16%,细胞外基质合成明显减少。Yuasa等[7]用Wnt3A培养或转入表达β-catenin可活化软骨细胞MMP-3、MMP-13、ADAMTS-4/-5蛋白酶的基因表达,引起细胞外基质的降解。
本实验研究发现,OA软骨中β-catenin表达明显增加,Wnt/β-catenin信号通路激活,同时MMP-3、
MMP-13及ADAMTS-4表达明显升高,而Ⅱ型胶原和蛋白聚糖表达下降。这提示兔OA中Wnt/β-catenin信号通路激活,而Wnt/β-catenin信号通路可通过调控MMPs和ADAMTS发挥对软骨基质的作用。这与目前国内外研究是一致的。Ryu等[8]发现,在OA退变的软骨细胞中β-catenin大量聚集,软骨细胞正常形态丢失并且异常分化。Fang等[9]
在人软骨组织中也发现了β-catenin的高表达。笔者收集了40例行全膝关节置换术的OA患者和10例
股骨髁骨折和截肢患者的关节软骨,结果发现,正常关节软骨中β-catenin很少表达,但在退变软骨中则大量表达,而且中度到重度的退变软骨高于轻度退变的软骨。
OA的炎症介质(如IL、PG、TNF-α、NO等)在OA发病中也发挥了重要作用。IL-1可促进多种炎性因子的分泌,也是软骨基质降解的主要驱动因子,可促进软骨降解酶类的合成与分泌,导致软骨的损伤。IL-18、IL-33具有和IL-1相似的促炎反应。而本实验以兔膝OA软骨细胞进行实验,结果显示,IL-1β、IL-18和IL-33在OA中水平较正常软骨细胞升高,但差异无统计学意义(P > 0.05),而同时MMPs和ADAMTs水平明显升高,Ⅱ型胶原和蛋白聚糖水平明显下降。这提示在IL-1、IL-18、IL-33等炎性因子无明显升高时,仍有明显的软骨基质破坏,表明上述炎性因子在软骨破坏过程中并未起到关键作用,这与国外研究一致。Clements等[1]对OA小鼠模型的IL-1β基因进行敲除,结果发现,与野生型小鼠相比,基因敲除小鼠出现快速进展的软骨破坏,表现为MMPs和ADAMTs的显著增加,Ⅱ型胶原和蛋白聚糖的明显降低,提示在无IL-1β的作用下,OA软骨基质仍有明显破坏,IL-1β并未在OA软骨破坏中发挥关键作用。
综上所述,兔OA中Wnt/β-catenin信号通路明显激活,介导软骨细胞外基质代谢,导致软骨的破坏;而炎性因子IL-1、IL-18、IL-33在软骨破坏过程中并未起到关键作用。
5 参考文献
[1] Clements KM,Price JS,Chambers MG,et al.Gene deletion of either interleukin-1beta,interleukin-1beta-converting enzyme,inducible nitric oxide synthase,or stromelysin 1 accelerates the development of knee osteoarthritis in mice after surgical transection of the medial collateral ligament and partial medial meniscectomy[J].Arthritis Rheum,2003,48(12):3452-3463.
[2] Little CB,Meeker CT,Golub SB,et al.Blocking aggrecanase cleavage in the aggrecan interglobular domain abrogates cartilage erosion and promotes cartilage
repair[J].J Clin Invest,2007,117(6):1627-1636.
[3] Burrage PS,Brinckerhoff CE.Molecular targets in osteoarthritis:metalloproteinases and their inhibitors[J].Curr Drug Targets,2007,8(2):293-303.
[4] Wu Q,Zhu M,Rosier RN,et al.Bate-catenin,cartilage,
and osteoarthritis[J].Ann N Y Acad Sci,2010,1192(1):344-350.
[5] Zhu M,Tang D,Wu Q,et al.Activation of beta-catenin signaling in articular chondrocytes leads to osteoarthritis-like phenotype in adult beta-catenin conditional activation mice[J].J Bone Miner Res,2009,24(1):12-21.
[6] Shortkroff S,Yates KE.Alteration of matrix glycosaminoglycans diminishes articular chrondrocytes' response to a canonical Wnt signal[J].Osteoarthritis Cartilage,2007,15(2):147-154.
[7] Yuasa T,Otani T,Koike T,et al.Wnt/beta-catenin signaling stimulates matrix catabolic genes and activity in articular chondrocytes:its possible role in joint degeneration[J].Lab Invest,2008,88(3):264-274.
[8] Ryu JH,Kim SJ,Kim SH,et al.Regulation of the chondrocyte phenotype by beta-catenin[J].Development,2002,129(23):5541-5550.
[9] Fang X,Shi X,Gao Z,et al.Expression of beta-catenin in articular cartilage of knee primary osteoarthritis[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2012,26(5):532-535.
收稿日期:2015-06-11;修回日期:2015-07-04