磁性海泡石的制备及其对次甲基蓝的吸附性能
马玉书,李计元,赵海英,朱骏峰,王长平
(天津城建大学材料科学与工程学院,天津 300384)
磁性海泡石的制备及其对次甲基蓝的吸附性能
马玉书,李计元,赵海英,朱骏峰,王长平
(天津城建大学材料科学与工程学院,天津 300384)
摘 要:以酸改性海泡石为载体采用化学共沉淀法制备了具有良好吸附性能的磁性海泡石。利用XRD和FTIR对磁性海泡石进行表征。结果表明,磁核Fe3O4以静电力固载于海泡石纤维表面。以磁性海泡石为吸附剂,对次甲基蓝的吸附研究可知,磁性海泡石对次甲基蓝的吸附符合Langumir等温吸附方程式,吸附焓变和熵变分别为1.048 KJ/mol和12.502 J/(mol·K),吸附表现为自发的物理吸附过程且吸热,并遵循准二级动力学方程。
关键词:磁性海泡石;吸附;次甲基蓝;Langumir;吸热;动力学
E-mail:chengjianyushu@163.com
0 引 言
海泡石是一种纤维状镁硅酸盐矿物,结构通式为:Si12O30Mg8(OH)4(H2O)4·8H2O。其结构为两层硅氧四面体中间夹一层镁氧八面体形成的2∶1型层链状结构[1, 2]。四面体分布在同一个平面内,彼此以三个角顶相连。四面体的中心是一个四价的硅,四个二价的氧分布于四面体的四个顶角上。八面体由六个氧原子或氢氧根离子以等距排列而成,或“位居”中心。同样,八面体也排列成层状结构,成为八面体片层。海泡石的孔道与c轴平行,孔道尺寸为0.36×1.06 nm,沸石水和可交换的阳离子即位于孔道中,位于八面体边缘的Mg2+连接2个配位水[3-5]。海泡石独特的晶体结构使其呈现出很强的表面活性和良好的吸附性能。因此,海泡石在污水治理和功能陶瓷等领域有广泛应用报道[6-13]。然而,由于海泡石颗粒细小,作为吸附剂处理废水时很难与作用体系分离。近年来,研究者结合粘土矿物的强吸附性和磁性氧化铁的电磁性能,已制备出不同特性的磁性吸附剂[14-17]。磁性氧化铁的载体主要有膨润土、天然沸石、活性炭和海泡石等。袁明亮等[17]利用共沉淀法制备的磁性沸石对Pb2+、Cu2+等重金属离子的去除率均大于90%。鉴于此,实验以酸改性海泡石为载体,利用共沉淀法制备磁性海泡石。以碱性染料(Methylene blue,次甲基蓝)的水溶液为模拟废水,研究磁性海泡石对次甲基蓝的吸附效果,并从动力学和热力学角度探讨磁性海泡石对次甲基蓝的吸附机理,为海泡石在碱性染料废水治理方面的应用提供实验与理论依据。
1 实验部分
1.1海泡石提纯与酸改性
海泡石原矿由河北省井陉某公司提供,经XRD分析海泡石原矿内含有方解石、石英和滑石等杂质。石英采用重力沉降法去除,方解石采用稀盐酸酸洗的方法处理,使方解石与稀盐酸反应生成可溶性的氯化钙和二氧化碳气体,具体实验方法见文献[18]。
1.2有机海泡石制备
将2 g提纯处理后的酸改性海泡石分散于160 mL含铁离子溶液中(其中含铁离子的溶液体积比为Fe3+∶Fe2+=5∶3),置于70 ℃的恒温水浴锅中搅拌90 min,同时向混合液中滴加2 mol/L的NaOH溶液,调节混合液的pH值为11.5,停止搅拌后在恒温水浴锅中陈化120 min。然后,抽滤并用去离子水洗涤黑色沉淀物2-3次,最后置于80 ℃恒温干燥箱中干燥24 h后研磨,可得到黑色粉末状的磁性海泡石。
1.3吸附试验
以次甲基蓝为污染物配制模拟废水,取一定量模拟废水按2 g/L的比例投加磁性海泡石,磁力搅拌一定时间后取上清液于波长为660 nm处,以蒸馏水为参比样,采用日本岛津UV-vis 2550型紫外-可见分光光度计测量吸光度,计算吸附量Qt和脱色率η。公式如下:
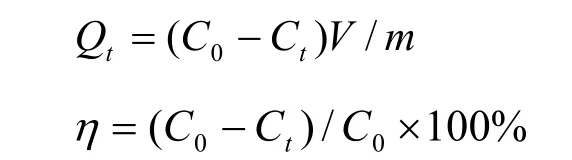
式中:C0,次甲基蓝的初始浓度(mg/L);Ct,t时刻溶液中次甲基蓝的浓度(mg/L);V,溶液的体积(L);m,磁性海泡石的用量(g)。
1.4分析表征
红外测试利用NICOLET-380型傅立叶变换红外光谱仪,实验条件:KBr压片制样,扫描波数范围4000-400 cm-1。采用日本理学RINT2000X-射线衍射仪进行物相分析,实验条件:CuKα作射线源,管电压40 KV,管电流150 mA,步长0.02 °。
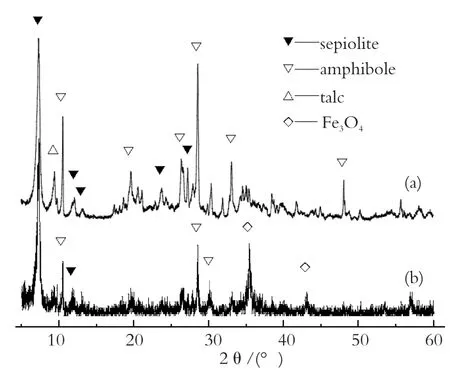
图1 海泡石试样的XRD图谱 (a)酸改性海泡石 (b)磁性海泡石Fig.1 XRD patterns of sepiolite samples:
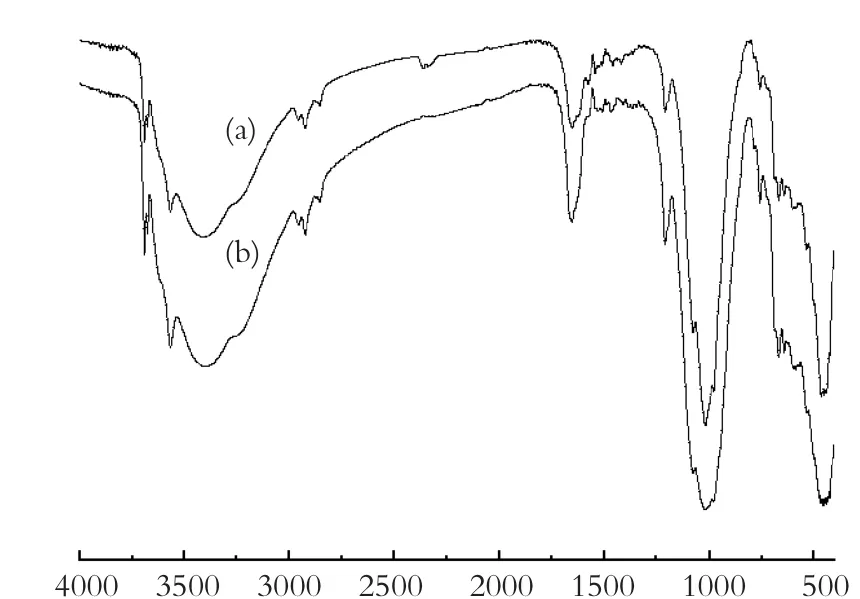
Wave number /cm-1图2 海泡石试样的FTIR图 (a)酸改性海泡石 (b)磁性海泡石Fig.2 FTIR spectra of sepiolite samples:
2 结果与讨论
2.1磁性海泡石表征
图1(a)是酸改性海泡石的XRD谱图,可知该物质的主晶相为海泡石,其(110)面的特征衍射峰位于2θ=7.4°处。从谱图中还能看出仍存在其它杂质的衍射峰,主要有闪石和滑石等,仅用盐酸并不能将杂质完全去除。磁性海泡石的XRD谱图见图1(b),可见磁性海泡石的衍射谱图中出现很多弥散相,而海泡石的衍射峰并未发生明显改变,说明试样仍旧保持海泡石的晶体结构。同时,试样中新出现位于2θ=35.37°和43.042°等处的衍射峰。该衍射峰峰形较宽、不尖锐,表明结晶性不好。经jade5.0分析此处为Fe3O4的特征衍射峰,分别对应于d=2.5356 nm和d=2.0997 nm,说明与海泡石结合的氧化铁是以Fe3O4的形式存在的,这即是磁性海泡石具有磁性的原因[17]。
图2为磁性海泡石的FTIR谱图。酸改性海泡石和磁性海泡石的峰形相似,并未出现新的红外谱峰,由此说明Fe3O4磁核和海泡石矿物表面并未形成新的化学键,可以认为形成的Fe3O4磁核主要是由静电力固载于海泡石表面[19]。
2.2磁性海泡石的吸附性与磁性
以原矿和酸改性海泡石与磁性海泡石对次甲基蓝进行吸附性能对比,实验条件:投加量为2.0 g/L,次甲基蓝浓度为100 mg/L,常温下搅拌时间120 min。图3为海泡石吸附性能对比柱状图,可以看出酸改性提高了海泡石的吸附能力,但是磁性海泡石的吸附性能(Qe=34.2 mg/L)却不及酸改性海泡石(Qe= 39.8 mg/L),这可能是由于Fe3O4磁核靠静电引力固载于海泡石纤维表面阻碍其对水相中次甲基蓝的吸附。将磁铁棒在此体系中搅拌30 s,原矿和酸改性海泡石在水相的回收率基本为零,而磁性海泡石回收率高达98.6%,由此可以证实磁性海泡石具有吸附性和磁性。
2.3吸附时间的确定
由图4可知,磁性海泡石对次甲基蓝的吸附量随吸附时间延长而增加,120 min后吸附量增加不明显,表明120 min可以达到吸附-解吸的动态平衡。
2.4吸附动力学
准一级和准二级动力学模型被广泛应用于描述固、液体系吸附动力学过程。公式描述如下:
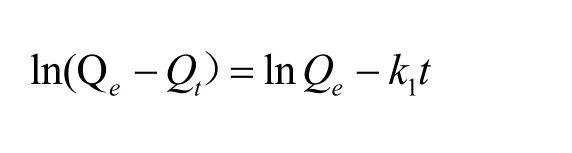
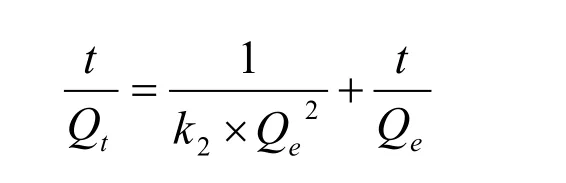
其中,Qe为平衡吸附量(mg·g-1);Qt为t时刻的吸附量(mg·g-1);k1、k2分别为准一级、准二级速率常数(mg·g-1·min-1)。不同温度下磁性海泡石对次甲基蓝的吸附量随时间的变化规律如图5所示。用以上两种动力学方程式对图5中的数据进行线性拟合,结果列于表1。对比线性相关系数,准二级动力学明显大于准一级动力学的拟合效果,所以磁性海泡石吸附次甲基蓝时准二级动力学模型比一级动力学模型有更好的回归效果。这主要是由于准一级动力学方程具有局限性,实际吸附过程是一个较复杂的物理化学过程,达到吸附平衡时间较长,因而测得的Qe值与实际平衡吸附量有偏差。因此准一级动力学只适用于吸附初始阶段的动力学描述,而不能准确地描述吸附的全过程。
2.5吸附等温线
热力学中,常用Langmuir和Freundlich吸附等温方程描述吸附行为,方程如下:
Langmuir吸附等温方程:
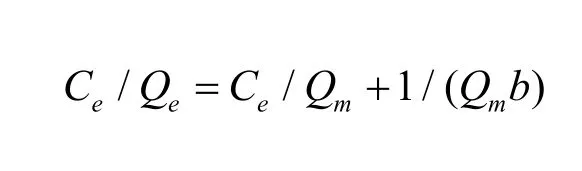
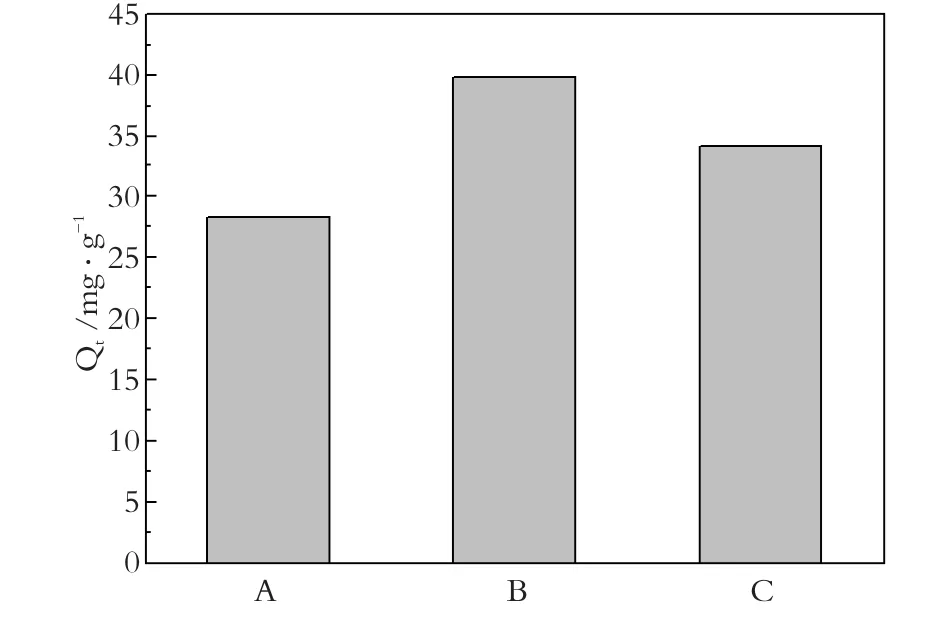
图3 原矿(A)、酸改性(B)和磁性海泡石(C)吸附量的对比结果Fig.3 Comparison result of adsorptive capacity of methylene blue onto raw (A), acid treated (B) and magnetically modified sepiolite (C)
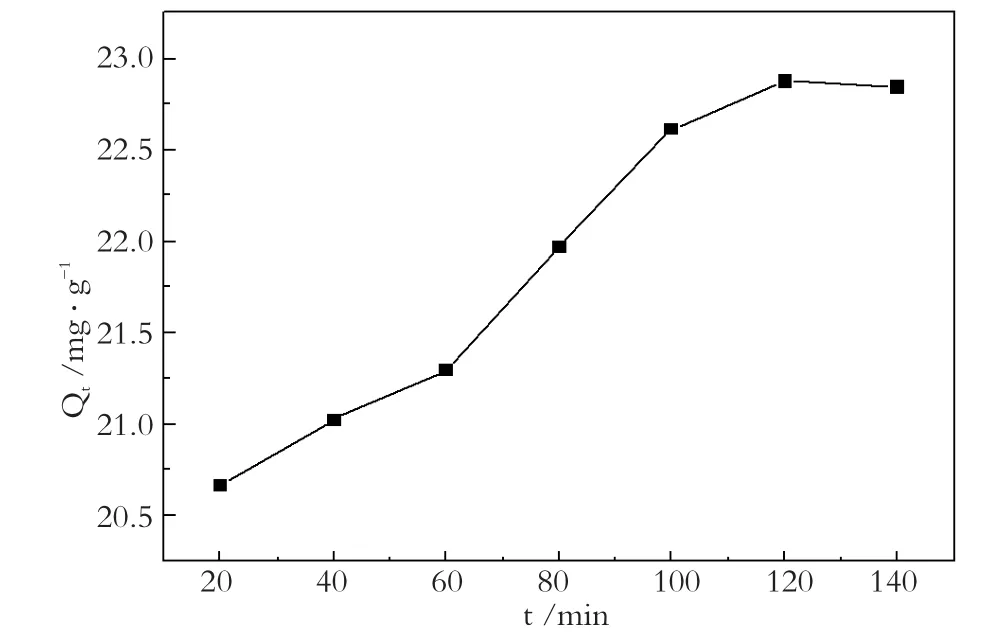
图4 吸附时间对吸附量的影响Fig.4 Effect of contact time on the adsorptive capacity
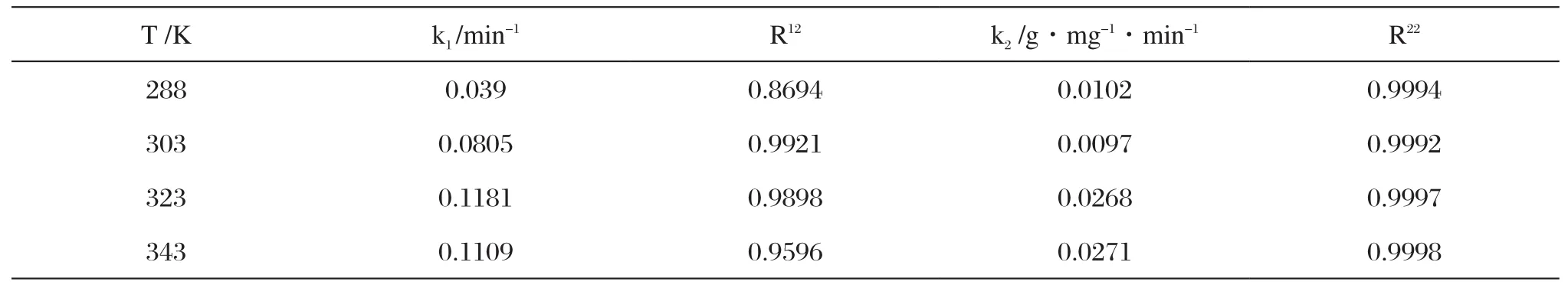
表1 次甲基蓝在磁性海泡石上的吸附动力学速率常数Tab.1 Kinetic constants of methylene blue adsorption onto magnetically modified sepiolite
Freundlich吸附等温方程:
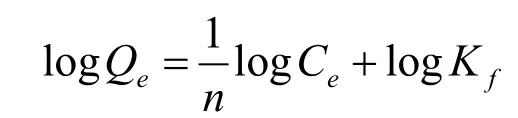
其中,C
e
为溶液的平衡浓度,mg/L;Q
e
为磁性海泡石的平衡吸附量,mg/g;Q
m
为静态饱和吸附量,mg/g;b、K
f
为吸附常数;1/n为吸附指数。
图6为磁性海泡石在不同温度下对次甲基蓝的吸附等温线。分别用Langmuir和Freundlich吸附等温方程式对实验数据进行拟合,结果如表2所示。
由表2可以看出,Langmuir吸附等温方程的线性相关系数明显大于Freundlich吸附等温方程,所以可知磁性海泡石吸附次甲基蓝更符合Langmuir吸附等温方程,静态饱和吸附量Qmax随着温度的升高而增大,说明磁性海泡石对水溶液中次甲基蓝的吸附过程为吸热过程。
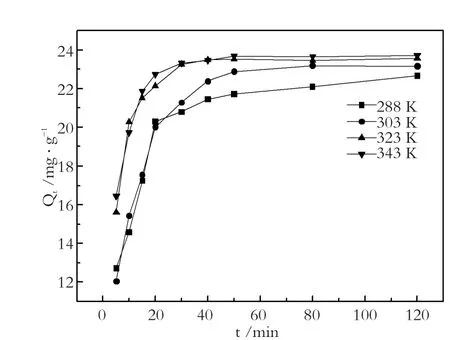
图5 吸附动力学曲线Fig.5 Curves for adsorption kinetics
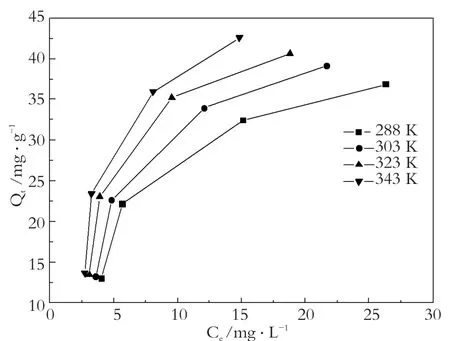
图6 不同温度下的吸附等温线Fig.6 Adsorption isotherms at different temperatures
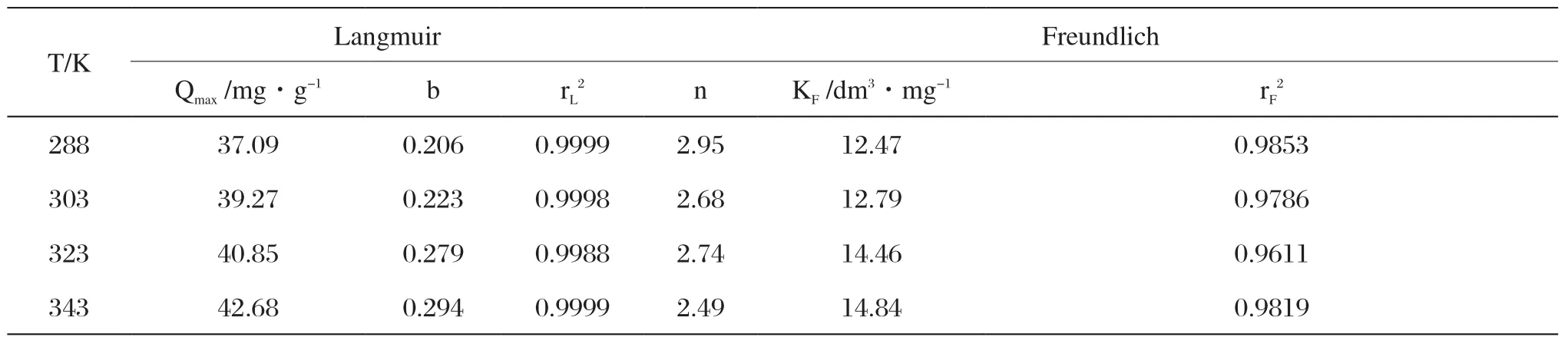
表2 磁性海泡石的等温吸附参数Tab.2 Adsorption isotherm constants for methylene blue adsorption onto magnetically modified sepiolite
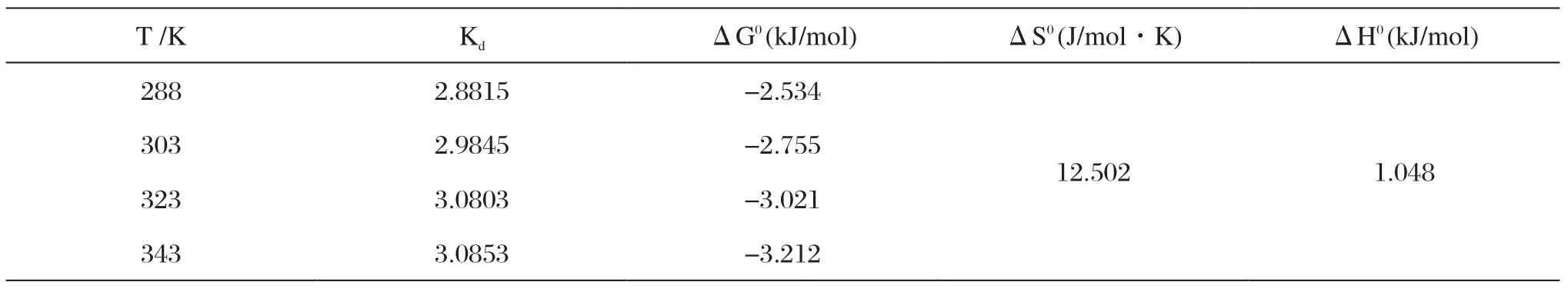
表3 热力学相关参数Tab.3 The rmodynamic constants
2.5吸附热力学函数
由热力学基本公式:ΔG0= -RT lnKd(1) ΔG0= ΔH0- TΔS0(2) lnKd= -ΔH0/RT +ΔS0/R (3)其中,Kd为吸附平衡常数;R为气体常数,8.314J/ (mol·K);T 为绝对温度(K);ΔG0为吸附自由能变(kJ/mol);ΔH0为吸附焓变(kJ/mol);ΔS0为吸附熵变[J/(mol·K)]。
热力学常数Kd可以用ln(Qe/Ce)-Qe拟合,然后外推求截距得出,所以利用式(1)可以求出不同温度下的吸附自由能变。由式(3)对lnKd和1/T作图进行线性拟合,根据直线的斜率和截距求得吸附反应的熵变ΔS和焓变ΔH,结果如表3所示。
由表3可以看出ΔH>0,ΔG<0,表明该吸附过程为自发的吸热过程。ΔG值反映了吸附过程中推动力的大小,而且其绝对值越大,表明自发推动力越大。在实验温度范围内,ΔG随着温度升高而增大,表明温度升高对吸附过程有利,由于ΔG值数值均较小,所以可以认为该过程属于物理吸附过程[12]。染料分子在磁性海泡石上的吸附所引起的熵减少小于水分子在海泡石上的解吸引起的熵增加,所以整个体系ΔS>0,表现为熵增过程[20]。
3 结 论
采用共沉淀法制备了磁性海泡石,并用于处理次甲基蓝模拟印染废水。XRD和FTIR分析表明,Fe3O4磁核由于静电引力成功的固载于海泡石表面,并未对海泡石结构产生影响。磁性海泡石对次甲基蓝的吸附随时间的延长而增大,120 min后可达到吸附平衡。动力学研究表明该吸附过程符合准二级动力学模型。热力学研究表明,磁性海泡石对次甲基蓝的吸附是一个自发的物理吸附过程。焓变为1.048 kJ/mol,熵变为12.502 J/(mol·K),表明该吸附为熵增过程,且吸热。
参考文献:
[1]LAZAREVIC S, JANKOVIC-CASTVAN I, JOVANOVIC D, et al. Adsorption of Pb2+, Cd2+and Sr2+ions onto natural and acid-activated sepiolites. Applied Clay Science, 2007, 37(1): 47-57.
[2]ESTEBAN-CUBILLO A, PINA-ZAPARDIEL R, MOYA J, et al. The role of magnesium on the stability of crystalline sepiolite structure. Journal of the European Ceramic Society, 2008, 28(9): 1763-1768.
[3]CHIVRAC F, POLLET E, SCHMUTZ M, et al. Starch nano-biocomposites based on needle-like sepiolite clays. Carbohydrate Polymers, 2010,80 (1): 145-153.
[4]GONZALEZ-PRADAS E, SOCIAS-VICIANA M, URENAAMATE M, et al. Adsorption of chloridazon from aqueous solution on heat and acid treated sepiolites. Water Research, 2005, 39(9): 1849-1857.
[5]VALENTIN J, LOPEZ-MANCHADO M, RODRIGUEZ A, et al. Novel anhydrous unfolded structure by heating of acid pretreated sepiolite. Applied Clay Science, 2007, 36(4): 245-255.
[6]ZHOU J, DONG Y, HAMPSHIRE S, et al. Utilization of sepiolite in the synthesis of porous cordierite ceramics. Applied Clay Science, 2011, 52: 328-332.
[7]TURHAN Y, TURAN P, DOGAN M, et al. Characterization and adsorption properties of chemically modified sepiolite. Industrial & Engineering Chemistry Research, 2008, 47(6): 1883-1895.
[8]苏小丽, 夏光华, 廖润华. 有机海泡石的制备及其结构性能的研究[J]. 陶瓷学报, 2010, 31(2): 310-314. SU Xiaoli, et al. Journal of Ceramics, 2010, 31(2): 310-314.
[9]张晓飞, 柴立元, 彭兵, 等. 海泡石陶瓷料浆稳定性的研究[J].陶瓷学报, 2007, 28(3): 210-216. ZHANG Xiaofei, et al. Journal of Ceramics, 2007, 28(3): 210-216.
[10]SABAH E, TURAN M, CELIK M S. Adsorption mechanism of cationic surfactants onto acid- and heat-activated sepiolites. Water Res., 2002, 36: 3957-3964.
[11]EREN E, AFSIN B. Investigation of a basic dye adsorption from aqueous solution onto raw and pre-treated sepiolite surfaces. Dyes and Pigments, 2007, 73: 162-167.
[12]OZCAN A, OZCAN A S. Adsorption of Acid Red 57 from aqueous solutions onto surfactant-modified sepiolite. Journal of Hazardous Materials, 2005, B125: 252-259.
[13] OZDEMIR Y, DOGAN M, ALKAN M. Adsorption of cationic dyes from aqueous solutions by sepiolite. Microporous and Mesoporous Materials, 2006, 96: 419-427.
[14]王维清, 冯启明, 董发勤. 磁性海泡石的制备及表征[J]. 水处理技术, 2010,36(7): 40-42. WANG Weiqing, et al. Technology of Water Treatment, 2010, 36(7): 40-42.
[15]曹吉林, 陈学青, 刘秀伍, 等. 磁性膨润土净水剂制备及其应用[J]. 天津大学学报, 2007,40(4): 457-462. CAO Jilin, et al. Journal of Tianjin University, 2007, 40(4): 457-462.
[16]黄桂华, 章伟光, 徐政和, 等. 功能化介孔磁性载体的制备及对铜离子的吸附[J]. 华南师范大学(自然科学版), 2006, (4): 82-87. HUANG Guihua, et al. Journal of South China Normal University (Natural Science Edition), 2006, (4): 82-87.
[17]袁明亮, 闫冠杰. 磁性天然沸石的制备及其对Pb2+、Cu2+的吸附性能[J]. 过程工程学报, 2008, 8(6): 1213-1217. YUAN Mingliang, et al. The Chinese Journal of Process Engineering, 2008, 8(6): 1213-1217.
[18]李计元, 马玉书, 张婷婷, 等. 硅烷偶联剂改性海泡石的制备及表征[J]. 非金属矿, 2011, 34(5): 27-29. LI Jiyuan, et al. Non-Metallic Mines, 2011, 34(5): 27-29.
[19]王维清, 冯启明, 董发勤, 等. 磁性膨润土的制备及其性能[J].硅酸盐学报, 2010, 38(4): 684-688.WANG Weiqing, et al. Journal of the Chinese Ceramic Society, 2010, 38(4): 684-688.
[20]徐淑芬, 倪哲明, 夏盛杰, 等. Mg/Al双金属氧化物吸附Cr(Ⅵ)的动力学和热力学机理[J]. 硅酸盐学报, 2009, 37(5): 773-777. XU Shufen, et al. Journal of the Chinese Ceramic Society, 2009, 37(5): 773-777.
通信联系人:马玉书(1963-),男,讲师。
Received date: 2014-07-08. Revised date: 2014-09-07.
Correspondent author:MA Yushu(1963-), male, Lecturer.
Preparation of Magnetically Modified Sepiolite and Its Adsorption of Methylene Blue
MA Yushu LI Jiyuan ZHAO Haiying ZHU Junfeng WANG Changping
(School of Materials Science and Engineering, Tianjin Chengjian University, Tianjin 300384, China)
Abstract:Magnetically modified sepiolite with good adsorption was prepared by chemical coprecipitation process with acid-treated sepiolite as a carrier. The magnetically modified sepiolite was characterized by XRD and FTIR. The results showed that magnetic core Fe3O4was successfully loaded on the surface of sepiolite fibers by electrostatic force. The adsorption of methylene blue in simulated wastewater by magnetically modified sepiolite was studied. The results indicate that the adsorption isotherm for methylene blue accords with the Langmuir equation. The adsorption enthalpy and entropy changes are respectively 1.048 kJ/mol and 12.502 J/(mol•K), and the adsorption is a spontaneous, physical and endothermic process. Also the adsorption dynamics follows the laws of pseudo-second-order kinetics.
Key words:magnetically modified sepiolite; adsorption; methylene blue; Langmuir; endothermic; kinetics
中图分类号:TQ174.75
文献标志码:A
文章编号:1000-2278(2015)01-0064-06
DOI:10.13957/j.cnki.tcxb.2015.01.014
收稿日期:2014-07-18。
修订日期:2014-09-07。

