60份红麻种质资源ISSR和RAPD的聚类分析
李建军,霍光,2,唐慧娟,陈安国,黄思齐,李德芳*
(1.中国农业科学院麻类研究所,长沙410205;2.湖北省烟草公司恩施州公司,湖北恩施444500)
红麻(Hibiscus cannabinus L.)属于锦葵科木槿属一年生古老而富含新概念的环保作物,作为多用途可持续利用的再生资源越来越受到关注[1]。作为纺织、造纸和生物质能源的理想原料,红麻具有其独特的优势。我国相继育成一批红麻优良品种[2-3],产量和品质有较大幅度的提高,在国内外居领先水平,但在不抗倒性耐根腐线虫病等方面研究较少。前人对这批优异种质资源或品种做了较多鉴定、评价与利用工作,主要集中在形态学、遗传基础等主要表型特征进行分析[4],而红麻属于常异花授粉作物,在繁种过程中容易引起性状改变,因此新的分子标记技术能更快更准确对红麻在繁种过程中是否存在变异或混杂进行分析。
近年来,国内外学者利用RAPD和ISSR技术对植物亲缘关系进行研究。利用ISSR技术对罂粟[5]、大叶茶[6,19]、黄麻[7]进行多样性分析。利用 RAPD 技术对苎麻[8]、红麻[9]资源进行分析,将近缘种和栽培种区分开来。已利用 RAPD[9-10]、ISSR[11-12]、AFLP[13]分子标记技术对红麻种质资源遗传多样性作了一些初步研究,主要集中在部分当家品种和选育品种,仅与主要国外品种的亲缘关系,所反映的遗传相似性比较狭窄。红麻基因组还没有测序,仅有极少数基因克隆,无法大量开发SSR[17]、SNP和EST标记,研究起来进展缓慢,而ISSR和RAPD标记能够在未知序列的情况下快速方便找到差异,因此,针对我国红麻种质资源的遗传多样性及亲缘关系的分子标记研究仍不全面,我们将扩大群体数量,增加近缘种和野生种数量探讨遗传多样性和亲缘关系,在品种选育中能更好的选择中间材料,减少盲目性。
红麻种质资源的遗传多样性十分丰富,对种质资源遗传多样性的研究不但可以为新品种选育策略的制订提供参考依据,而且可以为亲本的选配、后代遗传变异程度及杂种优势水平的预测提供预见性的指导,对于发掘红麻优异种质基因,拓展栽培品种的遗传基础具有重要意义。本研究采用RAPD和ISSR分子标记技术,从不同地区和省份广泛征集并选取有代表性红麻栽培种、半野生种和野生种60份供试材料进行研究,以期揭示其栽培种、半野生种和野生种遗传多样性及亲缘关系,为红麻遗传改良和分子标记辅助育种提供科学依据。
1 材料与方法
1.1 供试材料
征集并选取红麻供试材料60份,分别来自16个国家和地区,其中包括野生及半野生品种15份,栽培品种45份,材料名称、来源及品种类型见表1。
1.2 方法
DNA提取采用白凤虎的遗传改良CTAB方法[14],200条RAPD引物和100条ISSR引物(均购自上海生工),反应体系为总体系 20 μL ,其中 10 ×buffer 2 μL ,2.5 mM dNTP 0.4 μL ,2.5 UTaqmerase 0.4 μL ,primer 0.4 μL ,模版 2 μL ,ddH2O 14.8 μL 。ISSR 采用李辉[15]的 PCR 扩增方法,94℃ 3 min;94℃ 60 s,52℃ -56℃(不同引物其特异退火温度不同)30 s,72℃ 90 s,39个循环;72℃ 6 min;4℃保存。产物在1×TBE缓冲液中,用6%聚丙烯酰胺凝胶电泳检测,电压为180 V,电泳2 hr。银染显色,BioRad凝胶成像仪拍照记录。RAPD采用李建军[8]的PCR扩增方法,首先94℃ 预变性3 min;然后94℃ 60 s,37℃ 45 s,72℃ 60 s,39个循环;72℃ 6 min;4℃保存。产物在1.8%琼脂溶胶检测。
1.3 数据处理
PCR产物经含EB的1.8%琼脂糖凝胶电泳后,用Quantity One 6.0分析软件结合人工方法读带,记录电泳图谱中清晰且能重复出现的条带,在相同的迁移位置上,有带用“1”表示,无带用“0”表示。采用NTSYS-pc2.10e分析软件计算样品间的遗传相似系数,同时用类平均聚类法(UPGMA)进行聚类分析,构建分子聚类图。
2 结果与分析
2.1 ISSR和RAPD多态性分析
从200条RAPD引物中筛选出38条多态性较好、条带清晰的引物用于统计分析,这38条引物编号分别为:S406、S407、S409、S417、S422、S425、S427、S433、S434、S437、S439、S440、S441、S442、S444、S446、S463、S470、S487、S491、S506、S509、S511、S512、S516、S1004、S1013、S1015、S1024、S1047、S1052、S1073、S1075、S1079、S1080、S1062、S507 和 S1053。38 条引物共扩增出 286 条重复性好的清晰条带,其中多态性条带有227条,平均每条引物扩增条带为7.53条,多态性条带比率为79.4%;100条ISSR引物中共筛选出符合条件的21条引物用于数据分析,21条引物编号分别为:U808、U809、U812、U817、U818、U824、U826、U827、U828、U846、U847、U848、U855、U856、U860、U864、U879、U881、U887、U889和U891。21条引物共扩增出169条清晰条带,多态性条带有141条,平均每条引物扩增出8.05条带,多态带的比率为83.4%。ISSR标记的多态性条带比率高于RAPD标记,与RAPD标记比较,ISSR标记能检测出更多的基因组多态性信息,但两种标记均较好的表现出了60份红麻材料丰富的遗传多样性。有关两种分子标记技术得到的结果比较见表2。
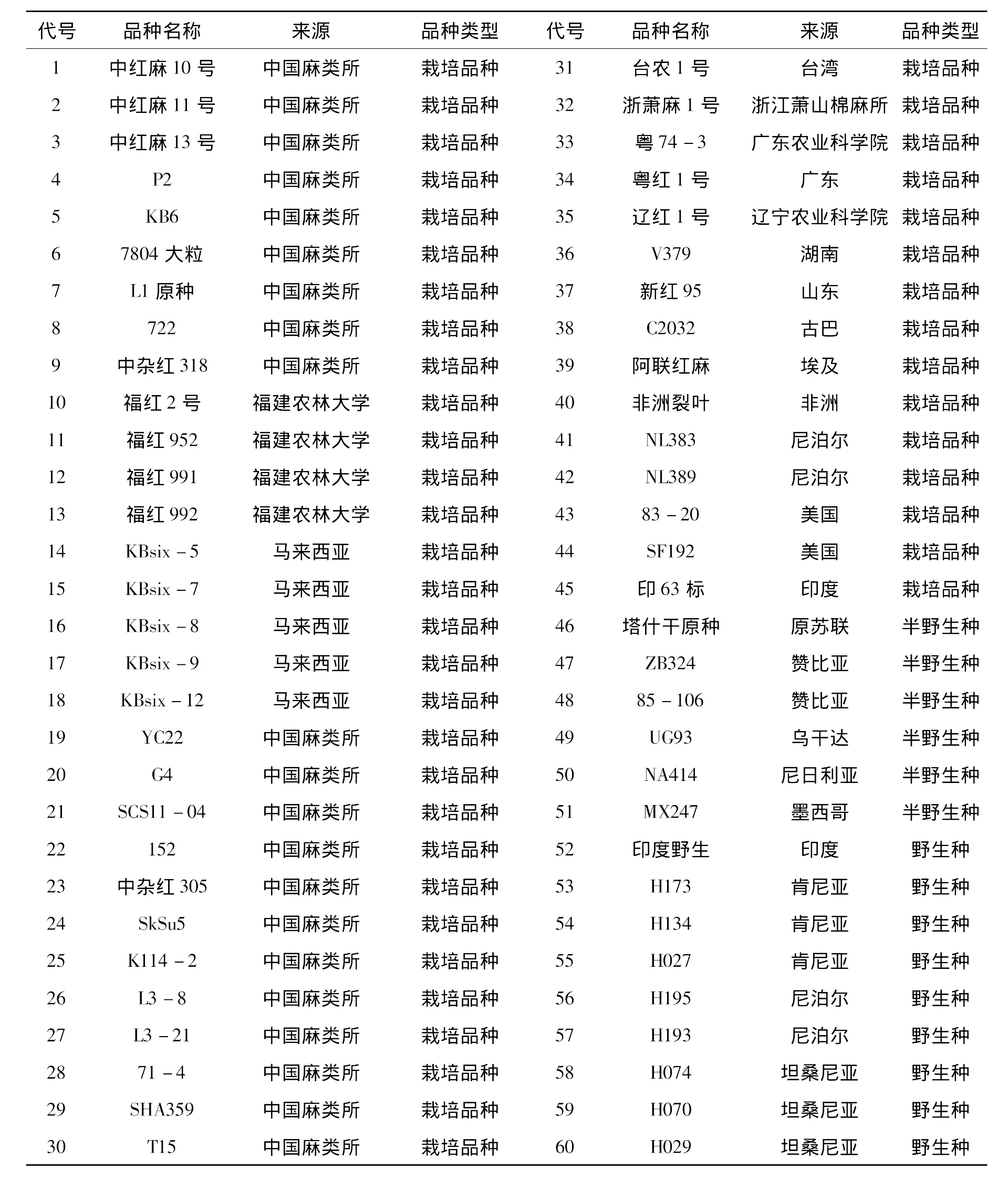
表1 供试红麻品种,来源及品种类型Tab.1 Kenaf varieties and their origins
2.2 综合利用ISSR和RAPD进行60个品种的聚类分析
利用NTSYS-pc2.10e分析软件以同样的方法进行聚类分析,建立聚类树状图(如图1所示)。60份红麻材料间的遗传相似系数(GSC,genetic similarity coefficients)在0.457-0.971之间,当在遗传相似系数为0.871处作切割线L1时,可将60份材料分为两大类群:45份栽培品种分成一大类群,15份野生、半野生品种聚为另一大类群。在15份野生种和半野生种构成的类群中,H029和H027(GSC=0.954)、85-106和ZB324(GSC=0.876)的遗传关系最近,所以聚成一类,其余的野生、半野生种间都独立成类;另外,源于尼泊尔的两个野生种H193与H195(GSC=0.761)和源于肯尼亚的两个野生种H173与H134(GSC=0.865)的亲缘关系在这一大类群中相对较近;原始野生种H070依旧处于聚类的最基础地位,与其他品种间的遗传相似系数在0.457-0.750之间(与NA414和印度野生的GSC=0.457,与H195的GSC=0.750)。当在遗传相似系数为0.882处作切割线L2时,45份栽培品种构成的大类群可分为四个亚群:第一亚群中仅包括C2032;83-20、SF192、T15和阿联红麻组成第二亚群,这一群中美国的两个栽培品种83-20和SF192的亲缘关系最近(GSC=0.928);印63标独自作为第三亚群;其余39份材料为第四亚群。为了更好地了解遗传差异和亲缘关系,在遗传相似系数为0.896处作切割线L3,又可将39份材料构成的大亚群分为七个次亚群组:第一组由两个尼泊尔的栽培种NL383和NL389构成,说明地理位置可以区分品种的亲缘关系;中红麻11号和中红麻13号聚成第二组;第三组由722和台农1号组成;中杂红305、中杂红318和中红麻10号属于第四组,为中红麻系列,均为选育品种,说明3者亲缘关系接近;第五组包括K114-2和7804大粒;SCS11-04单独作为第六组;剩余的27份栽培品种构成第七亚群组,在这七个亚群组中,前六组中除了第一组和第二组中的台农1号外,其余品种都为中国农业科学院麻类研究所育成品种。当在遗传相似系数为0.925处作切割线L4时,可进一步将27个品种组成的第七亚群组分为五个群:福红952、粤红1号和浙萧麻1号组成第一群;非洲裂叶、福红991、福红2号、福红992和SHA359这五个品种组成第二群;由福建农林大学选育的福红系列聚在第一、第二群。第三群由L3-8和L3-21两个品种构成;第四群包括V379、YC22和714三个品种,前四个群共13个品种的选育单位为中国农业科学院麻类研究所、福建农林大学、浙江萧山棉麻所;最后14个品种聚为第五群,这一群品种的聚类也颇为复杂,不同地域的品种聚在一起。包括从马来西亚引进的5个品种、山东的1个品种(新红95)、中国麻类所的6个品种、广东农科院育成的1个品种(粤74-3)以及辽宁农科院育成的1个品种(辽红1号),其中Kbsix-5、新红95、L1原种和粤74-3都是各自单独成类的。45份红麻栽培种材料的GSC变化范围在0.821-0.971之间,表明栽培种间的亲缘关系和遗传进化关系相对紧密,其中来自马来西亚的品种KBsix系列共4个品种GSC极高,聚在一起,而KBsix-8和KBsix-12之间的GSC高达0.971,亲缘关系和遗传进化关系最密切。不同地理位置的品种聚在一起,说明国际育种交流日趋紧密,品种间相互利用,基因相互渗入,亲缘关系较近。
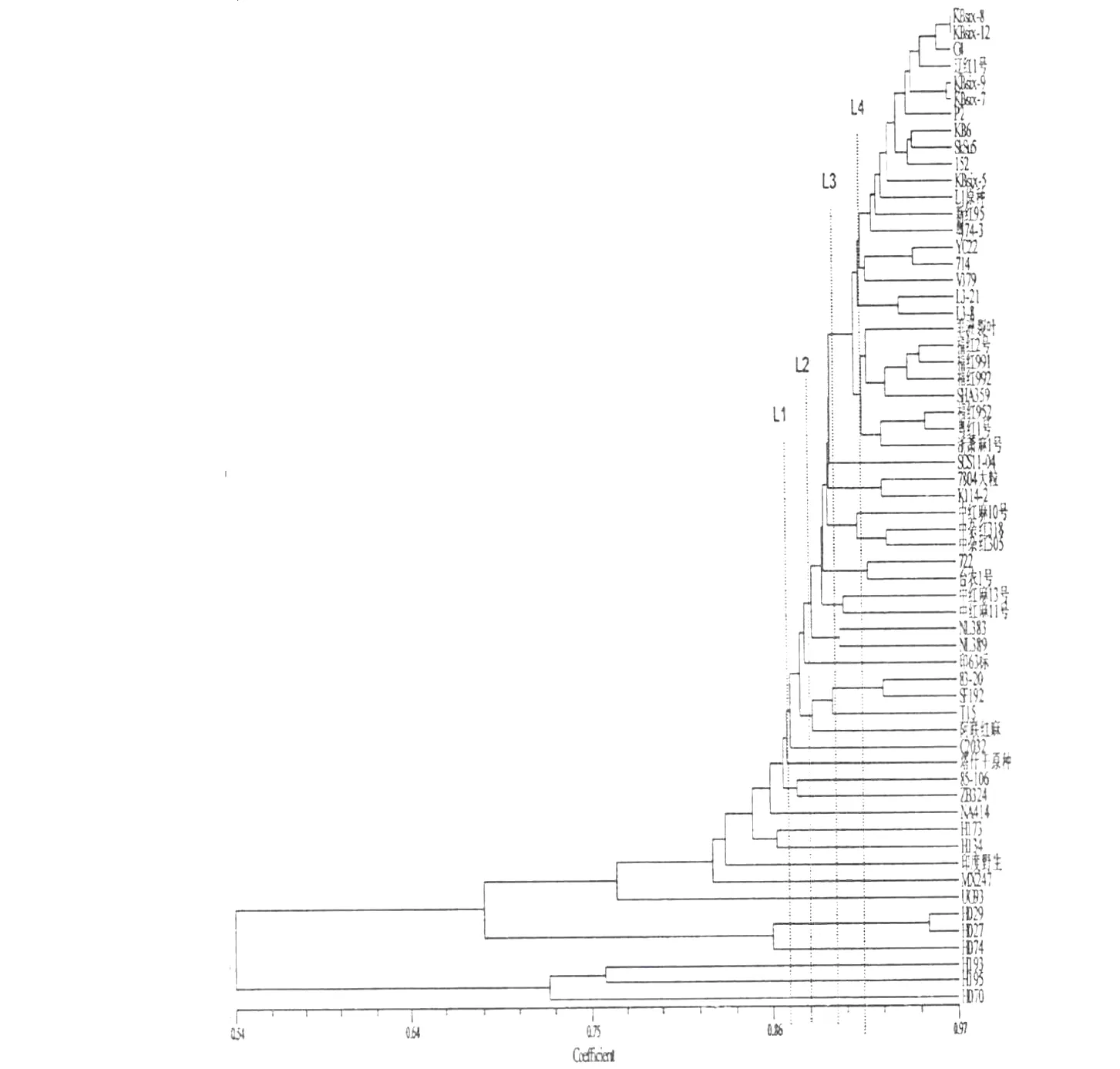
图1 60份红麻材料RAPD和ISSR聚类图Fig.1 Dendrogram of 60 kenaf clustered based on RAPD and ISSR markers
2.3 利用ISSR和RAPD对湖南省22个栽培品种的聚类分析
60份红麻材料中包括中国农业科学院麻类研究所育成的21个品种,为了研究这些品种之间的亲缘关系,考虑到地域和育种单位的因素,特将这21份材料和湖南的1个材料(V379)进一步作分子聚类分析,结果见图2。
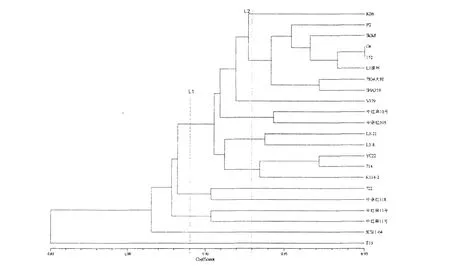
图2 22份红麻材料的遗传相似性聚类分析Fig.2 Dendrogram of genetic similarity of 22 kenaf by using UPGMA method
22份红麻品种间的GSC在0.836-0.954之间,当在遗传相似系数为0.896处作切割线L1时,22份栽培材料分为五个类群:T15、SCS11-04分别单独聚为两类;中红麻13号和中红麻11号聚为第三类;中杂红318和722组成第四类;第五类将剩余的品种包括在内。中红麻11号由72-44和72-3杂交选育而成,中红麻13号由中红麻10号与红麻11号杂交,然后与中红麻11号回交所选育[2],具有极高的遗传相似性,因此它们聚在一起。福红系列大都是以非洲裂叶为亲本选育而成,与非洲裂叶具有较高的遗传相似性。当在遗传相似系数为0.919处作切割线L2时,第五类品种可分为六个亚类:第一亚类包括YC22、714和K114-2;L3-8和L3-21组成第二亚类,它们都是从L3中株选而来,属于同一品系;第三亚类包括中红麻10号和中杂红305;V379单独组成第四亚类;第五亚类包括的品种数目最多,包括7个品种,分别是7804大粒、SHA359、L1原种、P2、SkSu5、G4和152,这一亚类中G4和152亲缘关系最近(GSC=0.954);最后一个亚类只包括KB6一个品种。
3 讨论
3.1 红麻资源的遗传多样性分析
中国农业科学院麻类研究所选育的21个栽培种和湖南的一个地方品种(V379)亲缘关系较近,遗传相似系数范围在0.827-0.959之间。利用综合矩阵得到的聚类图,可以清晰看到品种的选育过程和各品种间的亲缘关系。育种家选育的品种遗传相似系数极高,只有少数的变异。比如麻类研究所选育的品种中,T15处于聚类最基础的地位,在这22个栽培品种中可以考虑作为亲本使用,它不仅具有当地栽培品种的优良性状,而且在遗传选育中,它具有外来品种的优质基因,因此在选育品种的过程中,以当地优良品种作为亲本之一,在某些性状上互补的其他优异资源为材料进行杂交,弥补当地品种的缺陷,这样能够很快适应当地的栽培,有利于性状改良,获得所需优异种质[2]。45个栽培品种的GSC为0.871,说明栽培种间的遗传相似系数极高,种质资源的遗传基础狭窄,说明基因型与亲缘关系相近,可能中国的红麻品种主要以引进有关,主要集中在少数优良性状的基因上。福红系列品种主要由非洲裂叶为亲本选育而成,具有相似的遗传背景,亲缘关系相对较近[3,11]。本研究加大种质资源的数量和来源地,更好地区分和鉴定红麻资源遗传的多样性,能够把来自马来西亚、中国农业科学院麻类所和福建农林大学3个育种单位或地区的品种有效区分开来。因此不同育种研究者可相互借鉴,利用对方品种的优点去弥补相互的缺点,这样大大提高品种选育的选择性,减少盲目性。地理分布与种群的遗传多样性有直接联系,从15个野生种和半野生种来源于不同的国家或地区,来自于同一个国家的品种聚在一起,遗传相似系数也高;不同国家的品种属于不同的类群,说明地理因素决定品种的遗传多样性。红麻起源于非洲,分布范围广,保持了较高的遗传多样性[12,20]。15份野生种和半野生种聚为一类,与栽培种的遗传距离较远,这些品种资源具有较强的抗病性[13]和其他优良性状基因,扩大遗传基础;通过60份资源的RAPD和ISSR分子标记能够更好地减少盲目选育,能够有目的有计划地进行驯化。特别是全球气候变暖,恶劣天气和不正常气候给农业生产带来巨大的灾害,因此对红麻核心种质的遗传多样性[16]分析有助于我们在今后开展育种工作中提供借鉴意义。同时通过分子辅助育种能够提高选择品种的正确率,减少由于主观原因所造成的偏差,加快育种进程,构建核心种质库有利于品种的遗传改良。因此利用育种家的种质构建核心种质库,挖掘近缘种或者野生种中的一些优异资源(抗逆性或者品质)共同组成核心种质库[20-21],避免品种选育的单一化,呈现品种的多样性。
3.2 ISSR和RAPD对研究红麻遗传多样性的可靠性分析
ISSR和RAPD能够不针对物种,能够快速区分品种的遗传多样性。两种引物的多态性达到45%以上,与他们的结果相近。60份遗传材料的遗传相似系数在0.457-0.971,与用ISSR标记的结论相近[12,18],说明两种分子方法结合也能够有效区分不同品种间的多样性,在黄麻[10]等物种中得到印证。虽然RAPD产生假阳性,可通过提高退火温度,使实验数据能够很好的重复,保证了实验的准确性[8-10],说明RAPD仍不失为可利用的分子标记。
[1]James M.Dempsey.Fiber Crops[M].The Board of Regents of the State of Florida,1975:203 -225.
[2]陈安国,李德芳,李建军,等.高产优质抗病强适应性广红麻新品种“中红麻13号”的选育[J].中国麻业科学,2011,33(4):169-173.
[3]吴建梅,祁建民,林荔辉,等.高产稳产多抗红麻新品种福红13号的选育[J].中国麻业科学,2008,30(1):6-12.
[4]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:233-242.
[5]魏玉杰,张金文,何庆祥,等.不同生态区罂粟种质的遗传多样性ISSR分析[J].植物遗传资源学报,2012,13(2):239-243.
[6]刘本英,王丽鸳,周健,等.云南大叶种茶树种质资源ISSR指纹图谱构建及遗传多样性分析[J].植物资源学报,2008,9(4):458-464.
[7]祁建民,周东新,吴为人.RAPD和ISSR标记检测黄麻属遗传多样性的比较研究[J].中国农业科学,2004,37(12):2006-2011.
[8]李建军,郭清泉,陈建荣.21份不同木质素含量的苎麻的RAPD聚类分析[J].中国麻业,2006,28(3):120-122.
[9]郭安平,周鹏,粟建光.红麻及其近缘种的RAPD分析[J].热带亚热带植物学报,2002,l0(4):306-312.
[10]程舟,鲛岛一彦,陈家宽.红麻种质资源遗传变异和亲缘关系的RAPD分析[J].中国麻业,2002,24(1):1-11.
[11]陶爱芬,祁建民,李爱青.红麻优异种质资源遗传多样性与亲缘关系的ISSR分析[J].作物学报,2005,3l(12):1668-1671.
[12]霍光,李德芳,陈安国,等.利用ISSR分子标记分析44份红麻种质资源的遗传多样性[J].安徽农业科学,2009,37(21):9890-9892.
[13]程舟,杨晓伶,卢宝荣,等.红麻种质资源的遗传多样性和亲缘关系的AFLP分析[J].中国麻业,2003,25(4):162-167.
[14]白凤虎,李德芳,陈安国,等.改良CTAB法用于提取红麻成熟叶片高质量DNA的研究[J].中国麻业科学,2007,29(3):158-161.
[15]李辉,李德芳,陈安国,等.红麻雄性不育系的选育和不育基因的ISSR分子标记[J].中国农学通报,2008,24(8):80-83.
[16]戴志刚,粟建光,陈基权,等.我国麻类作物种质资源保护与利用研究进展[J].植物遗传资源学报,2012,13(5):714-719.
[17]赵胜杰,朱红菊,陆绪强,等.无籽西瓜品种SSR指纹图谱构建及遗传多样性构建[J].植物遗传资源学报,2013,14(6):1142-1146.
[18]龚榜初,刘国彬.锥栗自然居群遗传多样性的ISSR分析[J].植物遗传资源学报,2013,14(4):581-587.
[19]林 立,胡仲义,王国明.舟山群岛野生山茶种群遗传多样性的ISSR分析[J].植物遗传资源学报,2013,14(4):594–599.
[20]Zhang L W,Li A Q,Wang X H,et al.Genetic diversity of kenaf evaluated by ISSR[J].Biochem Genet,2013,51:800 –810.
[21]Pratik Satya,Maya Karan,Kaustav Chakraborty,et al.Comparative analysis of diversification and population structure of kenaf(Hibiscus cannabinus L.)and roselle(H.sabdariffa L.)using SSR and RGA(resistance gene analogue)markers[J].Plant Systematics and Evolution,2014,300(5):1209-1218.

