顶空毛细管气相色谱法测定18F-氟代乙酸盐中有机溶剂残留
郭莘 戴红峰 周硕 陈文新
·论著·
顶空毛细管气相色谱法测定18F-氟代乙酸盐中有机溶剂残留
郭莘 戴红峰 周硕 陈文新
目的 建立以毛细管气相色谱法测定18F-氟代乙酸盐(18F-FAC)中乙腈、丙酮和乙醇3种有机溶剂残留量的方法。方法 采用HP-INNOWAX(30m×0.53mm,1μm)毛细管色谱柱和氢火焰离子化检测器,检测器温度为270℃,进样口温度为200℃,柱温采用程序升温,载气为氮气,进样量为1μl。结果 乙腈、丙酮和乙醇均能得到较好的分离,呈现良好的线性关系,相关系数分别为:0.9999、0.9973、0.9988,平均回收率分别为99.8%、101.0%、97.5%,相对标准偏差值分别为4.6%、4.0%、1.5%。结论 毛细管气相色谱法简便快速、灵敏度高、结果准确可靠,适用于18F-FAC中残留有机溶剂的测定。
氟醋酸盐类;色谱法,气相;有机溶剂残留量
11C-乙酸盐是测定心脑氧化代谢情况、鉴别诊断泌尿道肿瘤和肝细胞癌的PET显像剂,其检测某些肿瘤的灵敏度及特异度高于最常用的PET显像剂18F-FDG[1-2];但11C的半衰期短,需由加速器即时提供,且不能进行延迟显像。18F-氟代乙酸盐(18F-fluoroacetate,18F-FAC)是11C-乙酸盐的类似物,其半衰期较长,能弥补11C-乙酸盐的不足,有报道其在诊断前列腺肿瘤方面能取代11C-乙酸盐[3],并在肝癌、胶质瘤等的鉴别诊断中表现出与18F-FDG不同的临床价值[4-5],显示出较好的应用前景。由于18F-FAC的清洁及合成过程中使用了乙腈、丙酮及乙醇,因此可能存在此3种有机溶剂残留。尤其乙腈为二类溶剂,具有一定毒性,应限制使用,所以控制这3种溶剂的残留量对保证18F-FAC的质量具有重要意义。关于18F-FAC残留溶剂的研究,《中国药典》2010年版及之前版本没有收录正电子类放射性药品,但制定了“正电子类放射性药品质量控制指导原则”[6],规定残留溶剂检查及其他项目要进行追溯性检验。《中国药典》2015年版在征求意见稿中要求采用气相色谱法测定PET显像剂18F-FDG中有机溶剂的残留量,但未见气相色谱法测定18F-FAC中有机溶剂残留量的规定及报道。本实验根据《中国药典》2015年版的相关规定及有关文献,采用顶空毛细管气相色谱法,以水为溶解介质,同时测定18F-FAC中乙腈、丙酮及乙醇3种残留溶剂的含量。
1 材料与方法
1.1 仪器与试药
GC-6890N型气相色谱仪、气相色谱工作站、氢火焰离子化检测器(美国Agilent公司);PL203电子精密天平[梅特勒-托利多仪器(上海)有限公司]。
丙酮、正丙醇均为色谱纯(国药集团化学试剂有限公司);乙醇和乙腈均为色谱纯(德国Merck KGaA公司);18F-FAC由本科室自制,自制方法参照邓怀福等[7]的报道,批号:20141104、20141114、20141120、20141124。
1.2 色谱条件
色谱柱:HP-INNOWAX(30m×0.53mm,1μm)(美国Agilent公司);载气:高纯氮;流速:2.0ml/min;分流比:30∶1;起始柱温为50℃,保持12min,以50℃/min升温至220℃,保持3min;进样口温度为200℃;检测器温度为270℃;进样量:1μl。
1.3 溶液制备
1.3.1 内标溶液的制备
取正丙醇约0.5 g,精密称定,置100ml量瓶中,加水稀释至刻度,摇匀,作为内标溶液。
1.3.2 对照品溶液的制备
分别精密称取丙酮585.64mg、乙醇522.06mg、乙腈44.11mg于100ml量瓶中,用水稀释至刻度,得到混合对照品储备液。精密量取混合对照品储备液1ml,置10ml量瓶中,精密加入内标溶液1ml,加水定容至刻度,摇匀,作为对照品溶液。
1.3.3 供试品溶液的制备
精密量取18F-FAC 1ml置10ml量瓶中,精密加入内标溶液1ml,加水定容至刻度,摇匀,作为供试品溶液。
1.4 系统适用性试验
精密量取对照品溶液和供试品溶液各1μl,注入气相色谱中,记录色谱图,测定各有机溶剂的分离度及柱效。1.5 专属性试验
分别取内标溶液、对照品溶液、供试品溶液和空白溶液,各进样1μl。
1.6 检测限和定量限
取对照品溶液,以逐级稀释法测定各对照品溶剂的检测限(S/N=3)和定量限(S/N=10)。
1.7 样品稳定性试验
取供试品溶液样品1份,于室温放置6 h,分别在0、1、2、4、6 h取样进行测定,记录色谱图。
1.8 仪器精密度试验
精密量取同一对照品溶液1μl注入气相色谱仪,按“1.2”项下的色谱条件进行分析,连续进样6次,记录色谱图,以各组分的峰面积对内标峰面积比值计算其相对标准偏差(relative standard deviation,RSD)。
1.9 线性关系考察
精密量取对照品储备液0.25、0.5、1.5、2.5、3.5、5.0、8.0ml置25ml容量瓶中,再分别加入内标储备液2.5ml,加水定容,摇匀,各配制2份。按“1.2”项下的色谱条件分别进样测定,记录色谱图。以浓度(μg/ml)为横坐标,被测组分峰面积与内标峰面积的比值为纵坐标。
1.10 回收率试验
量取对照品储备液20ml,置100ml量瓶中,分别精密量取上述溶液2.5、5.0、7.0ml各3份置于9个10ml量瓶中,各加入样品溶液1m l及内标储备液1ml,加水定容,摇匀。按“1.2”项下的色谱条件进行分析,按内标法以峰面积计算各组分的回收率。
1.11 样品测定
取各个批号的供试品溶液,按“1.2”项下的色谱条件进行分析,记录色谱图,按内标法以峰面积计算各有机溶剂的残留量。
2 结果
2.1 系统适用性试验
3种有机溶剂计算的理论板数均≥5000,相邻溶剂的分离度均符合要求,色谱图见图1。
2.2 专属性试验
由色谱图可见水及内标溶液对丙酮、乙醇和乙腈的测定无干扰。丙酮、乙醇和乙腈的对照品溶液及溶剂水在供试品溶液色谱图中,与内标溶液色谱峰相应位置处无干扰。结果表明方法专属性良好。
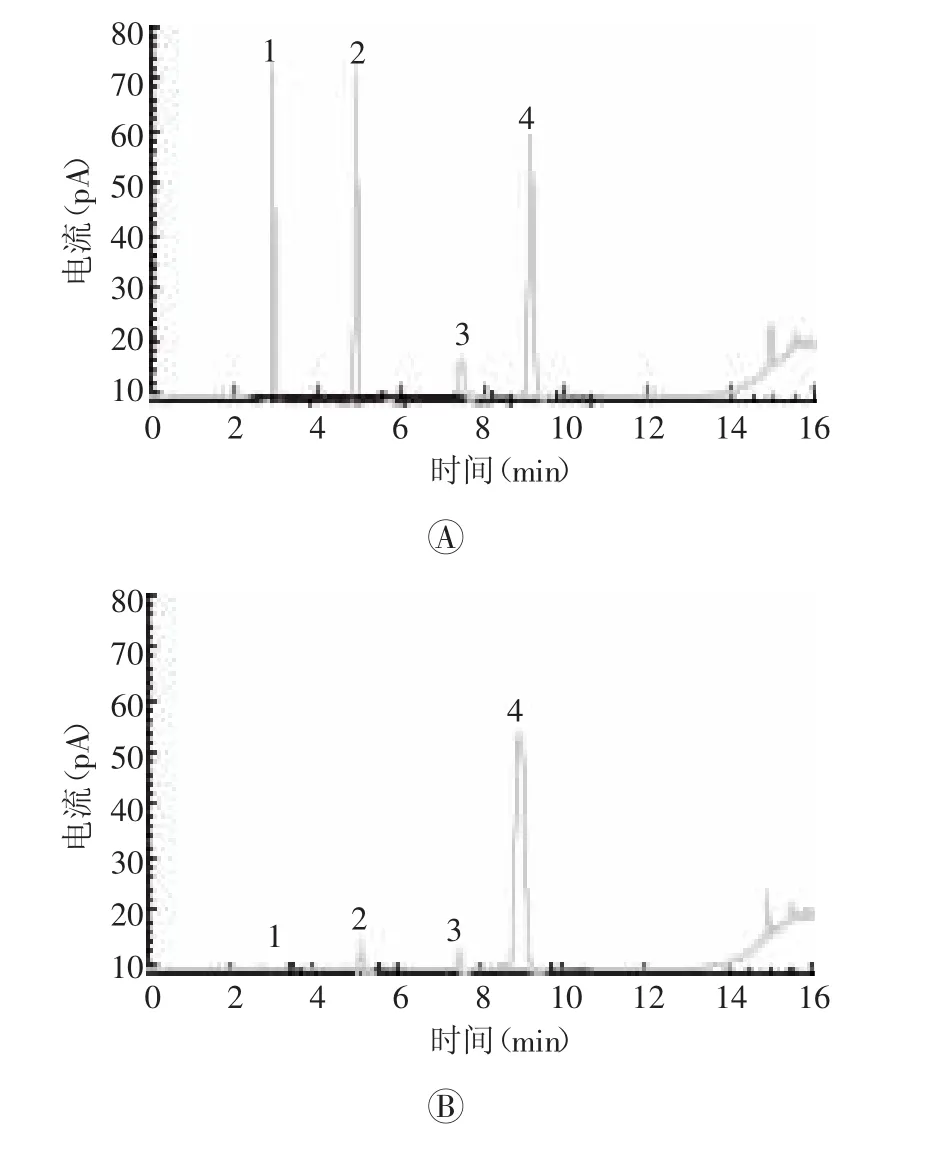
图1 有机溶剂残留气相色谱图 图中,A:对照品溶液;B:试供品溶液;1:丙酮;2:乙醇;3:乙腈;4:正丙醇(内标溶液)。Fig.1 Gas chromatogramsof residualorganic solvents
2.3 检测限和定量限
乙腈、丙酮和乙醇的对照品溶剂的检测限分别为0.4411、0.2528、0.0523μg/ml。定量限分别为4.411、2.528、2.616μg/ml。
2.4 样品稳定性试验
丙酮、乙醇及乙腈的平均峰面积的RSD分别为1.4%、0.9%、0.6%。
2.5 仪器精密度试验
丙酮、乙醇、乙腈的峰面积比的RSD分别为5.0%、3.9%和3.3%。
2.6 线性关系考察
待测组分的线性回归方程,结果见表1。

表1 3种残留溶剂的回归方程及线性范围(n=7)Table 1 Regression equations and linear ranges of the three residualsolvents(n=7)
2.7 回收率试验
丙酮、乙醇、乙腈的平均回收率分别为101.0%、97.5%、99.8%,RSD分别为4.6%、4.0%、1.5%。
2.8 样品测定
根据《中国药典》2010年版的限度规定:丙酮残留量<0.5%、乙醇残留量<0.5%和乙腈残留量<0.04%。试验结果表明,本试验所测4批样品中的丙酮、乙醇和乙腈的残留量符合《中国药典》2010年版二部附录中对注射剂有机溶剂限度的要求。结果见表2。
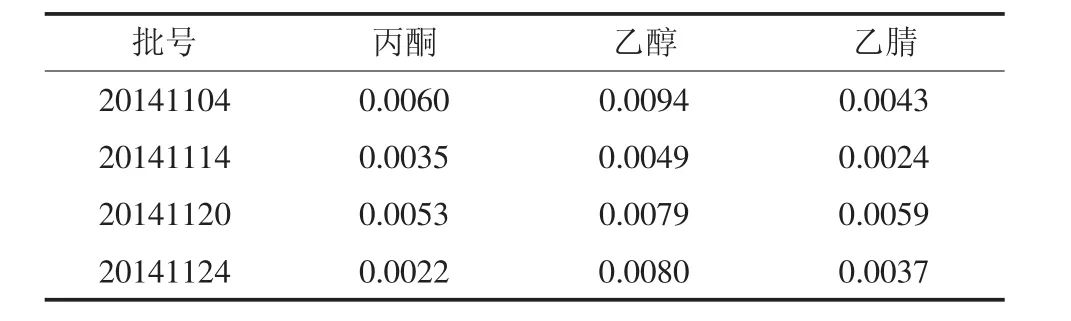
表2 样品有机溶剂残留量测定结果(%)Table 2 The resultsof residualorganic solvents in samples(%)
3 讨论
18F-FAC中残留有机溶剂乙醇、乙腈的沸点分别为78.4℃、81.1℃,差异较小,而乙醇、丙酮、乙腈在极性上有一定的差别,可考虑采用极性色谱柱进行分离。实验前期分别选用强极性的HPINNOWAX柱及中极性的DB-624柱,结果发现使用DB-624柱时,乙醇峰脱尾较严重,而HPINNOWAX柱对各待测组分及内标液的分离效果较好,故本研究选择该柱对待测组分进行分离。柱温对被测组分的分离影响较大,初始温度过高,低沸点组分在固定相上保留不充分,不能得到有效分离;初始温度过低,高沸点组分可能在色谱柱前端冷却液化,使峰形变宽,分离度降低。本研究经筛选将初始温度设为50℃,其后采用程序升温,可有效缩短出峰时间,改善峰形。本研究采用顶空进样,与直接进样相比,样品及溶剂不注入色谱系统,可避免其污染色谱系统,减少其对待测组分测定的干扰,缩短了分析时间,提高了样品测定的重现性;同时待测组分气化后在顶部富集,浓度增大,使检测灵敏度提高。
正电子类放射性显像剂主要用于PET显像,能在分子水平上反映细胞代谢、受体活性、核酸合成及基因改变等,在临床疾病特别是肿瘤的诊断和治疗中占有重要的地位。正电子类放射性显像剂的半衰期较短,一般由医疗机构或正电子类放射性显像剂生产企业于临床使用前制备,制备后立即进行性状、pH值、放射化学纯度及放射性浓度等必检项目检查后即投入临床使用,其他如无菌检验、细菌内毒素检查、有机溶剂残留量检查等作为追溯性检验项目在使用后才进行,这要求正电子放射性显像剂的制备必须严格控制生产中的每一个环节,特别应确保制备工艺的稳定、安全和可靠。目前18FFAC制备工艺中的纯化工艺除固相萃取纯化法外还有液相碱水解的柱纯化法[8]及半制备高效液相色谱纯化加固相萃取法[9]。本研究中18F-FAC的合成采用18F-离子与溶于乙腈的前体反应生成中间体,然后采用固相萃取法,将混有乙腈的中间产品吸附在 Sep-Pak-C18柱上,经水清洗后往柱上加NaOH水解吸附在柱上的中间体,最后用水依次经Sep-Pak-C18柱、Al2O3柱及ICH柱纯化后将终产品淋洗下来。该制备工艺的生产条件要求低、简便、稳定、产率较高。采用上述气相色谱法对使用该工艺制备出的18F-FAC进行有机溶剂残留量分析,结果表明,乙腈、丙酮、乙醇等有机溶剂残留量均符合标准,结果偏差小,说明制备工艺稳定可靠。
顶空气相色谱法测定18F-FAC中有机溶剂的残留量尚未见相关报道,本研究方法简便、准确可靠,可有效排除可能存在的其他杂质的干扰,可用于18F-FAC中有机溶剂残留量的测定。
[1]Huo L,Guo J,Dang Y,etal.Kinetic analysisofdynamic11C-acetate PET/CT imagingasa potentialmethod for differentiation ofhepatocellular carcinoma and benign liver lesions[J].Theranostics,2015, 5(4):371-377.
[2]Dusing RW,Peng W,Lai SM,et al.Prostate-specific antigen and prostate-specific antigen velocity as threshold indicators in11C-acetate PET/CTAC scanning for prostate cancer recurrence[J]. Clin NuclMed,2014,39(9):777-783.
[3]Ponde DE,Dence CS,Oyama N,etal.18F-fluoroacetate:a potential acetate analog for prostate tumor imaging—in vivoevaluation of18F-fluoroacetateversus11C-acetate[J].JNuclMed,2007,48(3):420-428.
[4]Ho CL,CheungMK,Chen S,etal.[18F]fluoroacetate positron emission tomography for hepatocellular carcinoma and metastases:an alternative tracer for[11C]acetate?[J].Mol Imaging,2012,11(3):229-239.
[5]Lopresti BJ,Mason NS.2-18F-fluoroacetate: a useful tool for assessing gliosis in the central nervous system?[J].JNucl Med, 2009,50(6):841-843.
[6]国家食品药品监督管理局.国食药监安[2004]324号正电子类放射性药品质量控制指导原则[S].2004-07-05.
[7]邓怀福,文富华,唐刚华,等.18F-氟代乙酸盐自动化合成及其动物实验研究[J].中山大学学报:医学科学版,2011,33(1):99-103,115.
[8]Sun LQ,Mori T,Dence CS,etal.New approach to fully automated synthesisof Sodium[18F]fluoroacetate—a simpleand fastmethod using a commercial synthesizer[J].Nucl Med Biol,2006,33(1):153-158.
[9]唐刚华,唐小兰,王明芳,等.肿瘤显像剂18F-氟代乙酸盐的自动化合成[J].核技术,2006,29(1):59-62.
Determ ination of residual organic solvents in18F-FAC by gas chromatography
Guo Shen,Dai Hongfeng,Zhou Shuo,Chen Wenxin.Center of PET/CT,Department of Nuclear Medicine,Fujian ProvincialHospital,Fuzhou 350001,China
ChenWenxin,Email:wenxinchzt@aliyun.com
Objective To develop a method for residual organic solvent determination in18F-fluoroacetate(18F-FAC)using capillary gas chromatography.M ethods The residual organic solvents were separated on the HP-INNOWAX capillary chromatographic column using temperature programming. Nitrogen gaswasused as the carriergas,alongwith a flame ionization detector(FID).The FID and injector temperatures were 270℃ and 200℃,respectively,and the injection volume was 1μl.Results Good linear relationshipsin theexperimental concentrations(r=0.9999,0.9973,0.9988)were observed.The three residual organic solvents were separated completely;the average recoveries were 99.8%,101.0%,and 97.5%,and the relative standard deviation valueswere 4.6%,4.0%,and 1.5%,respectively.Conclusion The proposed method is simple,rapid,accurate,and highly sensitive,which can be used in detecting residualorganic solvents in18F-FAC.
Fluoroacetates;Chromatography,gas;Residualorganic solvents
2015-04-17)
10.3760/cma.j.issn.1673-4114.2015.06.005
福建省卫生系统中青年骨干人才培养项目(2013-ZQN-JC-4)
350001福州,福建省立医院核医学科PET/CT中心
陈文新(Email:wenxinchzt@aliyun.com)

