耐多药结核分枝杆菌对环丝氨酸、对氨基水杨酸的耐药性及其与基因型关系分析
杨健 逄宇 赵雁林 张天华 王西娣 陈美龄 李妍 王蕊
·论著·
耐多药结核分枝杆菌对环丝氨酸、对氨基水杨酸的耐药性及其与基因型关系分析
杨健 逄宇 赵雁林 张天华 王西娣 陈美龄 李妍 王蕊
目的 评价耐多药结核分枝杆菌菌株对环丝氨酸(Cs)和对氨基水杨酸(PAS)两种二线抗结核药物的耐药性并分析耐药表型与基因型之间的关联,为我国耐多药结核病的治疗提供科学依据。方法 从2007年全国耐药基线调查点收集的菌株中选取196株耐多药结核分枝杆菌菌株,采用微孔板Alamar blue显色法分别测定对Cs和PAS的最低抑菌浓度(MIC),并采用间隔区寡核苷酸分型法(Spoligotyping)对其进行基因分型。北京基因型与非北京基因型对Cs和PAS耐药率比较采用卡方检验,以P<0.05为差异有统计学意义。结果 196株耐多药结核分枝杆菌菌株中对Cs耐药为44株,耐药率为22.4%(44/196);对PAS耐药为34株,耐药率为17.3%(34/196)。在耐Cs的耐多药结核分枝杆菌菌株中北京基因型为34株,耐药率为21.0%(34/162);34株非北京基因型菌株中耐Cs为10株,耐药率为29.4%(10/34);两者耐药率差异无统计学意义(χ2=1.15,P>0.05)。在耐PAS的耐多药结核分枝杆菌菌株中北京基因型为26株,耐药率为16.0%(26/162);34株非北京基因型菌株中耐PAS为8株,耐药率为23.5%(8/34);两者耐药率差异无统计学意义(χ2=1.10,P>0.05)。结论 我国耐多药结核分枝杆菌对二线抗结核药物Cs和PAS的耐药率处于较高水平。北京基因型家族是我国耐多药结核分枝杆菌中主要流行的菌株,北京基因型与非北京基因型的耐多药结核分枝杆菌菌株对Cs和PAS两种二线抗结核药物耐药率差异无统计学意义。
结核分枝杆菌; 抗药性,多种,细菌; 环丝氨酸; 氨基水杨酸; 基因型
耐药结核分枝杆菌的出现,特别是耐多药结核病 (至少对异烟肼和利福平同时耐药的结核病)患者的出现是造成结核病疫情居高不下的重要原因之一。我国是全球22个结核病高负担国家之一,也是全球27个耐药结核病高负担国家之一[1]。根据WHO《全球结核病控制2010年报》估算,我国结核病年发病患者例数仅次于印度,居世界第二位,而耐药结核病患者例数居世界首位[2]。全国结核病耐药性基线调查报告(2007—2008)显示:涂阳肺结核患者分离的结核分枝杆菌耐多药率为8.32%,广泛耐药率为0.68%,尤以复治患者的耐药性为严重(耐多药率为25.64%,广泛耐药率为2.06%)[3]。随着耐多药结核病患者的日趋增多,异烟肼和利福平等一线抗结核药物常不能满足临床治疗的需要,在我国耐多药结核病的治疗主要依靠二线抗结核药物,其中阿米卡星(Am)、卷曲霉素(Cm)、氧氟沙星(Ofx)等药物在治疗耐多药结核病中起着非常重要的作用,而中国对以上二线抗结核药物耐药性研究较为普遍,但目前尚缺乏耐多药结核病患者对环丝氨酸(Cs)的耐药性的分析。近年来,“北京基因型家族”菌株在结核分枝杆菌的研究中受到广泛关注。这些菌株传播广泛,有时可引起大范围的结核病暴发,在某些情况下又与耐药性有联系。因此笔者选取2007年全国耐药基线调查点收集分离的196株耐多药结核分枝杆菌菌株,主要探讨Cs及对氨基水杨酸(PAS)两种二线抗结核药物的耐药性及耐药表型与基因型之间的关系。
材料和方法
一、菌株来源
2007年全国耐药基线调查点收集的部分菌株,经罗氏培养、生化鉴定并进行比例法药敏试验鉴定为耐多药结核分枝杆菌的菌株,共收集菌株196株。其来源分布见表1,标准菌株H37Rv来源于国家参比实验室菌株库保存标准株。
二、试剂和培养基来源
6种药物敏感性试验(简称“药敏试验”)培养基和对硝基苯甲酸(PNB)培养基、噻吩-2-羧酸肼(TCH)培养基、改良罗氏培养基(L-J)均购自珠海贝索生物技术有限公司,药粉购自美国Sigma-Aldrich公司,7H9液体培养基(7H9粉、OADC)购自美国BD公司,Alamar blue显色液购自美国BIO-RAD公司。
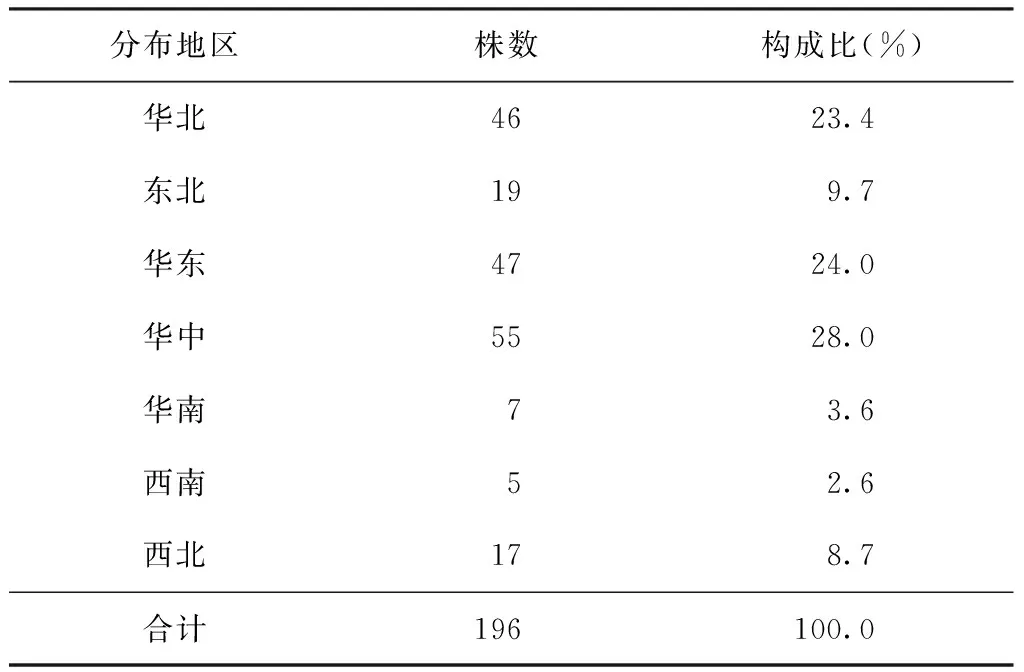
表1 196株耐多药结核分枝杆菌菌株来源分布情况
三、方法
(一)药敏试验及菌种鉴定
药敏试验及分枝杆菌菌种鉴定按照文献[4]操作,药敏试验采用比例法,培养基内药物终浓度分别为异烟肼(INH)0.2 μg/ml、利福平(RFP)40 μg/ml、乙胺丁醇(EMB)2 μg/ml、链霉素(Sm)4 μg/ml、卡那霉素(Km)30 μg/ml、氧氟沙星(Ofx)2 μg/ml。采用PNB生长试验和TCH生长试验对分枝杆菌进行菌种鉴定,培养基中PNB浓度为500 mg/ml、TCH浓度为5 mg/ml。
(二)Cs和PAS的最低抑菌浓度(MIC)测定
采用微孔板Alamar blue显色法,操作方法参照文献[5],使用7H9液体培养基(7H9∶OADC=9∶1),MIC测定的药物浓度:Cs为0.5~512 μg/ml,PAS为0.25~256 μg/ml。药物临界值参照文献[5]推荐的临界浓度,Cs为2.5 μg/ml,PAS为2 μg/ml。取改良罗氏培养基中传代3周后生长良好的菌落进行磨菌、比浊、制备1 mg/ml菌悬液,接种到稀释成不同药物浓度梯度的7H9液体培养基上,37 ℃孵育1周后加Alamar blue显色液显色。以标准菌株H37Rv作为对照。
(三)采用间隔区寡核苷酸分型方法(Spoligotyping法)进行检测
1. DNA模板的制备:实验菌株采用罗氏培养基常规培养3~4周,用生理盐水从L-J培养基斜面上洗脱菌体,吸取菌悬液1 ml于无菌1.5 ml离心管中,80 ℃ 30 min灭活, 12 000×g离心5 min后倒掉上清液,菌体沉淀用500 μl TE缓冲液充分悬浮,95 ℃水浴30 min,12 000×g离心3 min,取上清液即为DNA模板。
2. DR区(又称直接重复区,不同菌株间或同一株菌株内的直接重复区序列高度保守,而间隔区的数量和序列存在多态性,通过比较间隔序列的多态性可以区分不同基因型的菌株)序列PCR扩增:使用Spoligotyping法对菌株的DR区域进行鉴定分型,操作流程按照试剂盒提供的说明书进行(荷兰,Isogn Bioscience BV公司)。引物的序列为DRa:5′-GGT TTT GGG TCT GAC GAC-3′,5′端用生物素标记,用于杂交后发光检测;DRb:5′-CCG AGA GGG GAC GGA AAC-3′,以耐多药结核分枝杆菌菌株基因组DNA为模板进行扩增。PCR反应体系采用50 μl反应体系:PCR预混液25 μl(北京,Genstar公司),DRa 4 μl, DRb 4 μl,DNA模板5 μl,无菌去离子水12 μl。反应条件:94 ℃预变性5 min,94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,扩增整个直接重复(DR)区。同时扩增标准菌株H37Rv、卡介苗(BCG)作为对照。
3. DNA杂交:PCR产物用150 μl 2×SSPE(缓冲液)/0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)稀释,95 ℃变性10 min,立即置于冰水浴中。用250 ml 2×SSPE/0.1%SDS 60 ℃洗膜5 min,置于Miniblotter杂交板内,探针方向与狭缝垂直,吸净狭缝剩余液体,按标本顺序将稀释的PCR产物加入到杂交板的狭缝中,同时加入标准菌株H37Rv、BCG、空白作为对照组,在水平面60 ℃杂交1 h。
4.检测:吸出狭缝中杂交液,用2×SSPE/0.5% SDS于60 ℃洗膜10 min,加入15 ml链霉亲和素-过氧化物酶偶联溶液(15 ml 2×SSPE/0.5%SDS加7.5 μl 500 U/ml链霉亲和素-过氧化物酶偶联物),42 ℃孵育60 min,用2×SSPE/0.5% SDS 42 ℃洗膜2次,2×SSPE室温洗膜2次,使用化学发光系统对膜上的杂交信号进行收集。
5.质量控制:药敏试验、MIC试验均设H37Rv标准菌株作为质控株,菌种鉴定实验在高稀释度菌液对照培养基上生长菌落少于20株,均进行重复试验。间隔区寡核苷酸分型试验均以标准菌株H37Rv、BCG作为质控株,如与标准条带不符合则进行重复试验。
(四)统计学分析
所有Spoligotyping数据提交至国际数据库MIRU-VNTRplus和SpolDB 4.0进行基因型比对。采用SAS 9.2统计学软件进行统计学分析,北京基因型与非北京基因型对Cs和PAS耐药率比较使用卡方检验,以P<0.05为差异有统计学意义。
结 果
一、196株耐多药结核分枝杆菌菌株对Cs和PAS的MIC值分布
结果显示196株耐多药结核分枝杆菌菌株中Cs耐药为44株,敏感为152株,耐药率为22.4%;其中耐药菌株主要分布在药物浓度为2.50 μg/ml和8.00 μg/ml的培养基上,分别为22株(11.2%)和8株(4.1%);敏感株分布在药物浓度为0.50 μg/ml的培养基上50株(25.5%),浓度为1.00 μg/ml者54株(27.6%),浓度为1.25 μg/ml者48株(24.5%)(表2)。PAS耐药为34株,敏感为162株,耐药率为17.3%;耐药株主要分布在药物浓度为8.00 μg/ml、16.00 μg/ml、256.00 μg/ml的培养基上,分别为4株(2.0%)、4株(2.0%)、10株(5.1%)(表3)。
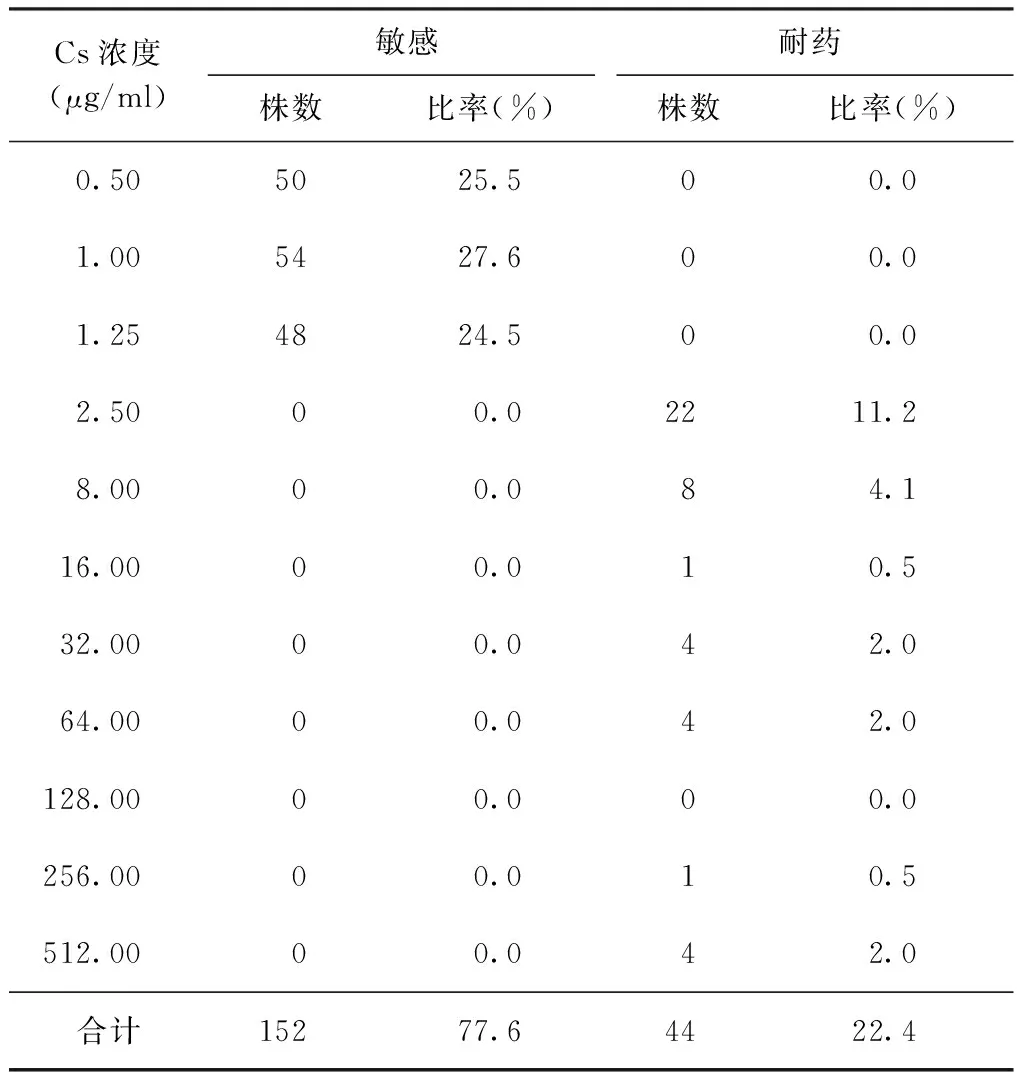
表2 不同Cs浓度在196株耐多药结核分枝杆菌菌株中的分布
注 Cs的MIC临界浓度为2.5 μg/ml
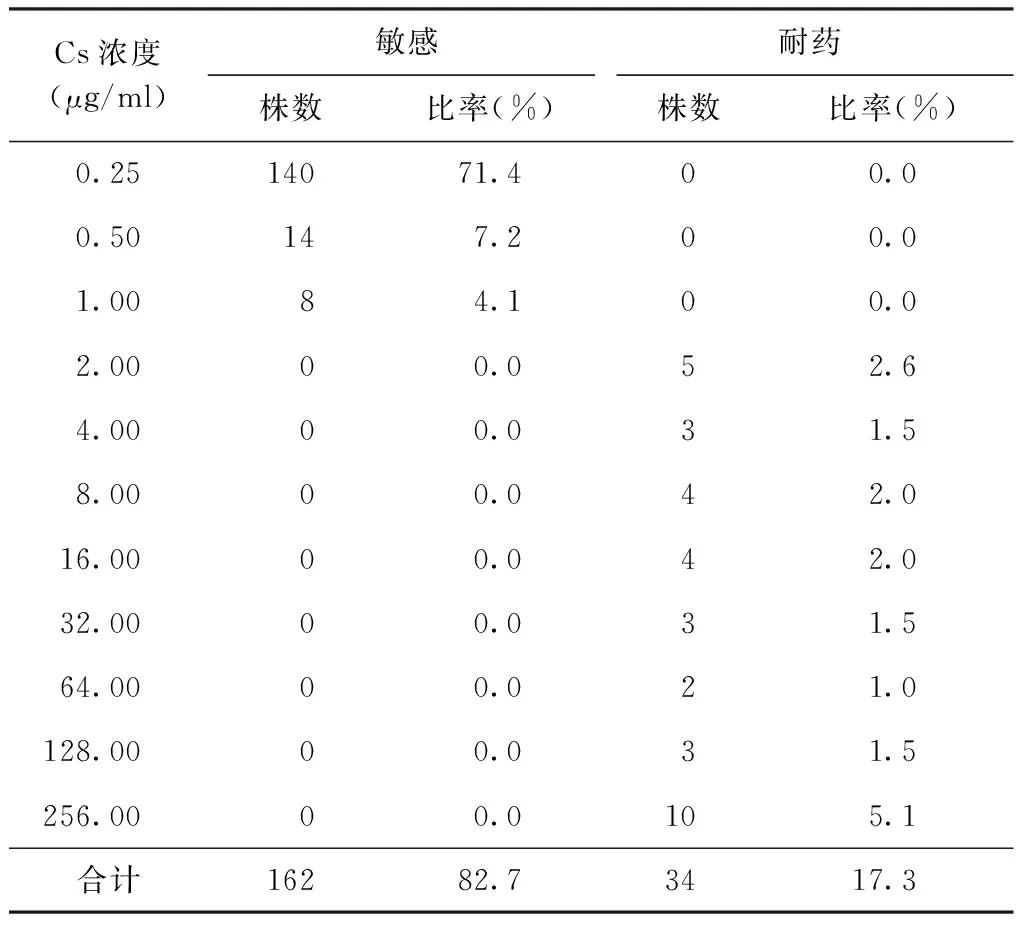
表3 不同PAS浓度在196株耐多药结核分枝杆菌菌株中的分布
注 PAS的MIC临界浓度为2.0 μg/ml
二、196株耐多药结核分枝杆菌菌株在Spoligotyping法中的基因型分布
本研究共分离得到196株耐多药结核分枝杆菌菌株,96.4%(189/196)菌株基因型为数据库MIRU-VNTRplus和SpolDB 4.0内所包含,7株没有匹配到结果,为新发现基因型。其中北京基因型菌株162株,占82.7%(162/196);北京基因型中非典型北京基因型2株,占1.0%(2/196)。非北京基因型菌株34株,占17.3%(34/196)。非北京基因型中T1基因型14株,占7.1%(14/196),非北京基因型中T2基因型11株,占5.7%(11/196),MANU2基因型1株,占0.5%(1/196),S基因型1株,占0.5%(1/196);新发现基因型为7株,共占3.6%(7/196)(表4)。
三、196株耐多药结核分枝杆菌不同基因型的Cs和PAS耐药情况比较
在耐Cs的耐多药结核分枝杆菌菌株中,北京基因型为34株,耐药率为21.0%(34/162);34株非北京基因型菌株中耐Cs为10株,耐药率为29.4%(10/34);两者耐药率差异无统计学意义(χ2=1.15,P>0.05)。在耐PAS的耐多药结核分枝杆菌菌株中,北京基因型为26株,耐药率为16.0%(26/162);34株非北京基因型菌株中耐PAS为8株,耐药率为23.5%(8/34);两者耐药率差异无统计学意义(χ2=1.10,P>0.05)(表5)。
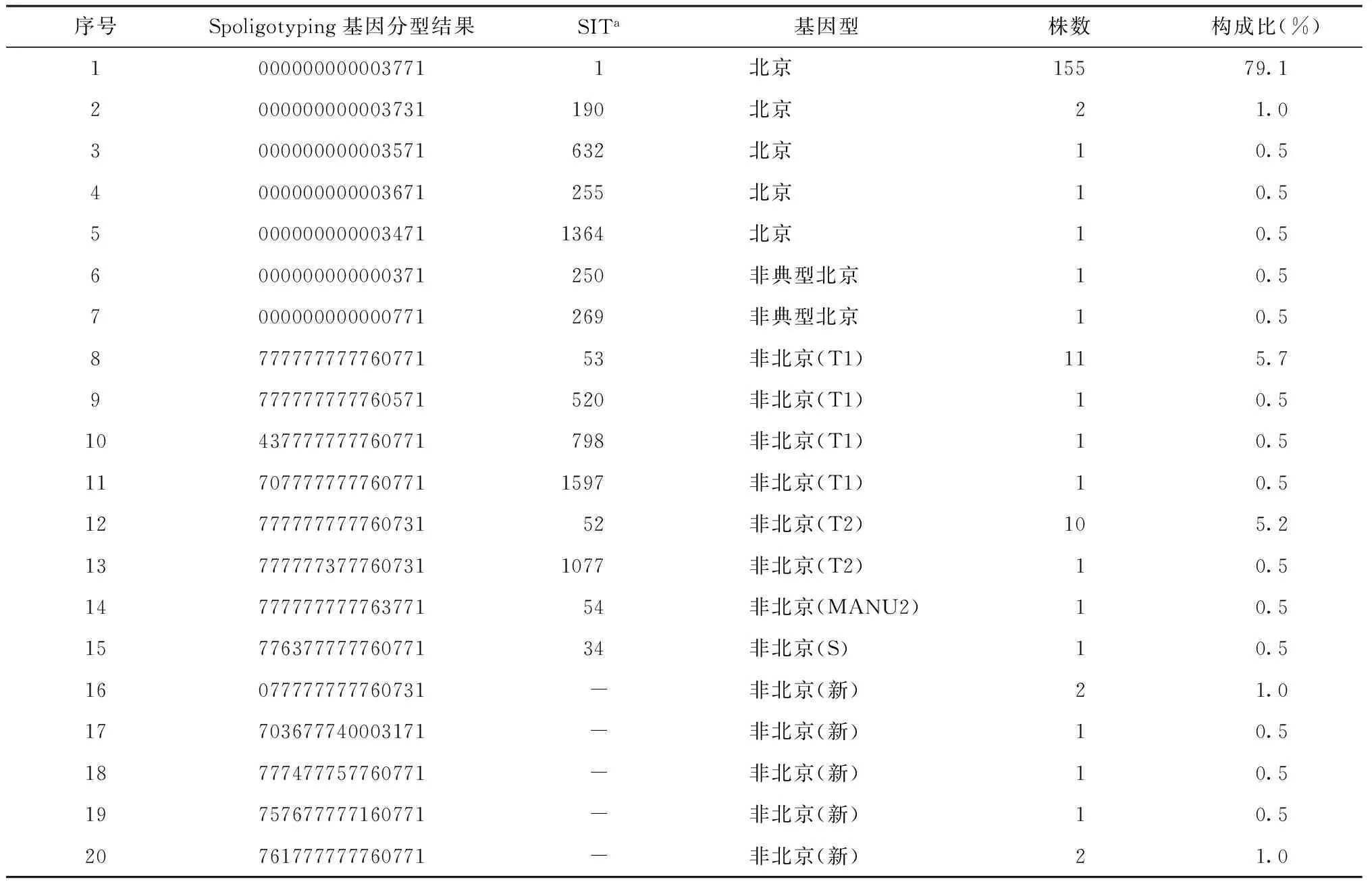
表4 196株耐多药结核分枝杆菌菌株在Spoligotyping法中的基因型分布
注a:数据库MIRU-VNTRplus和SpolDB 4.0中的SIT[Spoligotyping international type(间隔区寡核苷酸分型法国际类型),是数据库定义的一个编码系统,便于索引和匹配]编号;“-”:数据库中无匹配结果;序号1~7为北京基因型,共计162株;序号8~20为非北京基因型,共计34株
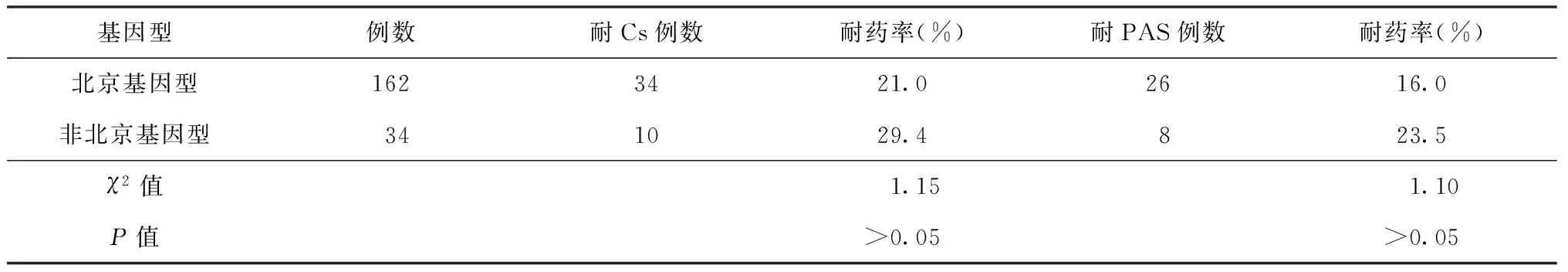
表5 不同基因型耐药率的比较
讨 论
耐药结核病的发生及其流行已成为全球结核病控制的一大难题,为治疗耐多药结核病,二线抗结核药物得到广泛应用,对其耐药性也随之增高。
一、196株耐多药结核分枝杆菌菌株对Cs耐药性分析
早在利福平问世以前,Cs即已成为复治结核病化学治疗方案中的主要药物。近年来耐多药结核病患者日趋增多,异烟肼和利福平等一线抗结核药物常不能满足临床治疗的需要,Cs对结核病的低耐药率受到重视。Cs为D-丙氨酸类似物,可抑制丙氨酸消旋酶、合成酶,抑制细胞壁黏肽产生,使结核分枝杆菌的细胞壁缺损和耐酸能力减弱,起到杀菌和抑菌作用[6]。Cs的耐药率较低,与其他抗结核药物不发生交叉耐药,在用药过程中不易产生耐药性。
据文献报道,1993—2007年荷兰的131例耐多药结核病患者二线抗结核药物药敏试验中,只有1例对Cs耐药,耐药率为0.8%[7],2005年俄罗斯耐多药结核分枝杆菌的Cs耐药率为7.4%,1995—2011年中国香港耐多药结核分枝杆菌中的Cs耐药率只有8.6%[8]。综合以上研究资料来看,Cs较其他二线抗结核药物耐药率低,本研究结果:196株耐多药结核分枝杆菌菌株中对Cs耐药株为44株,耐药率为22.4%,其主要分布在浓度为2.5 μg/ml和8 μg/ml,分别为22株和8株,属于低浓度耐药,与荷兰、俄罗斯、中国香港地区相比耐药率处于较高水平,可能与我国是全球结核病高负担大国,地广人多、经济发展不平衡,耐药结核病情况差异较大[3]和在治疗过程中药物的不规范使用等多种因素有关,这有待于下一步的研究探讨。
二、196株耐多药结核分枝杆菌菌株对Cs耐药性分析
PAS的作用机制尚未肯定,一般认为对氨基水杨酸钠化学结构与对氨基苯甲酸(PABA)相似,可竞争性抑制二氢叶酸合成酶,使二氢叶酸合成障碍,造成蛋白质合成受阻,使细菌不能繁殖。据文献报道:1993—2007年荷兰的131株耐多药结核分枝杆菌中PAS耐药率为4.6%[7];国内对耐多药结核分枝杆菌中PAS的耐药率也有很多报道:2006—2007年北京43株耐多药结核分枝杆菌中PAS耐药率为9.3%[9],2009年上海431株耐多药结核分枝杆菌中PAS耐药率为8.1%[10],2008—2009年浙江25株耐多药结核分枝杆菌菌株中对PAS的耐药率为32.7%[11],2008—2010年江西萍乡22株耐多药结核分枝杆菌菌株中对PAS的耐药率为45.5%[12],2010—2012年江苏无锡77株耐多药结核分枝杆菌菌株中对PAS的耐药率为33.8%[13],从以上数据来看,各地耐多药结核分枝杆菌菌株对PAS耐药率高低各不相同,存在明显地区差异。本研究196株耐多药结核分枝杆菌菌株中PAS耐药为34株,耐药率为17.3%,与以上国内报道的数据相比处于平均水平,但较国外相比仍处于较高水平。
三、耐药性与基因型相关性分析
北京基因型结核分枝杆菌在世界各地广泛流行,并存在明显的地域差别,在亚洲地区较为流行。北京基因型是中国结核分枝杆菌的主要基因型。本研究结果显示,196株耐多药结核分枝杆菌基因型分布具有明显多态性,主要为北京基因型,共162株,占82.7%,表明北京基因型家族是我国耐多药结核分枝杆菌菌株中主要流行的菌株。
由于耐多药北京基因型菌株多次引起暴发流行,北京基因型菌株与耐药性之间的关联成为研究的热点。北京基因型结核分枝杆菌与耐药性密切相关,但不同国家和地区各有不同,有研究表明,俄罗斯、越南和伊朗等国耐药结核病流行主要由北京基因型菌株引起;有些文献报道,在越南胡志明市、爱沙尼亚、美国纽约等地区,北京基因型家族耐药率高于非北京基因型家族;有些报道,在印度尼西亚、阿塞拜疆、哥伦比亚等地区,北京基因型家族与非北京基因型家族耐药率差异无统计学意义,而中国香港北京基因型家族菌株异烟肼耐药率低于非北京基因型家族菌株[14]。本研究结果表明:北京基因型与非北京基因型的耐多药结核分枝杆菌菌株对Cs和PAS两种二线抗结核药物耐药率差异无统计学意义,这在一定程度上表明北京基因型的耐多药结核分枝杆菌菌株流行可能与Cs和PAS耐药性无明显相关性。
有研究表明[14],北京基因型家族又分为古代型与现代型,古代型主要盛行在东南亚、印度等地区,与菌株的耐药性密切相关,而现代型为我国主要流行菌株,与菌株流行传播能力有关,与古代型相比,现代型具有高度的遗传性和致病能力,为进一步探讨耐药表型与基因型的关系,笔者后续会扩大样本量并对北京基因型中古代型和现代型进行流行病学分析。
我国耐多药结核分枝杆菌对二线抗结核药物Cs和PAS的耐药率处于较高水平。北京基因型家族是我国耐多药结核分枝杆菌中主要流行的菌株,北京基因型与非北京基因型的耐多药结核分枝杆菌菌株对Cs和PAS两种二线抗结核药物耐药性无明显相关性。
[1] World Health Organization.Multidrug and extensively drug-resistant TB (M/XDR-TB):2010 global report on surveillance and response[R/OL]. Geneva: World Health Organization,2010[2014-05-12]. http://whqlibdoc.who.int/publications/2010/9789241599191_eng.pdf.
[2] World Health Organization.Global tuberculosis control: WHO report 2010.Geneva:World Health Organization,2010.
[3] 中华人民共和国卫生部.全国结核病耐药性基线调查报告(2007—2008).北京:人民卫生出版社,2010.
[4] 赵雁林,刘志敏.结核病实验室标准化操作与网络建设.北京:人民卫生出版社,2013.
[5] Reham AK, Marwa SN, Ashraf AG, et al. Resazurin Microtiter Assay Plate method for detection of susceptibility of multidrug resistantMycobacteriumtuberculosisto second-line anti-tuberculous drugs. Egyptian Journal of Chest Diseases and Tuberculosis,2013,62(2):241-247.
[6] 谢安,肖和平. 环丝氨酸在治疗耐多药结核病方面的应用.中华结核和呼吸杂志,2012,35(12):949-950.
[7] J.van Ingen,M.J.Boeree,A.Wright,等. 荷兰不同来源耐多药结核病例中二线耐药情况.刘青,译.国际结核病与肺部疾病杂志(中文版),2009,4(2):47-51.
[8] 肖和平. 环丝氨酸治疗耐多药结核病. 中华医学会结核病学分会2012年学术大会论文汇编,2012. 北京:中华医学会结核病学分会,2013:58-61.
[9] 洪峰,邢青,朱建华,等.耐多药肺结核患者二线药敏试验结果分析.中国防痨杂志,2009,31(9):505-507.
[10] 沈鑫,李静,高谦,等.2009年上海市耐药肺结核患者二线抗结核药物耐药状况调查.中华结核和呼吸杂志,2011,34(6):451-453.
[11] 陈松华,王晓萌,柳正卫,等.浙江省耐多药结核病例中二线耐药状况分析.中国预防医学杂志,2011,12(9):761-764.
[12] 胡东华,欧阳福娃,李鹰,等.耐多药结核分枝杆菌对二线抗结核药物的敏感性实验研究.实验与检验医学,2010,28(6):543-545.
[13] 陈惠芬,黄秋生,高爱霞,等.耐多药结核分枝杆菌对二线抗结核药物敏感性观察.南京医科大学学报(自然科学版),2014,34(1):69-71.
[14] 汪晓艳,赵雁林,逄宇,等.重庆市结核分枝杆菌临床分离株的基因分型及相关耐药性分析.中国防痨杂志,2013,35(9):668-672.
(本文编辑:王然 薛爱华)
Analyses on resistance to cycloserine and p-aminosalicylic acid and genotypes in multidrug-resistant M. tuberculosis isolates
YANG Jian*,PANG Yu,ZHAO Yan-lin,ZHANG Tian-hua,WANG Xi-di,CHEN Mei-ling,LI Yan,WANG Rui.
*Tuberculosis Reference Laboratory, Shaanxi Provincial Institute for Tuberculosis Control and Prevention,Xi’an 710048,China
ZHANG Tian-hua,Email:zhthfzhk@126.com; ZHAO Yan-lin,Email:zhaoyanlin@chinatb.org
Objective To evaluate the resistance to cycloserine (Cs) and p-aminosalicylic acid (PAS) in multi-drug resistant (MDR)M.tuberculosisisolates, and analyze the relationship between the genotype and drug-resistant phenotype, which will provide the scientific evidence for MDR-tuberculosis treatment. Methods One hundred and ninety-six MDR-M.tuberculosisisolates were collected from the first tuberculosis drug resistance survey of China conducted in 2007, were detected their minimum inhibition concentrations (MICs) of Cs and PAS by microplate Alamar blue assay, and were analyzed the genotypes by Spoligotyping method. Cs and PAS resistant rates between Beijing genotype and non-Beijing genotype strains were compared using Chi square test,P<0.05 was considered as statistically significant difference. Results Of 196 MDR-M.tuberculosisisolates, 22.4%(44/196) were resistant to Cs, and 17.3%(34/196) were resistant to PAS. 82.7%(162/196)isolates belonged to Beijng geno-type, while 17.3%(34/196) strains belonged to non-Beijing genotypes. Of 162 Beijing genotype strains, 21.0% (34/162)strains were resistant to Cs, while 29.4%(10/34) of non-Beijing genotype strains were resistant to Cs. There were no statistical difference in Cs-resistant rates between Beijing and non-Beijing genotype strains(χ2=1.15,P>0.05). 16.0%(26/162)of Beijing genotype strains were resistant to PAS, while 23.5% (8/34) of non-Beijing genotype strains showed the resistance to PAS. They had no significant difference(χ2=1.10,P>0.05). Conclusion The Cs- and PAS-resistant rates in MDR-M.tuberculosisstrains were high in China. Beijing genotype was the predominant among MDR-M.tuberculosisisolates in China. The Cs- and PAS-resistant rates between Beijing and non-Beijing genotype strains had no significant difference.
Mycobacteriumtuberculosis; Drug resistance, multiple, bacterial; Cycloserine; Aminosalicylic acid; Genotype
10.3969/j.issn.1000-6621.2015.02.002
710048 西安,陕西省结核病防治研究所 结核病参比实验室(杨健、王西娣、陈美龄、李妍、王蕊),办公室 (张天华);中国疾病预防控制中心结核病预防控制中心(逄宇、赵雁林)
张天华,Email:zhthfzhk@126.com;赵雁林,Email:zhaoyanlin@chinatb.org
2014-05-30)

