肿瘤细胞特异启动子hTERT介导的靶向mdr1基因的RNAi用于逆转卵巢癌细胞MDR的研究*
林燕真 程通 张雅丽 李瑞银 杨连威 温兰玲
卵巢癌死亡率居妇科恶性肿瘤之首,患者对化学治疗药物的耐药及多药耐药(MDR)是造成总体预后不良的主要原因之一,如何逆转MDR已成为目前肿瘤化疗研究的热点。研究显示,mdr1基因及其表达产物P-gp蛋白是引起肿瘤细胞产生MDR现象的主要原因[1-2]。故应用RNAi技术抑制肿瘤细胞中mdr1基因的表达,下调P-gp蛋白表达水平是逆转MDR的一种重要方法。目前已有研究显示,靶向mdr1基因的siRNA可用于下调卵巢癌细胞的P-gp蛋白表达水平[3]。而在RNAi技术应用中,除了需要获得具有高效抑制能力的RNAi元件,如何实现RNAi元件在特定组织细胞中的高效特异表达也是十分重要的。P-gp蛋白也存在于人正常组织中,故使RNAi元件的表达仅限于目标肿瘤细胞显得尤为重要。但目前siRNA表达中常规使用的启动子如H1、U6等均缺乏组织特异性,不能满足要求。人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)启动子是一种肿瘤细胞特异性启动子,在大多数正常组织中不具表达活性,已被报道可用于在肺癌、肝癌、卵巢癌等肿瘤细胞中特异表达外源基因[4]。目前,应用hTERT启动子介导RNAi元件用于卵巢癌细胞的MDR逆转研究尚未见报道。本研究即提出了以肿瘤组织特异性hTERT启动子介导靶向mdr1基因的siRNA在卵巢癌细胞中的特异表达,以达到特异性抑制mdr1表达并逆转卵巢癌MDR的目的。本研究结果可为进一步开展逆转卵巢癌MDR研究提供重要基础,现将本研究报道如下。
1 材料与方法
1.1 材料 限制性核酸内切酶、磷酸化酶分别购自大连宝生物工程有限公司、New England Biolabs公司或华美生物工程公司,T4 DNA连接酶购自北京天根公司,Taq酶购自上海生工公司,质粒小量提取试剂盒、胶回收试剂盒为上海华舜公司产品,DMEM培养基、Opti-MEM、Glutamine、细胞培养用非必需氨基酸购自Invitrogen公司,酵母粉购自OXOID公司,配液用水由Millipore公司纯水仪过滤,脂质体Lipofectamine 2000购自Invitrogen公司,细胞培养用胎牛血清(FBS)购自Gibico公司。Dual-Luciferase®双萤光素酶报告基因检测系统购自Promega公司,抗体Phycoerythrin(PE) Anti-Human MDR1购自BD Pharmingen™公司,SYBR PrimeScriptTM RT-PCR kit购 自 TaKaRa公 司,Cell Counting Kit-8试剂购自碧云天公司。
1.2 方法
1.2.1 phTERT-siMDR1B表达载体的构建 在前期研究中已筛选获得1个可高效靶向mdr1基因的siRNA元件siMDR1B[5]。其靶序列为:5’-AGAAAGAACTTGAAAGGTA-3’(位于 mdr1基因序列的1230~1248 nt)。以靶向HBV基因的B245作为对照[6]。合成各siRNA靶点序列所对应的siRNA引物(表1),引物两端分别引入Hind Ⅲ与Bgl Ⅱ酶切位点,经退火处理后与Bgl Ⅱ/Hind Ⅲ双酶切处理的pBT-del-279载体连接,经酶切及测序鉴定后获得携带hTERT启动子引导的siMDR1B表达元件的表达载体phTERT-siMDR1B及对照质粒phTERT-B245。

表1 siRNA合成的引物序列
1.2.2 报告质粒的构建 合成PCR引物(表2)扩增mdr1基因上不包含和包含siMDR1B靶点所在位置的约250 bp长度的DNA序列(MT1和MT2),其中siMDR1B靶点序列位于MT2序列中。PCR产物分别与pMD18-T载体连接,经酶切及测序鉴定获得含单倍体靶序列的质粒pT-T。pT-T经BamH Ⅰ/EcoR Ⅰ双酶切后回收目的片段,再与经Bgl Ⅱ/EcoR Ⅰ双酶切处理的pT-T载体连接获得含双倍体靶序列的pT-TT。pT-TT经BamH Ⅰ/EcoR Ⅰ双酶切后回收双倍体靶序列片段,与经同样双酶切处理的pST-luc载体连接,经酶切鉴定得到分别含不同区段双倍体靶序列的报告质粒pSTluc-MT1和pSTluc-MT2。

表2 报告质粒PCR扩增引物序列
1.2.3 荧光素酶活性检测 在24孔培养板中每孔铺入2×105个细胞,12 h后换液,将携带待检测启动子-luc报告基因表达元件的质粒用脂质体对细胞进行转染,质粒用量为0.6 μg。转染后48 h裂解细胞,检测细胞裂解液中的荧光素酶活性。检测试剂为Promega公司产品Dual-Luciferase®双萤光素酶报告基因检测系统,检测过程参照说明书进行。
1.2.4 流式细胞术检测转染后细胞中P-gp蛋白的表达 转染48 h后消化细胞制成细胞悬液,收集约1×106个细胞,1000 r/min离心3 min,预冷的PBS洗1次。用1 mL含5%血清的PBS重新悬浮细胞,4 ℃孵育10 min,1000 r/min离心3 min去上清。加入含5%Phycoerythrin(PE) anti-human MDR1 的 PBS 100 μL,4 ℃避光孵育60 min,离心弃上清。用PBS洗涤2次,加入1 mL PBS重悬细胞。使用EPICS XL流式细胞仪进行检测,数据应用CellQuest软件进行分析。
1.2.5 RT-PCR方法检测细胞中mdr1基因的mRNA水平 细胞经消化后,用Trizol试剂提取细胞总RNA,逆转录获得cDNA。以cDNA为模板进行PCR检测,以细胞看家基因GADPH为对照。mdr1的PCR扩增引物序列为:mdr1f:5’-ATGTAAGGTTTCTACGGGA-3’;mdr1r:5’-ATCCACGGACACTCCTACG-3’。PCR 反应条件:94 ℃ 10 min,94 ℃ 50 s,54 ℃ 50 s,72 ℃50 s,30 个循环,72 ℃ 10 min。取 3 μL PCR.产物行1.5 g/L琼脂糖凝胶电泳,紫外照相并进行扫描分析,重复检测3次。
1.2.6 CCK8 kit检测转染后细胞紫杉醇药物半数致死量(IC50)[7]预先在24孔板上进行共转染实验(具体方法同前),36 h后将24孔板上的细胞消化并重新铺到96孔板,细胞数量为5000个/孔。12 h后分别加入不同浓度的紫杉醇(分别为32 000、8000、2000、500、125、32、8、2、0 ng/mL), 孵育24 h后再加入10 μL CCK8溶液,37 ℃ 5% CO2孵育3 h,检测OD450/OD620值。根据寇氏改良公式:抑制率=(未处理细胞的OD值-处理后细胞的OD值)/未处理细胞的OD值[7]。计算不同浓度的紫杉醇的抑制率,并利用IC50计算软件计算出药物的IC50。
2 结果
2.1 hTERT启动子在卵巢癌细胞的表达活性 hTERT启动子在卵巢癌细胞A2780可有效启动luc报告基因的表达,而在人二倍体细胞MRC-5中没有显示出表达活性,见图1。

图1 不同细胞hTERT启动子转录活性比较
2.2 hTERT启动子介导的靶向mdr1的siRNA的表达载体构建 本研究构建的hTERT启动子介导的siMDR1B可获得良好的抑制效果,可有效抑制pSTluc-MT2的表达,体现出良好的抑制特异性,见图2。
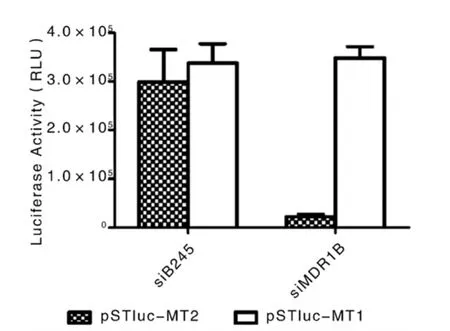
图2 hTERT启动子引导的靶向mdr1的siRNA的抑制效率
2.3 hTERT启动子介导的siMDR1B对mdr1基因转录与表达的抑制效果 phTERT-siMDR1B转染细胞的mdr1的mRNA水平低于对照组细胞,说明了hTERT启动子介导的siMDR1B表达可有效抑制靶基因mdr1的mRNA水平;与转染对照组细胞相比,转染phTERT-siMDR1B细胞中的P-gp蛋白活性明显降低,与转染对照组细胞比对P-gp蛋白的抑制效率为65.5%,hTERT启动子介导的siMDR1B对mdr1基因表达具有较好的抑制效果。见图3。

图3 siMDR1B在转染后细胞中对mdr1基因mRNA水平及蛋白水平的抑制效果
2.4 hTERT启动子介导的siMDR1B逆转卵巢癌细胞MDR 与对照组相比转染了hTERT启动子介导的siMDR1B表达元件的细胞对紫杉醇的耐药程度显著降低,hTERT启动子介导的siMDR1B能够用于卵巢癌细胞的MDR逆转。见图4。

图4 hTERT启动子介导的siMDR1B对紫杉醇的耐药程度
3 讨论
紫杉醇是卵巢肿瘤化疗常用药之一,肿瘤细胞对包括紫杉醇在内的治疗药物产生多药耐药(MDR)是导致对肿瘤化疗失败的重要原因。研究显示,肿瘤细胞中mdr1基因编码的P-gp蛋白过表达与MDR产生密切相关[8]。通过抑制肿瘤细胞中mdr1基因的表达可实现肿瘤细胞的耐药逆转[9]。RNAi技术可用于特异、高效地抑制细胞内靶基因的表达,在抑制mdr1基因以及MDR逆转研究中具有良好的应用潜力。已有研究显示,靶向mdr1基因的siRNA可抑制骨肉瘤、肾癌、肺癌、肝癌、卵巢癌细胞中的mdr1表达并逆转耐药[10-12]。然而在RNAi抗肿瘤研究中,实现siRNA对肿瘤组织细胞的特异性导入或表达是十分重要的,特别是以在一些正常组织细胞中也有表达的mdr1基因作为抑制靶标时。本研究构建了肿瘤细胞特异性启动子hTERT引导的靶向mdr1基因的siRNA表达元件,并证明其可在卵巢癌细胞中特异表达并有效抑制mdr1基因,并可逆转卵巢癌细胞对紫杉醇药物的耐药,为进一步应用RNAi技术开展卵巢癌MDR逆转研究提供了重要基础。
人类卵巢组织较为复杂,也是全身各脏器中肿瘤类型最多的部位,卵巢肿瘤细胞也缺乏特异的标志物,因此研究可针对相关肿瘤细胞的靶向技术对于发展更为高效的卵巢肿瘤治疗方法是十分重要的。靶向转录是一种有效的可实现治疗分子如siRNA在目标细胞中表达的重要策略[13]。靶向转录技术是利用组织和细胞特异性启动子控制基因的转录,从而使治疗基因元件如siRNA表达元件可在特定的细胞中表达以达到靶向治疗的目的。目前尚未发现可特异靶向卵巢肿瘤细胞的启动子。hTERT是端粒酶的限速酶,对端粒酶的活性调控起重要作用。hTERT启动子已被发现是一种肿瘤细胞特异性启动子,可在包括肺癌、乳腺癌等多种肿瘤细胞中均具有表达活性[14]。本研究结果显示,hTERT启动子在卵巢肿瘤细胞中也具有良好的转录活性,具有较好的肿瘤细胞特异性和有效性。
包括hTERT启动子在内目前已鉴定获得多个具有肿瘤细胞特异性的启动子,其中部分已应用于肿瘤治疗方法研究。根据其对肿瘤细胞的转录活性可分为3类,第1类为可靶向多数肿瘤细胞的启动子,如hTERT启动子、P53启动子、survivin启动子等;第2类为靶向特定肿瘤细胞的启动子,如肝癌细胞特异的AFP启动子、结肠癌特异的CEA启动子等;第3类为可特异靶向特定组织细胞的启动子,如前列腺细胞特异性抗原启动子(PSA启动子)等。这些启动子均为RNA聚合酶Ⅱ类启动子。在siRNA表达中通常使用的是RNA聚合酶Ⅲ类启动子,如U6、H1启动子,这些启动子在引导siRNA表达中具有较强的转录活性,然而往往容易造成表达过量而影响细胞正常功能,相对而言RNA聚合酶Ⅱ类启动子具有较广的选择范围,包括许多组织特异性或诱导型启动子,从而有利于对siRNA脱靶效应的控制[15]。然而,RNA聚合酶Ⅱ类启动子是否可应用于siRNA的有效表达尚未获得充分的确定。目前已有研究显示,一些组织特异性启动子如T7启动子可用于介导siRNA在特定组织中的表达和抑制作用[6]。本研究结果证明,hTERT启动子作为RNA聚合酶Ⅱ类启动子可以介导靶向mdr1基因的siRNA在卵巢肿瘤细胞中的特异表达,并逆转卵巢肿瘤细胞MDR。由于hTERT启动子在包括肺癌、肝癌、卵巢癌等其他多种肿瘤细胞中均具有表达活性,该基因治疗策略配合化疗药物有望能够扩大治疗的覆盖范围,有利于更大限度地抑制肿瘤和转移瘤的生长,具备较好的应用潜力。在导入方法改进上,hTERT启动子介导的siRNA表达元件可克隆入溶瘤病毒中,以实现双重靶向调控作用,并利用溶瘤病毒的自我扩增作用加强siRNA元件的表达,以达到更好的抑制肿瘤的效果。本研究结果可为进一步开展卵巢肿瘤MDR逆转和治疗方法研究提供基础。
[1] Leith C P,Chen I M,Kopecky K J,et al.Correlation of multidrug resistance(MDR1) protein expression with functional dye/drug efflux in acute myeloid leukemia by multiparameter flow cytometry:identification of discordant MDR-/efflux+ and MDR1+/efflux- cases[J].Blood,1995,86(6):2329-2342.
[2]李金枝.金属硫蛋白的生物学特性与生理作用[J].微量元素与健康研究,1995,12(4):62-63.
[3] Stege A,krühn A,Lage H.Overcoming multidrug resistance by RNA interference[J].Methods Mol Biol,2010,596:447-465.
[4] Komata T,Kanzawa T,Kondo Y.Telomerase as a therapeutic target for malignant gliomas[J].Oncogene,2002,21(4):656-663.
[5]林燕真,张雅丽,等.靶向肿瘤多药耐药基因mdr1的siRNA的构建与鉴定[J].厦门大学学报(自然科学版),2012,51(3):391-396.
[6] Zhang P,Chen Y,Jiang X,et al.Tumor-targeted efficiency of shRNA vector harboring chimera hTERT/U6 promoter[J].Oncol Rep,2010,23(5):1309-1316.
[7] Soothill J S,Ward R,Girling A J.The IC50:an exactly defined measure of antibiotic sensitivity[J].Antimicrob Chemother,1992,29(2):137-139.
[8]蒋知俭.医学统计学[M].北京:人民卫生出版社,1999:138-140.
[9] Kobayashi H,Dorai T,Holland J F,et al.Reversal of drug sensitivity in multidrug-resistant tumor cells by an MDR1(PGY1) ribozyme[J].Cancer Res,1994,54(5):1271-1275.
[10] Susa M,Iyer A K,Ryu K,et al.Inhibition of ABCB1 (MDR1)expression by an siRNA nanoparticulate delivery system to overcome drug resistance in osteosarcoma[J].PLos One,2010,5(5):e10 764.
[11]楼江燕,彭芝兰,郑莹,等.小干扰RNA诱导人卵巢癌细胞MDR1基因沉默的研究[J].四川大学学报(医学版),2007,38(5):753-755.
[12] Carlos G,Midha L A,Lee S D,et al.Abstract 3532:P-glycoprotein downregulation using RNAi decreases cholesterol efflux from human renal cancer cells[J].Cancer Res,2010,70(8 Suppl):3532.
[13] Rajendran S,Collins S,van Pijkeren J P,et al.Targeting of breast metastases using a viral gene vector with tumour-selective transcription[J].Anticancer Res,2011,31(5):1627-1635.
[14] Takakura M,Kyo S,Kanaya T,et al.Cloning of human telomerase catalytic subunit(hTERT) gene promoter and identification of proximal core promoter sequences essential for transcriptional activation in immortalized and cancer cells[J].Cancer Res,1999,59(3):551-557.
[15] Boden D,Pusch O,Silbermann R,et al.Enhanced gene silencing of HIV-1 specific siRNA using microRNA designed hairpins[J].Nucleic Acids Res,2004,32(3):1154-1158.

