一株酵母菌的鉴定及其挥发性物质防病测定
黄 蓉,黄 盼,黄瑞荣,李国庆*
(1.江西省农业科学院 植物保护研究所,江西 南昌 330200;2.华中农业大学 湖北省作物病害监测与安全控制重点实验室,湖北 武汉 430070)
草莓灰霉病是草莓大棚生产中及采后草莓储藏期的重要病害之一,也是导致草莓的产量和质量降低的主要因素之一[1]。大棚草莓发生灰霉病后,每年能造成10% ~30%的减产,在雨水较多的年份则可能达到50%以上的减产[2],并且灰霉病在草莓整个生长期和草莓果实储藏期,均能引发危害。目前对草莓灰霉病的防治主要还是依靠喷洒杀菌剂、温湿调控度和清除病残体。而长期使用杀菌剂导致的灰葡萄孢产生抗药性及残留等问题,已引起大众关注,包括生物防治在内的替代防治技术迫切需要发展[3]。
酵母菌因为其所具有的丰富的酶系和多种经济价值很高的生理生化活性物质,而广泛地应用于人们的生活中。而作为生防菌,酵母菌的优势也很明显。除了用途广泛、容易获得外,酵母菌的适应力强、繁殖快,对环境的要求不高,抗逆能力强,生产工艺及流程已较为成熟。一些酵母菌还可以和其他的杀菌剂合用,从而提高对病害的控制作用,降低杀菌剂的使用剂量[4]。因此酵母菌近年来越来越受重视。
对于酵母菌的分类鉴定,传统的方法主要是通过形态特征的观察和生理生化特性的测定。随着分子生物学和现代微生物分类学的不断发展,从遗传进化等角度解决微生物种群之间和种内存在的相互关系问题,也是客观的需求,因而,分子生物学的方法也被广泛地应用于酵母菌的分类鉴定上。
至今已有不少研究人员展开了对于酵母菌作为生防菌的控制机理的研究。若植物上的酵母菌数量的变化,即浓度的变化会影响酵母菌的生控作用,则说明酵母菌与别的病原菌间存在营养和空间的竞争[5]。若与此同时引起了植物体内某些酶的产生或是量的变化而控制病害的发生,则说明酵母菌诱发了植物自身抗性[6]。前期研究发现酵母菌可以不接触植物组织,通过产生抑菌性挥发性物质这一方式来控制病害[7-8]。因此,释放挥发性抑菌物质也成为酵母菌的防病机理之一,且这一机制具有巨大的应用空间。目前已有可产生挥发性抑菌物质的真菌被开发为生物杀菌剂来防治植物病害。如植物内生真菌Muscodor albus菌株CZ-620已被作为生物杀菌剂来防治水果收获后储藏期病害、甜菜苗期病害、胡椒根腐病、茄子枯萎病、植物线虫病害和建筑物腐霉[9-15]等。
本文针对前期工作中筛选得到的一株从草莓植株上分离得到的酵母菌菌株W4682来进行探讨。明确其分类地位,并测定其挥发性物质对灰霉病的抑制能力,为以后生产应用工作的开展奠定基础。
1 材料与方法
1.1 试验菌株
从不同地区采集回来的草莓植株样品中共分离得到1151株酵母菌菌株,经过平板对峙培养测定和离体叶片及果实菌体接种测定的层层筛选,获得菌株W4682可以有效防治草莓灰霉病的酵母菌菌株。灰葡萄孢(Botrytis cinerea)菌株STBC-1分离自罹病草莓果实。
1.2 ITS-5.8S rDNA 序列分析
采用CTAB法提取酵母菌总DNA,于PDA平板上20℃进行菌株活化,3 d后将新鲜菌体涂布到铺有灭菌玻璃纸的PDA平板上培养,2 d后用少量无菌水从PDA培养基上将新鲜的酵母菌菌体洗下,装在离心管中,放在离心机中以10 000 r/min的速度离心1 min,收集的菌体放入已预冷的研钵中,将液氮倒入研钵中,使菌细胞冷冻,同时迅速研磨酵母菌的菌体,使之成为粉末状。提取DNA的方法参照文献[16]。采用50 μL的反应体系进行PCR扩增。扩增引物ITS1/ITS4的设计参考文献[17],PCR扩增程序参照文献[18]。取5 μL PCR扩增产物,在10 g/L琼脂糖凝胶中电泳检测(110 V,1 h)扩增产物大小。使用回收试剂盒 AxyPrepTMDNA Gel Extraction Kit(Axygen Scientific,Inc.Union City,USA)对 PCR产物进行回收纯化后,将PCR产物连接到pMD18-T载体(TaKaRa Biotechnology Co.,Ltd.,Dalian,China)上,转入大肠杆菌(Escherichia coli DH5α)细胞。挑选阳性克隆送往北京赛诺生物工程技术服务有限公司进行序列测定。将测得的基因序列在GenBank核酸数据库(http://www.ncbi.nlm.nih.gov/blast)中通过BLAST程序进行对比分析。
1.3 形态及生物学鉴定
分子测序比对的结果与几个种的相似度都很高,因而按照《酵母菌的特征与鉴定手册》中所描述方法分别进行单菌落单细胞特征观察试验,假菌丝形成试验,子囊孢子诱导试验,糖发酵测定,碳源、氮源和醇类同化试验,产生类淀粉化合物测定,高渗透压培养测定,产酸、产酯测定,尿素水解试验,缺素生长测定和生长温度测定等试验[19],对菌株分类地位加以确认。
1.4 酵母菌产生的挥发性物质对灰霉菌菌丝生长的抑制测定
采用双皿对扣法[7]测定菌株W4682生长过程中产生的挥发性成分对灰葡萄孢生长的影响。将100 μL菌株W4682悬液(108cells/mL)均匀涂布在YEPDA平板(酵母提取浸粉10 g,葡萄糖20 g,蛋白胨20 g,琼脂20 g,蒸馏水1 L,pH 6.0左右)上。1 d后,在另外的PDA平板中央接种直径为6 mm的灰葡萄孢菌丝块。将2个培养皿盖去掉,皿底口对口扣在一起,YEPDA平板在下,PDA平板在上,用封口膜封口。在对照处理中,对扣皿中的YEPDA平板没有接种菌株W4682,而PDA平板上仍然接种灰葡萄孢菌丝块。将2种处理的对扣皿置于20℃下培养3 d,测量灰葡萄孢菌落直径。各处理设3次重复,整个试验重复3次。
1.5 酵母菌产生的挥发性物质对储藏期草莓灰霉病的防治
将100 μL新鲜酵母细胞悬浮液(108cells/mL)涂布在YEPDA平板上,20℃下培养1 d,用无菌水将平板上的酵母菌体洗下,血球计数板计算每皿生物量。用75%的乙醇对试验用的干燥器和草莓进行表面消毒,无菌水洗涤。在6个干燥器底部依次放入培养1 d的酵母菌株W4682平板0,2,4,6,8,10个,分别记为处理CK,W2,W4,W6,W8,W10,另外取一个干燥器,在干燥器底部先铺一定量的活性炭,然后将另外的10个平板置于活性炭上,记为处理WAC。盖上隔板,将晾干后的草莓置于隔板上,14颗果每板,每果接种100 μL灰霉菌孢子悬浮液(106cells/mL),加盖密封,20℃下培养7 d后,记录发病率及发病程度。病级严重度划分参照文献[7]。试验重复3次。
1.6 酵母菌定殖草莓果实产生挥发性物质对草莓灰霉病的防治
将20颗草莓进行表面消毒后浸泡在新鲜酵母细胞悬浮液(108cells/mL)中5 s,取出后晾干,置于消毒的干燥器底部,加盖密封,20℃下培养1 d后,将另外20颗草莓进行表面消毒后,直接放于另一消毒的干燥器底部,在2个干燥器隔板上分别放置14颗新鲜草莓,加盖密封,20℃下培养。同时进行空白对照处理,即仅在干燥器隔板上放置14颗草莓,底部不做任何添加。7 d后记录发病率和发病程度。病级严重度划分同上。试验重复3次。
1.7 数据统计与分析
用 SAS 软件(SAS Institute,Version 8.0,Cary,NC,USA,1999)中的方差分析(ANOVA)程序和 Duncan氏新复极差法分析各试验中不同处理之间的差异。用t测验比较2种处理之间的差异显著性。
2 结果与分析
2.1 ITS-5.8S rDNA 序列分析
扩增后获得酵母菌菌株W4682的ITS-5.8S rDNA片段大小均为618 bp,经过使用BLAST程序将获得的序列与在GenBank数据库中已经上传注册的ITS-5.8S rDNA序列进行同源比对分析后,证实该菌株与Debaryomyces hansenii、Candida saitoana、Candida glaebosa和Filobasidiella neoformans这几个种的相似度都很高。将所获序列提交GenBank,登录号为GQ913348。
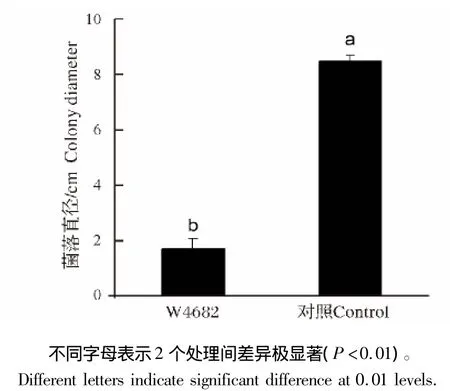
图1 菌株W4682产挥发性物质对灰霉菌丝生长的抑制效果(20℃,3 d)Fig.1 Effect of the volatile organic compounds produced by the strain W4682 on mycelial growth of B.cinerea(20 ℃,3 d)
2.2 形态及生物学鉴定
将形态及生物学测定的结果对照《酵母菌的特征与鉴定手册》里的酵母菌检索表进行检索[19],菌株W4682可发酵D-葡萄糖,可同化赤藓糖醇生长,不可同化硝酸盐生长,可同化蔗糖生长,不可同化L-鼠李糖生长,可同化棉子糖生长,可同化蜜二糖生长,不可同化D-阿拉伯糖生长,不可同化乳糖生长,无生物素时可生长,不可同化淀粉生长,0.01%放线菌酮条件下不生长,形成假菌丝不产生有隔菌丝。因此,酵母菌菌株W4682应为:子囊菌门(Ascomycota)、半子囊菌纲(Hemiascomycetes)、酵母菌目(Saccharomycetales)、酵母菌科(Saccharomycetaceae)、德巴利酵母属(Debaryomyces)、汉逊德巴利酵母Debaryomyces hansenii。
2.3 酵母菌产生的挥发性物质对灰霉菌菌丝生长的抑制
在接种灰葡萄孢和菌株W4682的对扣皿处理中,3 d后PDA平板上的灰葡萄孢菌落直径为1.7 cm,而在仅接种灰葡萄孢的对扣处理中,灰葡萄孢直径达到8.5 cm。2种处理之间灰葡萄孢菌落直径差异性达到极显著水平(图1)。在接种灰葡萄孢和菌株W4682的对扣皿处理中,2种真菌在空间上是分离的,灰葡萄孢菌丝生长受到抑制说明菌株W4682在生长时利用YEPDA中的养分产生了挥发性抗真菌物质。
2.4 酵母菌产生的挥发性物质对储藏期草莓灰霉病的防治
干燥器中每皿的酵母菌生物量约为1010cells,因此处理CK,W2,W4,W6,W8,W10中酵母菌的生物量呈梯度上升,处理WAC中酵母菌的生物量与处理W10相同。如图2所示,CK发病最为严重,果实的平均发病严重度为7.4,平均发病率为100.0%,菌丝布满草莓。W2,W4,W6,W8,W10的发病程度则依次减轻。W2处理中草莓果实的平均发病严重度为5.8,平均发病率为100.0%;W4处理中草莓果实的平均发病严重度为3.7,平均发病率为71.4%;W6处理中草莓果实的平均发病严重度为1.1,平均发病率为57.1%;W8处理中草莓果实的平均发病严重度为0.3,平均发病率为28.6%;W10处理中草莓果实的平均病害严重度为0.2,平均发病率为21.4%。由此可见,草莓的发病程度与酵母菌的生物量是呈负相关的。而在WAC处理中草莓果实平均严重度恢复至6.7,平均发病率上升至100.0%,与CK处理的结果间没有显著差异。由此说明干燥器底部的酵母菌体可以释放出挥发性抑菌物质,使发病程度降低,而添加的活性炭可以将这些挥发性物质吸附,减少其对灰霉菌侵染草莓的影响。

图2 菌株W4682产生的挥发性物质对储藏期草莓灰霉病的防治效果Fig.2 Effect of the volatile organic compounds produced by the strain W4682 on suppression of botrytis fruit rot of strawberry
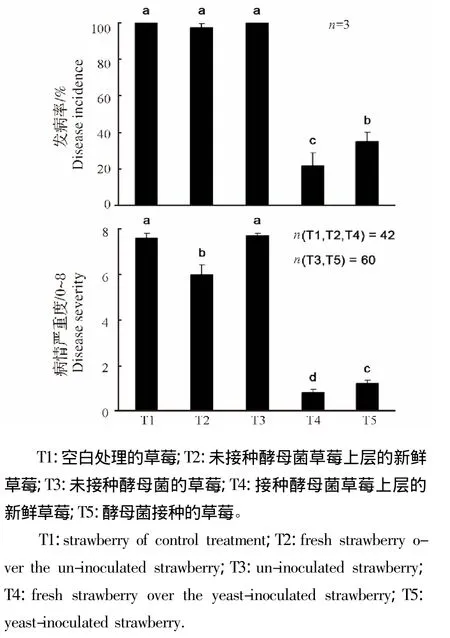
酵母菌定殖草莓果实产生挥发性物质对草莓灰霉病的防治效果Effect of the volatile organic compounds from yeast-infested fruits of strawberry on suppression of botrytis fruit rot of strawberry
2.5 酵母菌定殖草莓果实产生挥发性物质对草莓灰霉病的防治
从图3和图4的结果中可知,当干燥器底部为空白时,隔板上放置的草莓果实其平均发病率为100.0%,平均病情严重度为7.6(T1);当干燥器底部为未接酵母菌的草莓果实时,隔板上放置的草莓果实的平均发病率为97.6%,平均病情严重度为6.0(T2),底部的草莓果实平均发病率为100.0%,平均病情严重度为7.7(T3);而当干燥器底部为接种酵母菌W4682的草莓果实时,隔板上放置的草莓果实平均发病率仅为21.4%,平均病情严重度为0.8(T4),且底部的草莓果实平均发病率也仅为35.0%,平均病情严重度为1.2(T5)。很明显未接种酵母菌的草莓无法抑制草莓灰霉病发生,而草莓接种了酵母菌W4682后不仅可以控制被接种果实的病害发生,还可以产生挥发性抑菌物质,控制隔板上未接种酵母菌的草莓上病害的发生。

图4 酵母菌定殖草莓果实产生挥发性物质对草莓灰霉病的防治效果Fig.4 Effect of the volatile organic compounds from yeast-infested fruits of strawberry on suppression of botrytis fruit rot of strawberry
3 结论
随着分子生物学技术的发展,发现ITS-5.8S rDNA结构既具保守性(反映生物物种的亲缘关系),又具高变性(揭示生物物种的特征核酸序列)[20]。测定ITS-5.8S rDNA的序列已经被作为酵母菌鉴定及系统进化研究的重要手段,测定的结果也已成为研究酵母菌分类的必要数据。但在某些情况下,单独使用ITS-5.8S rDNA的序列测定是无法确定其分类地位的。只有同时采用传统的形态特征和生物学特性的分类鉴定法[21],才能确保鉴定结果的准确性,更客观地反映菌株的实际分类地位,得到更为可靠的结果。因而经形态学、生物学及ITS测定后,鉴定菌株W4682为汉逊德巴利酵母(Debaryomyces hansenii)。目前报道的汉逊德巴利酵母防病机制主要包括竞争营养和空间、诱导植物产生抗性[22-23],本文中证实了汉逊德巴利酵母菌株W4682产生的挥发性物质同样对灰霉菌的生长及灰霉病的发生都有较好的抑制作用,是其主要防病机理之一。这是首次报道汉逊德巴利酵母产生的挥发性物质有抑菌效果和防病能力。
汉逊德巴利酵母菌株W4682接种草莓后不仅可以在被接种果实上定殖,控制其病害发生,还可以产生挥发性抑菌物质,控制同一密闭空间内未接种的草莓上病害的发生。因此,在获得相同防病效果的前提下,可以使酵母菌在田间和储藏期的应用更为方便,使生防酵母菌的实际施用剂量降低,为实际生产应用提供了有利的条件。据报道,汉逊德巴利酵母可以防治芒果炭疽病和蒂腐病,甜樱桃褐腐病,桃软腐病,苹果青霉病,柑桔绿霉病、青霉病和酸腐病等储藏期病害[22,24-27]。但本研究中没有测定菌株W4682产生的挥发性物质对其它果实致腐真菌的防治效果,为了开发应用工作的展开,其防病广谱性的测定,需要进一步研究探讨。虽然本研究中所用的汉逊德巴利酵母菌株分离于健康的草莓叶片组织,且汉逊德巴利酵母是干酪中最常见的酵母菌之一,对干酪的成熟起着重要的作用[28],其相关研究屡见不鲜,但也有报道称其是人类条件致病菌[29],因此分析验证菌株W4682产生的挥发性物质组分以及检测好菌株本身的安全性问题,都是下一步工作必须要解决的重点。
[1]Jarvis W R.The Biology of Botrytis[M].London:Academic Press,1980:1-17.
[2]罗军.金华市金东区2种不同品种草莓灰霉病的发生情况调查[J].安徽农学通报,2009,15(23):124-129.
[3]葛绍荣,牛莉娜,李铭.番茄灰霉病害及其微生物防治的研究进展[J].生物加工过程,2007,5(3):15-19.
[4]Qin G Z,Tian S P.Biocontrol of postharvest diseases of jujube fruit by Cryptococcus laurentii,combined with a low dosage of fungicides under different storage conditions[J].Plant Disease,2004,88(5):497-501.
[5]Pusey P L,Stockwell V O,Mazzola M.Epiphytic bacteria and yeasts on apple blossoms[J].Biological Control,2009,99(5):571-581.
[6]Zhao Y,Tu K,Shao X F,et al.Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit[J].Postharvest Biology and Technology,2008,25(3):1018-1016.
[7]Huang R,Li G Q,Zhang J,et al.Control of postharvest Botrytis fruit rot of strawberry by volatile organic compounds of Candida intermedia[J].Phytopathology,2011,101(7):859-869.
[8]Huang R,Che H J,Zhang J,et al.Evaluation of Sporidiobolus pararoseus strain YCXT3 as biocontrol agent of Botrytis cinerea on post-harvest strawberry fruits[J].Biological Control,2012,62(1):53-63.
[9]Schöler C E G,Gürtler H,Petersen R,et al.Volatile metabolites from actinomycetes[J].Journal of Agricultural and Food Chemistry,2002,50(9):2615-2621.
[10]Mercier J,Jiménez J I.Control of fungal decay of apples and peaches by the biofumigant fungus Muscodor albus[J].Postharvest Biology and Technology,2004,31(1):1-8.
[11]Stinson A M,Zidack N K,Strobel G A,et al.Mycofumigation with Muscodor albus and Muscodor roseus for control of seedling diseases of sugar beet and Verticillium wilt of eggplant[J].Plant Disease,2003,87(11):1349-1354.
[12]Mercier J,Manker D C.Biocontrol of soil-borne diseases and plant growth enhancement in greenhouse soilless mix by the volatile-producing fungus Muscodor albus[J].Crop Protection,2005,24(4):355-362.
[13]Stinson M,Ezra D,Hess W M,et al.An endophytic Gliocladium sp.of Eucryphia cordifolia producing selective volatile antimicrobial compounds[J].Plant Science,2003,165(4):913-922.
[14]Riga E,Lacey L A,Guerra N.Muscodor albus,a potential biocontrol agent against plant-parasitic nematodes of economically important vegetable crops in Washington State,USA[J].Biological Control,2008,45(3):380-385.
[15]Mercier J,Jiménez J I.Potential of the volatile-producing fungus Muscodor albus for control of building molds[J].Canadian Journal of Microbiology,2007,53(3):404-410.
[16]Möller E M,Bahnweg G,Sandermann H,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues[J].Nucleic Acids Research,1992,20(22):6115-6116.
[17]White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A,Gelfand D H,Sninsky J J,et al eds.PCR protocols:a guide to methods and applications.San Diego:Academic Press,1990:315-322.
[18]Staats M,Van Baarlen P,Van Kan J A L.Molecular phylogeny of the plant pathogenic genus Botrytis and the evolution of host specificity[J].Molecular Biology and Evolution,2005,22(2):333-346.
[19]Barnett J A.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991:17-430.
[20]周春艳,张秀玲,王冠.酵母菌的 5 种鉴定方法[J].中国酿造,2006,161(8):51-54.
[21]Harrigan W F.食品微生物实验室手册[M].李卫华等,译.北京:中国轻工业出版社,2004:248-253.
[22]何秀娟.筛选芒果采后炭疽病和蒂腐病的生防菌研究[D].武汉:华中农业大学,2006.
[23]刘晓媛.拮抗酵母菌生防机理及应用研究[D].天津:天津科技大学,2009.
[24]范青,田世平,姜爱丽,等.采摘后果实病害生物防治拮抗菌的筛选和分离[J].中国环境科学,2001,21(4):313-316.
[25]Diesh S,Goutam M.Improved control of Rhizopus stolonifer-induced storage rot of peach with hot water and antagonistic yeast,Debaryomyces hansenii[J].Indian Phytopathology,2012,59(2):168-173.
[26]Singh D,Sharma R R,Samuel D V,et al.Enhancing the bioefficacy of Debaryomyces hansenii with sodium salts for reducing the blue mould rot in apples[J].Indian Phytopathology,2011,62(4):478-483.
[27]Chalutz E,Wilson C L.Postharvest biocontrol of green and blue mold and sour rot of citrus fruit by Debaryomyces hansenii[J].Plant Disease,1990,74(2):134-137.
[28]Fadda M E,Mossa V,Pisano M B.Occurrence and characterization of yeasts isolated from artisanal Fiore Sardo cheese[J].International Journal of Food Microbiology,2004,95(1):51-59.
[29]陈裕充,温海.野生鸽作为劳伦梯隐球菌、单咽隐球菌及汉逊德巴利酵母菌的携带者[J].国外医学:皮肤性病学分册,2000,26(4):253-254.

