C57-ras转基因小鼠模型杂交1代CB6F1的生长发育特性
刘甦苏,吴 曦,周舒雅,王辰飞,彭泽旭,左 琴,李保文,贺争鸣,范昌发
(中国食品药品检定研究院,国家啮齿类实验动物种子中心,北京 100050)
C57-ras转基因小鼠模型杂交1代CB6F1的生长发育特性
刘甦苏,吴 曦,周舒雅,王辰飞,彭泽旭,左 琴,李保文,贺争鸣,范昌发
(中国食品药品检定研究院,国家啮齿类实验动物种子中心,北京 100050)
目的测定自主建立的转基因致癌性模型C57-ras小鼠与BALB/c小鼠杂交1代的生长发育特性参数,为该模型的商业化供应提供基础数据。方法 将雄性转基因阳性C57-ras小鼠与野生型雌性BALB/c小鼠交配,获得杂交1代(CB6F1 c-Ha-ras+/-)并测定平均产仔数、离乳率、阳性鼠生长发育情况、转基因阳性率等参数。结果 在生长发育方面,雌鼠平均每窝产子数为8只,离乳率为90%,雄雌性别比符合预期。CB6F1的平均出生重为(1.73±0.05)g,10周龄时阳性鼠平均体重雌性(24.38±1.74)g,雄性(29.42±1.72)g。雄性鼠体重明显高于雌性,差异存在极显著性(P<0.01);基因型检测阳性率为46.9%,符合遗传规律。结论 转基因致癌性模型C57-ras小鼠与BALB/c小鼠杂交1代的生长发育特性正常,可实现规模化商业供应。
C57-ras转基因小鼠;人原癌基因c-Ha-ras;CB6F1;生长发育特性;
小鼠的生长发育特性是其生理学数据的组成部分也是动物饲养管理和健康状况的重要指标,对建立该品系的商业化供应体系具有指导意义[1],尤其对于新建立的转基因品系而言,是该品系不可或缺的背景数据。
C57-ras转基因致癌性小鼠模型是通过原核注射方法,将人原癌基因c-Ha-ras导入C57BL/6小鼠基因组中自主建立[2,3],旨在建立新一代基因修饰动物模型以用于我国临床前药物致癌性实验,促进我国建立符合 ICH规范的新评价替代方法体系[4-5]。由于C57-ras转基因小鼠纯合致死[6],以转基因杂合子(c-Ha-ras+/-)与C57BL/6野生型小鼠交配的方式进行传代繁殖。通过观察,发现C57-ras转基因小鼠繁殖能力及仔鼠成活率低,而之前文献报道其自发肿瘤的发生率较高[5,7],故此类临床前致癌性安全评价实验所用动物为C57-ras阳性小鼠和BALB/cJ的杂交1代阳性鼠(CB6F1 c-Haras+/-),以降低背景肿瘤对实验准确性的影响[7]。目前,我们已经完成部分该模型的阳性致癌物验证工作[10],也开始向部分临床前药物评价中心提供。而该模型的平均产仔数、离乳率、生产曲线等基本参数尚未测定,给建立商业化供应体系带来一定难度。本文在测定c-Ha-ras转基因阳性小鼠在CB6F1背景上生长发育性能参数的同时计算该基因检测阳性率,旨在为其生产供应及应用于药物安全评价提供参考。
1 材料和方法
1.1 实验动物及实验环境
9~10周龄的雄性转基因阳性C57-ras小鼠42只及8周龄野生型BALB/cJ雌鼠45只均饲养于国家啮齿类实验动物种子中心[SCXK(京)2009-0017],屏障环境,温度(18~26)℃,相对湿度50%~70%,自动光控(12 h明/12 h暗)。饲料购自北京维通利华,经60Co辐照灭菌。饮用水为经高压灭菌的自来水。
本实验在中国食品药品检定研究院实验动物伦理委员会监督下进行。实验人员均持有北京市实验动物从业人员上岗证。实验设计符合“3R”原则,动物饲养管理及实验操作符合《北京市实验动物管理条例》法规的要求,实验结束后实验动物处死方法为安乐死。
1.2 仪器及试剂
TaqDNA聚合酶、DNA marker、dNTP、PCR缓冲液、蛋白酶K均购置于由宝生物工程大连有限公司(TaKaRa)。1.5 mL离心管和PCR管及盖购自于Axygen。美国 Sartorius公司 BSA220ZS型电子天平、Thermo Nanodrop 2 000微量紫外分光光度计。引物由诺赛基因研究公司合成。
1.3 动物交配方式
雄性转基因阳性 C57-ras小鼠与雌性野生型BALB/cJ小鼠1:1交配获得F1代,交配采用隔天交配并记录阴道栓的方式,每天17点合笼(标记为0 d),次日(标记为0+1 d)上午9点开始检查雌鼠阴道栓,未成功检栓的雌鼠与雄鼠0+1 d的17点合笼,成功检栓的雌鼠2只一笼饲养待产,雄鼠则于0 +2 d下午17点合笼,以此类推。并于见栓14 d后挑选待产雌鼠,确认怀孕率。共进行3次繁殖交配实验,每次实验选用的繁殖亲本为前一次未成功交配的雌雄鼠。
1.4 生长发育测定指标
分别记录交配雌鼠的阴道栓见栓率以及后期怀孕率、雌鼠产仔数,小仔的性别比及离乳数。随机选取4窝仔鼠,分别称量其初生、7 d、14 d和21 d时窝重并计算单只仔鼠重量;小鼠离乳后经PCR方法检测 CB6F1基因型,分别称量雌雄各 20只CB6F1(c-Ha-ras+/-)转基因阳性鼠在4、5、6、7、8、9和10周龄时体重。
1.5 PCR反应扩增检测杂合CB6F1小鼠基因型
检测194只离乳小鼠,剪尾后进行蛋白酶K消化并提取基因组DNA。每只小鼠取100 ng基因组DNA,PCR检测基因型,引物设计针对转基因的编码序列,上游引物为 Pri.PFT,下游引物为 Pri.PRN1735(序列见表1),目的片段408 bp。PCR条件为:95℃ 5 min变性;95℃ 30 s;62℃ 30 s,72℃30 s,30个循环。采用内参基因Gapdh复检阴性样本,确认样本DNA提取正常,上下游引物序列及Tm值见表1。产物取5 μL用1.5% 琼脂糖凝胶电泳检测。
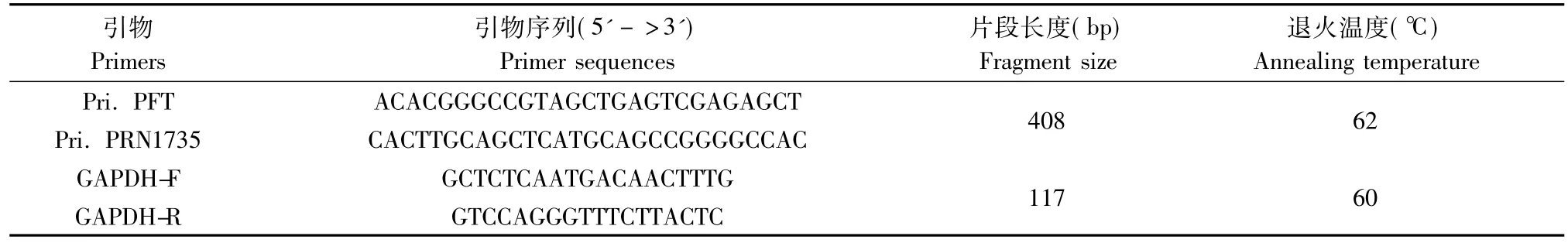
表1 PCR反应引物序列及退火温度Tab.1 The primer sequences and annealing temperature of PCR reaction

表2 野生型BALB/cJ雌鼠见栓率、雌鼠受孕率及检栓成功率Tab.2 The rate of vaginal plug,pregnancy rate and success rate of vaginal plug check in the wild-type BALB/cJ female mice
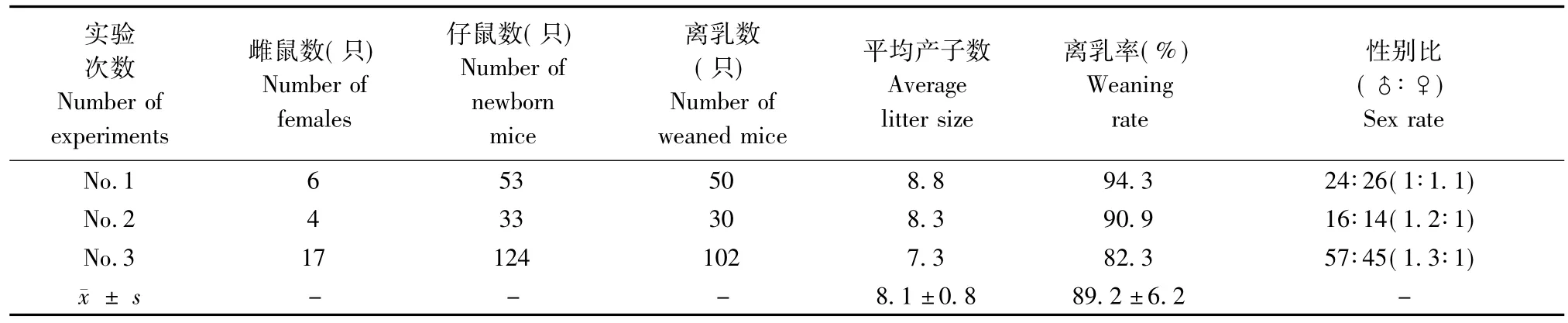
表3 雌鼠窝产子数,仔鼠的性别比及离乳数Tab.3 The number of newborn mice,weaned mice and sex ratio of the newborn mice
1.6 数据处理
用Excel统计实验所得数据,CB6F1(c-Haras+/-)转基因鼠生长体重数据进行ANOVA检验,性别比及转基因阳性率进行卡方检验,P值小于0.05作为具有显著性差异,P值小于0.01作为极显著性差异。统计结果以±s表示。
2 结果
2.1 野生型BALB/cJ雌鼠见栓率、受孕率及检栓成功率
一共进行了3次平行的繁殖交配实验,交配雌鼠见栓率、雌鼠受孕率及检栓成功率见(表2)。3次实验雌鼠见栓率及怀孕率差别比较明显,1和2次实验结果较为接近,见栓率及怀孕率在20%和14%左右,第3次为89.3%和60.1%。三次实验的检栓成功率相差不大,均值为61.6%。
2.2 BALB/cJ雌鼠窝产子数,仔鼠的性别比及离乳数
BALB/cJ雌鼠窝产子数,杂合CB6F1仔鼠的性别比及离乳数见(表3)。三批次平均窝产子数及离乳率的差异不明显,平均窝产子数为8只,离乳率为90%。仔鼠性别比为1.2∶1与理论值1∶1进行卡方检验(P>0.05),性别比符合预期。
2.3 CB6F1仔鼠的哺乳期窝重及单只仔鼠重
随机抽取4窝哺乳期仔鼠分别测定初生0 d、7 d、14 d和21 d时的总重量并进一步计算每窝的单只仔鼠重量(表4),发现初生0 d、7 d、14 d时单只仔鼠重量与雌鼠哺乳期的喂养仔鼠个数不存在相关作用,但21 d时第2窝单只仔鼠重量明显高于其他窝的仔鼠重量。通过计算单只仔鼠平均出生重为(1.73±0.05)g,21 d离乳时平均出生重量为(11.36±2.26)g。

表5 杂合CB6F1小鼠基因型检测阳性率Tab.5 Transgenic positive rate in the CB6F1(c-Ha-ras+/-)mice
2.4 生长鼠的生长发育情况测定
小鼠离乳后,随机挑选基因型检测为阳性的转基因CB6F1(c-Ha-ras+/-)生长鼠雌雄各10只测定其生长体重情况(图1)。从实验结果看,生长鼠雄性体重明显高于雌性,差异存在极显著性(P<0.01)。
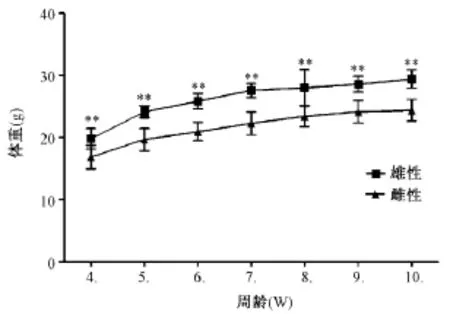
图1 4周龄后CB6F1生长鼠生长发育情况Note.Abscissa is the age in weeks of mice,ordinate is the body weight of mice.Difference in the growth curves of male and female mice is analyzed using ANOVA method,**P<0.01 shows an extremely significant difference.Fig.1 The body weight of 4-week old CB6F1 mice
2.5 基因型检测阳性率
通过检测194只离乳小鼠,91只扩增出目的条带且重复实验后结果一致,判定为转基因阳性;剩余103只阴性样本PCR反应均扩增出内参基因,部分实验结果见(图2)。该批实验转基因型检测阳性率为46.9%与理论值50%进行卡方检验(P>0.05),符合预期(表5)。
3 讨论
近几年来,采用为期6个月的基于转基因动物模型的致癌性评价替代实验在国内部分临床前药物安全评价中心逐步开展起来,以逐步建立符合ICH S1B的评价体系[8]。为适应此需求,周舒雅等从正常人血液中克隆得到的6.5 kb的c-Ha-ras基因并添加启动子和polyA后通过原核注射方法自主构建转基因小鼠模型C57-ras[3]。继获得此模型后,开展了部分生物学特性分析,明确了各脏器中转基因表达谱[9]。同时联合国内的药物临床前安全评价机构开展了致癌性评价研究[10],有望获得可用于药物致癌性安全评价的快速、稳定、有效的动物模型。
在药物临床前安全性评价中,为降低自发肿瘤发生率,需采用C57-ras和BALB/cJ的F1代杂交阳性动物,而该动物的出生率、离乳率等参数尚未测定。此次实验中3次实验的受孕率及见栓率均低于文献报道的BALB/cJ小鼠[11],表明在繁育时小鼠性周期的鉴定是确保小鼠按计划时间受孕的关键。对比3次实验结果,第1、2次受孕率及见栓率明显低于第3次,可能与所用C57-ras公鼠(c-Haras+/-)有关,其均为首次交配,而第3次实验则为二次交配,表明今后实验时应尽量选择交配后的雄鼠用于提高受孕率及见栓率。通过3次实验,发现野生型BALB/cJ雌鼠平均产仔数及离乳率与文献报道一致[12],这表明CB6F1小鼠生长发育正常。
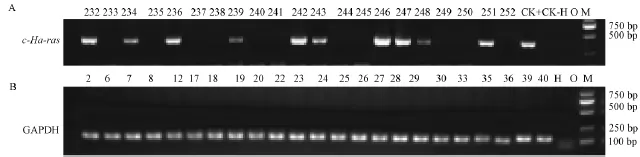
图2 PCR检测CB6F1小鼠c-Ha-ras基因及内参基因GAPDH表达Fig.2 Identification of c-Ha-ras and internal GAPDH gene expression determined by PCR in the CB6F1 mice
通过测定CB6F1窝重,发现哺乳期内单只仔鼠的体重与雌鼠代乳的仔鼠的数量关系不明显,平均初生体重为1.73±0.05g,14 d到21 d生长速度最快,离乳时体重达到(11.36±2.26)g。分析4周龄后CB6F1阳性鼠的生长发育情况(图1),3-5周生长较快,10周左右生长进入平台期,且雌性小鼠较雄性小鼠生长缓慢,二者体重差异存在极显著性(P<0.01)。由于目前暂无该阳性小鼠的相关文献数据,参考C57BL/6与BALB/c小鼠数据后[12],发现CB6F1背景的转基因阳性小鼠(c-Ha-ras+/-)的体重介于二者之间。进一步与相关文献[12-14]实验结果比较,小鼠生长发育性能正常,有利于该模型将来在临床前安全评价中的应用。
通过离乳小鼠基因分型检测,统计出该基因检测阳性率为46.9%,符合经典遗传学中的孟德尔定律。
本文测定了繁殖CB6F1(c-Ha-ras+/-)小鼠的母鼠平均产仔数、离乳率、阳性生长鼠生长体重,转基因阳性率等参数,对于建立该癌症动物模型的商业化供应体系,推动我国基于转基因动物模型致癌性替代方法的建立有积极意义。
[1]田小芸,恽时锋,郭联庆,等.Nrf2基因敲除小鼠的繁育及生长发育的生物学特性[J].中国比较医学杂志,2009,19(2):50-52.
[2]范昌发,岳秉飞,王军志,等.含有人源原癌基因c-Ha-ras的转基因小鼠的制作方法及其用途[P].ZL 2008 1 0101666.0,2013.9.4.
[3]周舒雅,左琴,刘甦苏,等.C57-ras转基因小鼠模型的建立[J].药物分析杂志,2013,33(11):1928-1934.
[4]范昌发,李波,王军志,等.遗传修饰致癌性动物模型与药物临床前安全性评价[D].北方实验动物科技年会,2009,66-68.
[5]Nielsen LL,Gurnani M,Tyler RD.Evaluation of the wap-ras transgenic mouse as a model system for testing anticancer drugs[J].Cancer Res,1992,52:733-3738.
[6]Saitoh A,Kimura M,Takahashi R,et al.Most tumors in transgenic mice with human c-Ha-ras gene contained somatically activated transgenes[J].Oncogene,1990,5(8):1195 -1197.
[7]Urano1 K,Tamaoki N,Nomura T.Establishing a laboratory animal model from a transgenic animal:RasH2 mice as a model for carcinogenicity studies in regulatory science[J].Vet Pathol,2012,49(1):16-23.
[8]ICH Sl B.International conference on harmonization ICH S1B.(1997)[M/OL].Guidance for industry S1B testing for carcinogenicity of pharmaceuticals.http:///www.fda.gov/cder/guidance/index.htm.
[9]刘甦苏,周舒雅,高正琴,等.c-Ha-ras在转基因小鼠模型C57-ras各组织中的表达谱分析[J].生物技术通讯,2013,24(5):636-640.
[10]吕建军,刘甦苏,左琴,等.C57-ras转基因小鼠模型的MNU验证实验[J].药物分析杂志,2013,33(11):1935 -1940.
[11]张俭,黄星群,刘建军.BALB/c小鼠繁殖性能的观察及分析[J].四川动物,2006,25(1):179-181.
[12]席晓霞,秦天达,吴润,等.SPF级BALB/c C57BL/6小鼠繁殖性能及生长发育的比较研究[J].畜牧兽医杂志,2009,28(6):11-12.
[13]吴清洪,顾为望,张嘉宁,等.SPF级C57BLP6J小鼠生长发育和繁殖性能指标的测定[J].中国比较医学杂志,2006,16(10):606-607.
[14]张洪,鲍波.浅谈国内BALB/c小鼠及KM小鼠的基本生物学特性[J].中国实用医药,2010,5(3):252-254.
Characterization of growth performance of F1 hybrid CB6F1 C57-ras transgenic mouse model
LIU Su-su,WU Xi,ZHOU Shu-ya,WANG Chen-fei,PENG Ze-xu,ZUO Qin,
LI Bao-wen,HE Zheng-ming,FAN Chang-fa(National Rodent Laboratory Animal Center,National Institute of Food and Drug Control,Beijing 100050,China)
Objective To obtain the basic growth parameters of a self-established F1 hybrid CB6F1 C57-ras transgenic mouse model,and to provide basic information for commercialization of this mouse model.Methods F1 hybrid mice(CB6F1)were produced by crossing C57-ras heterozygous transgenic(c-Ha-ras+/-)male mice and wild-type BALB/cJ female mice.The average litter size,weaning rate,sex ratio,growth performance and C57-ras transgenic positive rate were recorded and analyzed.Results The average litter size was eight,weaning rate was 90%,and sex ratio was approximately in accordance with prediction.The average body weight of newborn mice was 1.73±0.05 g.The average body weight of 10-week old c-Ha-ras transgenic female and male mice in CB6F1 background was 24.38±1.74 g and 29.42 ±1.72g,respectively,which had a significant difference(P<0.01).The c-Ha-ras transgenic positive rate was 46.9%.which was in accordance with genetic rules.Conclusions The F1 hybrid mice(CB6F1)produced by crossing C57-ras heterozygous transgenic(c-Ha-ras+/-)male mice and wild-type BALB/cJ female mice show normal growth performance and development characteristics,and it can be used for large-scale commercial supply.
C57-ras transgenic mice,Human c-Ha-ras gene,CB6F1,Growth performance
R33
A
1671-7856(2015)04-0018-05
10.3969.j.issn.1671.7856.2015.004.004
中国食品药品检定研究院中青年发展研究基金(批准号:2010C4)资助的课题。
刘甦苏(1981-),女,助理研究员,主要从事模式动物相关工作。
范昌发(1970-),男,博士,研究员,主要从事模式动物研究。Email:fancf@nifdc.org.cn。
2015-01-21

