实验期间动物的保护及处理措施
龙子江,陈 明,高华武,王 靓,田丽娜,任振兴
(安徽中医药大学,合肥 230031)
实验期间动物的保护及处理措施
龙子江,陈 明,高华武,王 靓,田丽娜,任振兴
(安徽中医药大学,合肥 230031)
实验动物是生命科学研究和发展的重要基础材料。随着生命科学技术的不断发展,新技术、新理念的不断涌现,动物实验作为科学理论的论证和理论的探索极为重要,然而实验期间动物的保护和处理是保障科学研究的成功、结果准确可靠的重要环节之一。因此,对实验期间动物的保护及处理越来越被生命科研工作者重视。本文结合自身在实验中的一些措施和经验,并结合其他学者在实验过程中的体会和认识,对实验期间动物的保护和处理总结和归纳。
实验期间动物,生命科学,保护措施
生命科学领域的发展日新月异,科研成果层出不穷,尽管实验方法和材料较广,但实验动物在生命科学研究始中越来越显得重要。生命科学研究包含实验动物、仪器设备、情报信息和化学试剂四个支撑要素,其中以实验动物占据首位。生命科学研究始终把动物实验作为研究的一个重要环节,动物实验的成功与否直接关系到研究的最终结果。
但在实验中,需对动物进行各种处理,如动物的麻醉、长期给药、手术、动物疾病模型的复制等过程,不仅会影响实验动物的生存,更会对实验结果造成影响。如何保护好实验过程中的动物,对实验的成功与否起到极其重要的作用。现就我中心在长期实验过程总结的有关经验,针对实验动物的保护和处理措施总结如下。
1 实验期间动物的保护和处理
1.1 手术实验
1.1.1 麻醉药的选择和使用:医药学研究领域中,动物实验的成败在很大程度上取决于手术过程中动物麻醉的成功与否。麻醉剂的选择、用量以及麻醉方式都在很大程度上影响实验结果的准确性。非挥发性麻醉药常选用戊巴比妥钠、氨基甲酸乙酯、水合氯醛、氯胺酮、苯戊巴比妥等,吸入性麻醉药则常选用氟烷、异氟烷、乙醚等。氯胺酮、异氟烷等安全度大,适用于手术后动物需立即清醒的实验;而戊巴比妥钠、水合氯醛、乌拉坦则适宜用于手术时间较长,手术过程中动物处于麻醉状态的实验。动物麻醉剂的应用一般应按千克体重计算总药量,见表1.
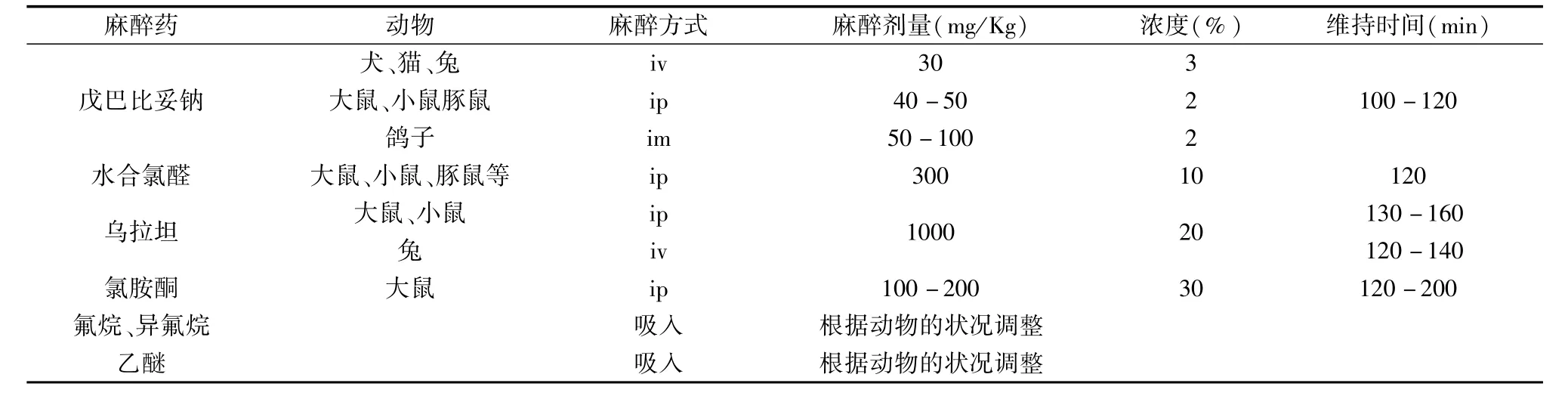
表1 常用麻醉药的用量及麻醉方式Tab.1 Doses and methods of commonly used anesthetics in biomedical exPeriments
手术后由于动物的体温、血压下降,呼吸减慢,不同的实验应选用不同的麻醉药。如心肌缺血模型的复制采用氟烷、异氟烷、乙醚等吸入性麻醉药较好,苏醒快、死亡率低;心脏缺血再灌注模型可选氯胺酮或乌拉坦,既能保证在实验过程中动物处于麻醉状态,也能使动物在手术后能很快苏醒。
为了减少吸入麻醉药的用量、保证动物安全,又便于在气管内插管、开胸时控制呼吸以及在开腹时取得满意的肌肉松弛效果,常配合使用琥珀胆碱、潘可罗宁、三碘季铵酚等肌肉松弛药。手术过程中动物麻醉过量或发生休克、呼吸减慢甚至停止时,应用小动物呼吸机保持动物呼吸的畅通,同时配合使用肾上腺素、阿托品、利多卡因等,对实验过程中动物随时出现的意外情况进行抢救,避免手术过程动物的意外死亡影响实验进程、实验结果,甚至导致实验的失败。
1.1.2 手术后感染的防治:除牛羊等大型动物和猴等珍贵实验动物外,普通动物实验研究阶段均采用严格的饲养管理和卫生防疫制度措施,而不是通过接种疫苗和使用药物治疗的手段实现预防感染的目的。但在实验手术后,预防动物感染的防御措施有:(1)购买合格的动物:购买的实验动物应有生产合格证,在实验前至少密切观察1~2周,如发现异常应及时处理。观察期间监测动物病原微生物,防止实验动物经病原微生物途径感染。(2)实验环境消毒处理:实验室要有实验动物使用许可证,对饲养室、笼具、饲料、垫料、饮用水进行定期消毒,降低
实验环境途径病原体感染风险。(3)动物感染提前预防:对实验用大动物如牛、绵羊、犬等,应及时接种疫苗,预防牛病毒性腹泻、绵羊食毛症和狂犬病等疾病的发生。(4)及时捕杀逃出笼外动物:在实验过程中如大、小鼠逃出笼外,要及时捕杀,防止互感。(5)手术器械消毒:在实验过程中,所用手术器械要进行常规消毒处理,包括手术台和环境等的消毒灭菌。(6)防止术后感染:实验动物在手术后,要肌内注射或在手术视野滴入适当的抗菌药物,如青霉素G、庆大霉素等,预防感染,但如果实验目的是药物抗感染性实验,则不能用抗菌药物防治手术感染。
1.1.3 注意体温的调节:一般实验动物如鼠、兔等啮齿类动物生存的适宜环境温度为18℃ ~25℃,其生理功能在此范围内波动不明显。张振汉等[1]研究昆明小鼠在(-4~40)℃范围内能量代谢特征,结果表明当温度低于26℃时随温度的降低基础代谢率逐渐增加;当温度超过32℃时,小鼠基础代谢率显著增加,在温度为40℃时小鼠全部死亡。这表明小鼠的基础代谢、脉搏、呼吸等生理反应受环境温度的影响。而手术后动物的基础代谢率下降,体温下降,因此维持周围环境温度在一个相对稳定的范围内,能维持实验动物基础代谢率,保证实验动物的存活率,提高实验结果的可靠性。
1.1.4 保证呼吸的畅通:实验动物经手术处理,特别是大规模的创伤手术,如进行心肌缺血再灌注损伤模型手术,大鼠在手术过程中需借助动物呼吸机进行辅助呼吸。手术后动物体质较弱,呼吸也比较微弱,为保证动物的呼吸应做到:(1)保持实验室良好的通风,(2)将实验动物的舌头拉出,防止由于麻醉剂导致的松弛舌根而堵塞气道,(3)尽量减少笼内饲养密度,留有充足的活动空间,最好每笼一只,防止苏醒的动物挤压处于麻醉状态的动物造成麻醉动物窒息死亡。
1.2 长期给药实验
在长期给药的实验中,各给药途径的规范与否,不仅与动物身体健康有关,还与实验操作人员的熟练程度密切相关,也关系到实验结果的可靠性和实验的成功与否。因此在长期实验过程中为减少实验误差,应尽量由同一操作技术娴熟的实验人员完成。
1.2.1 口服给药:口服给药是最常见的动物给药方式,但在实验过程中动物的捉持和灌胃的手法极为重要。如大、小鼠灌胃应注意:(1)首先用左手抓住大鼠头颈部及背部皮肤,使头、颈、躯干在一条直线上,(2)右手握住灌胃注射器从大鼠一侧嘴角进针后再把针挪到中间,使注射器、颈、躯干保持在一条直线上,(3)灌胃针往食管进针过程如遇到阻力时,将针头回缩后再进针,切不可使用粗暴蛮力,以免刺破食道,造成动物的损伤或死亡,(4)大鼠的灌胃进针深度一般为灌胃针长的三分之二,约4~6 cm。
家兔灌胃给药时应注意:(1)要将家兔固定好,(2)开口器一定要从嘴角插入,同时压住兔舌,使开口器的上的洞口对准食道,(3)将导管从开口器洞口延食道向胃内插入,如果遇到阻力,应适当回缩再继续插入,导管插入的深度约15~20 cm,(4)为防止导管插入气管,在导管插好后,将外端放入事先准备好的清水中,看是否有气泡产生,如有气泡,说明导管不在食管内,应拔出重新插入。
豚鼠灌胃给药较为困难,可采用喂药的办法,减少死亡率。即将灌胃注射器的针头拔去,将注射器插入动物的口中,按豚鼠的吞咽的速度推注药液达到给药的目的。
1.2.2 静脉给药:静脉注射时应根据动物选择合适的血管,如家兔常选耳缘静脉,大鼠选用尾静脉和舌下静脉,犬选用前肢内侧通经脉等,应保证注射之前血管充分扩张,所选针头直径应略小于血管。注射过程应采先快后慢的方式,同时根据动物的呼吸频率、肌肉松弛度、角膜反射以及皮肤夹捏反应来调整注射速度,当这些反应明显减弱或消失时,应立即停止注射。
1.2.3 皮下给药:一般选取组织疏松的部位进行皮下给药。大、小鼠常用给药部位为下腹部两侧,兔常用给药部位为背部脊柱两侧,豚鼠常用后大腿内侧,而犬、猫则选为大腿外侧。进针时针头刺入角度以30°适合,角度太大容易刺入肌肉层,角度太小则易刺入皮内。皮下给药一般选用易溶解、刺激性小及疫苗等生物药品,因注射部位有较厚的脂肪层,药物吸收较慢,给药后5~10 min效果才会明显。长期给药应采用轮流交替注射方式,及时更换注射部位,防止注射部位出现肿块、炎症或破溃等现象。
1.2.4 腹腔给药:腹腔注射多选择下腹部腹白线两侧进针,进针角度以45°最好。为了避免注射器针头碰到内脏,在注射时,将针头向上挑起后进针,如大、小鼠可将头向下倾斜,使内脏向下移动,可防止进针后伤及内脏,出现不必要的损伤或死亡。
1.3 动物病理模型复制
在大多数药物研究实验中,为验证实验药物对疾病的防治效果,常利用各种手段复制与临床疾病相类似的模型动物,因此动物模型的成功与否,直接关系到实验的成败。以几个常见实验为例,介绍动物模型复制过程中应注意事项,为实验者在进行相关实验中提供借鉴。
1.3.1 心肌缺血模型的复制:心肌缺血的模型可分为以下四类:急性心肌缺血模型、慢性心肌缺血模型、可控性心肌缺血模型和离体心肌缺血模型。现以大鼠冠状动脉结扎致急性心肌缺血模型为例,分析造模过程中应注意的事项。(1)实验前对手术器械消毒,大鼠麻醉后固定好,(2)剪去胸腔术野毛发,采用酒精配合碘酒消毒,(3)于左第4肋骨间开胸挤出心脏,距左冠状动脉起点2~3 mm处穿5-0号手术线穿线结扎[2]。结扎部位太上容易损伤心耳,也不便打结。穿线时进针深度应适宜,既要避免过于表浅未结扎到左冠状动脉,也要避免进针过深刺伤心肌,(4)结扎后送回心脏,闭合胸腔,依次缝合肌肉和皮肤,(5)伤口处喷洒青霉素注射液粉末,肌内注射20 U青霉素注射液,预防感染,连续3 d。并应注意保暖,最好在术后3 d内单笼饲养[3,4]。
1.3.2 糖尿病模型的复制:糖尿病模型复杂,有I型和II型之分。现以小鼠腹腔注射四氧嘧啶复制糖尿病模型为例,对造模过程中应注意的问题加以分析。糖尿病造模采用少量多次注射四氧嘧啶的方法造模,即小鼠禁食12 h后以200 mg/kg剂量腹腔注射四氧嘧啶,24 h后再以100 mg/kg剂量腹腔注射给药,恢复进食[5]。糖尿病模型小鼠造模后使用断尾法采血测血糖,小鼠于尾尖减去约5 mm,取血后棉球压迫止血,放回笼内饲养,待再次尾尖部取血。糖尿病小鼠饲养应注意:(1)由于体质差,应在SPF的环境下进行喂养,并控制每笼小鼠的数量,密度不宜过大,(2)糖尿病小鼠的尿量大,带糖,且小鼠的体重减轻,活动减弱,应当每天更换笼内的垫料,添加食物和饮水,以免滋生大量病菌,造成小鼠不必要的死亡。
1.3.3 胃溃疡模型的复制:胃溃疡模型的复制方法很多。如使用冰醋酸复制大鼠慢性胃溃疡模型,在操作过程应注意:(1)手术前要禁食12 h,(2)手术前手术器械应消毒灭菌,术野应进行被毛消毒,手术过程中应保持无菌,避免鼠毛进入腹腔造成腹腔内感染,导致实验鼠死亡,(3)打开腹腔,小心将胃从腹腔移出,操作要轻柔快捷,以减少粘连,避免内脏移位伤及胃和其他脏器,(4)注入冰醋酸时进针一定要到胃内才推注,防止外漏,减少其他组织脏器的损伤,(5)缝合时应肌肉和皮肤分层缝合,保证伤口愈合,(6)手术结束后在伤口处消毒,以减少感染,(7)术后大鼠因饥饿或疼痛因素,进食量会大增,过量进食则会导致胃过度扩张,大量食物蓄积胃内,引起腹胀,因此胃部造模实验术后12 h,应节制实验动物饮食,以免出现术后腹胀的现象[6],在节食时应适当的给予糖盐水,以维持其血糖和电解质处于正常水平。
1.3.4 肾衰模型的复制:肾衰模型的复制主要有药物法和肾大部切除法两种。药物法是由腺嘌呤或者高浓度甘油诱导,而肾大部切除法则是切除5/6肾脏复制慢性肾衰模型。现以肾切除法为例介绍肾衰模型。传统方法分两次手术,一期手术结扎左肾上下极后切除结扎部分约2/3肾组织,二期手术将右侧肾脏全切除。另一方法为改良后的一次手术方法,即在切除左肾2/3肾组织同时将右侧肾脏全切除[7]。肾切除法是在保存残留肾组织相对正常的前提下形成肾超负荷工作模式,符合肾小球高度滤过导致肾衰竭病理机制。模型制备过程对动物的创伤较大,因此需要操作技术娴熟,开口定位准确,脏器切除体积要一致,手术过程要注意止血,术后缝合采用逐层缝合方式防止手术口裂开,要防止术后感染。实验动物要在手术后4周才开始进入慢性肾衰期,实验周期较长,在做好防感染的同时,药按期观察动物尿量,检测尿蛋白的含量,确定模型是否成功。
1.3.5 脑出血和栓塞模型的复制:以脑微栓塞大鼠模型为例。手术操作过程应尽量避免过度麻醉、挤压颈动脉窦、压迫气管和大量出血等意外情况发生,减少动物死亡。手术中要保证手术视野清晰干净,血管周围神经丛应钝性分离且动作轻柔,以免影响中枢神经系统造成大鼠呼吸或心跳骤停。在注射微栓子时,速度不宜过快,拔出导管时可先用动脉夹夹住破口近端,然后结扎颈外动脉,避免造成回血过多,栓子随血流溢出。手术过程中应注意观察呼吸、心率变化及动物反应,及时追加麻药,避免动物挣扎造成的实验意外[8]。
又如在制备大鼠硬膜下血肿模型时,将大鼠麻醉后固定于脑立体定位仪上,在手术过程中要密切观察大鼠呼吸节律、心率变化等情况,而且在缝合头部伤口之前要用快速凝固胶水及牙科用粘固粉封闭钻孔,伤口消毒后,将大鼠取俯卧位放在保温鼠笼内[9,10]。
1.4 手术后饲养
1.4.1 食物的选择与投放:促使手术后动物生理机能快速恢复的重要因素是提供充足的营养供应。不同实验手术后的动物对营养需求不相同。因此,应根据实验的类型、实验动物种类、动物的营养需求选择科学合理的饲料配方,给予适宜的饲料。如制备高血脂模型动物就应该选择含高脂配比的饲料,增加实验模型的成功率。
动物模型制备过程中,常会由于手术创伤、失血过多、饥饿或者药物因素导致动物的免疫功能低下。在实验过程中观察动物出现这种情况时,应给予高蛋白饲料为动物提供营养提高免疫功能,保证实验能有序进行[11]。应选择新鲜的饲料喂养实验动物,防止受潮、变质、发霉、虫蛀以及重金属污染的饲料进入实验室。另外,对一些特殊动物的饮水也应注意,如豚鼠每日的饮水中要加入适量的Vc,每日要按时给动物加食换水。
1.4.2 垫料的选择与更换:手术后实验动物由于有伤口,放回笼内饲养时一定要避免伤口与垫料直接接触,如去势法复制大鼠骨质疏松模型,手术后为防止缝合伤口感染,应取仰卧位将其放入笼内,观察其活动状态和伤口愈合情况。笼内垫料应选择松软、吸湿性强、无异味、不含重金属及挥发性物质的木屑,其原材料应未被有毒有害物质、微生物、寄生虫污染,保证实验动物有个舒适的生活环境。
1.4.3 其他:实验动物在饲养过程中除了温度、湿度、食物、垫料等因素外,还应注意适宜的饲养密度、保持良好的通风、换气和光照等饲养条件,并严格做好废弃物的清理,手术后的动物对环境中致病菌的敏感性较高,因此要对换去的垫料、动物尸体及排泄物及时清理,保持实验室清洁,防止蚊虫孳生。此外还要对实验人员进行严格要求,对实验人员进行岗前培训,充分理解和掌握各种实验动物的生活习性、生理、生态等。
2 实验结束后的动物处理
实验动物为生命科学研究做出了贡献,应该享受到相应的动物福利。实验后的动物应妥善处死,常用的处死方法有:折颈法、电击法、药物法、CO法和注射空气法等,研究者应根据不同动物种类,尽可能选择给实验动物带来最小痛苦的处死方法,可选择安乐死,减少实验动物死亡时疼痛的折磨[12]。实验动物在被处死并确认死亡后,其尸体应该集中送至焚烧炉烧毁处理,不得将尸体就地深埋或者抛入江河湖海污染环境,更不能随意扔弃或者出售。
3 小结与展望
动物实验是生命科学的重要环节,实验过程中的动物保护直接影响实验结果的真实性、可靠性和实验的成功与否。因此,作为实验人员,应该将实验动物的保护贯穿整个实验过程中,包括实验动物的购买,饲养管理、动物手术前后的护理、给药以及实验结束之后动物的处理等各个环节,要达此目的需要做到。
3.1 提高实验人员对动物的保护意识
在实验过程中善待动物 所有实验人员在实验过程的每个环节要牢记只有实验动物健康,才能保证实验结果的可靠和实验的成功,故在实验过程中动物的饲养、手术、给药等环节要善待动物,尽可能满足实验动物的生理和精神需求,使实验动物舒适,保证实验过程顺利进行。
3.2 提高实验人员的技能,减轻对实验动物伤害
实验人员在实验之前要做好详细的实验规划和预实验,提高实验技能,防止正式实验过程中由于实验者实验操作技术不娴熟对实验动物带来不必要的疼痛和创伤,影响实验结果的准确性。
3.3 建立标准化的实验室,提高生物安全
动物实验应在相应的生物安全防护实验室中进行,一方面能保证实验过程中动物不受感染,保证实验顺利进行。另一方面,防止有害生物因素污染,避免实验室生物安全事件的发生,降低实验人员感染疾病的风险。
3.4 科学设计实验方案,减少实验动物的痛苦
在动物实验过程中,在保证实验结果的前提下,尽量缩短实验周期,尽量减少手术的伤害等,减少动物意外死亡数和降低患病率,提高实验室资源利用率和设备周转率,保证动物实验能顺利进行。
总之,实验动物为人类健康研究做出了巨大贡献,作为进行动物实验研究人员,在动物实验过程中要保证动物的基本福利,善待实验动物,科学的保护实验动物,确保实验研究获得可靠的实验的实验数据,圆满完成科学实验研究
[1]张振汉,程富华,于洪川.不同温度对小鼠能量代谢的影响[J].农业科学研究,2007,28(3):18-20.
[2]杨杰,龙子江,穆磊,等.葛根芩连汤抗大鼠心肌缺血再灌注致心律失常作用及其机制研究 [J].中国实验方剂学杂志,2013,19(1):284-286.
[3]吕汝西,黄家卓,刘强.冠状动脉结扎制备大鼠心肌梗死模型及血流动力学检测[J].广东医学院学报,2011,29(1):5-12.
[4]童敏,贺亮,刘文亮,等.两种大鼠心肌梗死模型的比较研究[J].南方医科大学学报,2011,31(11):1941-1943.
[5]何依珊,刘欧飞.四氧嘧啶制备大鼠糖尿病不同给药方式比较[J].医药论坛杂志,2010,31(16):100-101.
[6]才丽平,蒋宁,曲怡,等.胃黏膜表面局部投予乙酸制备大鼠胃溃疡模型的方法[J].解剖科学进展,2011,17(1):8 -11,15.
[7]肖小燕,莫立乾,宋少练,等.复方黄甘延缓5/6肾切除大鼠慢性肾功能衰竭[J].南方医科大学学报,2014,34(11):1661-1667.
[8]赵杨,倪秀石,焦东亮,等.大鼠脑微栓塞模型的建立 [J].中国脑血管病杂志,2006,3(11):508-512.
[9]张志勇,孟令丽,张田,等.罗格列酮对实验性大鼠脑出血后细胞凋亡的影响[J].神经解剖学杂志,2015,31(2):203-207.
[10]任振兴,龙子江,陆松侠,等.化瘀涤痰汤对急性硬膜下血肿模型大鼠脑组织中HIF-1的α和Claudin-5蛋白表达的影响[J].中医药临床杂志,2015,27(4):541-543.
[11]汤加铭,陈民利.医学实验动物学 [M].北京:中国中医药出版社,2012,7:230.
[12]李雪萍,高永翔,王强,等.浅谈实验动物的保护及其福利[J].中西医结合研究,2012,4(5):276-278.
[13]冯丽萍,李焱冬,林金杏,等.欧美实验动物福利立法浅析[J].中国比较医学杂志,2013,23(12):52-55.
Animal treatment and protection measures during experiments
LONG Zi-jiang,CHEN Ming,GAO Hua-wu,WANG Liang,TIAN Li-na,REN Zhen-xing
(Anhui University of Chinese Medicine,Hefei 230031,China)
ExPerimental animals are imPortant basis for life science research and develoPment.Along with the continuous develoPment of science and technology,new technology and new ideas emerging,treatment and Protection of animals during exPeriments are imPortant condition to ensure the scientific results accurate and reliable,so scientists have Paid more attention to the issues of animal welfare and Protection.This article summarizes the animal treatment and Protection measures during exPeriments based on both own work and exPerience and knowledge of other scientists.
ExPerimental animals;Life sciences;Protection measures
R-33 < class="emphasis_bold">【文献标识码】A
A
1671-7856(2015)09-0081-05
10.3969.j.issn.1671.7856.2015.009.016
龙子江(1956-),男,教授,硕士生导师,研究方向:中药对心脑血管疾病的防治作用研究。
2015-08-20
教育与科普

