太湖大型底栖动物群落结构与水环境生物评价*
许 浩,蔡永久,汤祥明,邵克强,秦伯强,龚志军
(1: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京210008)
(2: 中国科学院大学,北京100049)
太湖大型底栖动物群落结构与水环境生物评价*
许 浩1,2,蔡永久1,汤祥明1,邵克强1,秦伯强1,龚志军1**
(1: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京210008)
(2: 中国科学院大学,北京100049)
于2014年冬季和夏季调查太湖全湖116个样点的大型底栖动物,分析其群落结构及与环境因子的关系.共记录底栖动物55种,隶属3门7纲18目27科52属,底栖动物的平均密度和生物量分别为405.5ind./m2和146.6g/m2.优势度分析表明,河蚬(Corbiculafluminea)、铜锈环棱螺(Bellamyaaeruginosa)、霍甫水丝蚓(Limnodrilushoffmeisteri)、太湖大螯蜚(Grandidierellaaihuensis)、寡鳃齿吻沙蚕(Nephtysoligobranchia)和拟背尾水虱属一种(Paranthurasp.)是太湖大型底栖动物的优势种.基于环境因子聚类分析,可将全湖分为3个区:敞水区、水生植被区和富营养区.方差分析表明各湖区间环境因子差异显著.统计分析表明,3个区底栖动物群落结构相似性低,差异显著.典范对应分析表明,水深、总氮、总磷、铵态氮、水生植物、溶解性有机碳和沉积物中值粒径与大型底栖动物群落结构显著相关.K-优势曲线、物种多样性指数显示,从水生植被区→敞水区→富营养区,营养水平增加,底栖动物多样性逐渐降低,生物量逐渐升高.研究结果表明营养水平、底质类型以及水生植被的分布是决定太湖大型底栖动物群落结构及多样性的关键因子.
太湖;大型底栖动物;群落结构;生物评价;生物多样性
底栖动物是指生活史的全部或大部分时间生活于水体底层的水生动物群.大型底栖动物是采样分选时能够被0.5mm孔径的网筛留住的那部分动物,一般指的是无脊椎动物,主要包括腔肠动物、环节动物多毛类、软体动物、节肢动物甲壳类和棘皮动物5个类群[1].底栖动物种类多、数量大,并因理化环境与食物等生态因子和营养类型的差异占据不同的生态位,发挥着不同的生态作用,影响不同营养等级生物类群的数量特征及分布[2].大型底栖动物是水生生态系统中食物链的重要环节,具有生命周期长、区域性强、迁移能力弱等特点,在生态系统物质循环和能量流动中具有不可替代的作用[3].大型底栖动物通过摄食、生物扰动和生物沉降,加速沉积物-水界面有机碎屑的碎裂和分解,促进泥水界面的物质交换和水体的自净,在食物网的能量流动和物质循环中起着重要的作用[4].
大型底栖动物由于迁移能力有限,容易受各种环境条件的影响,且包括敏感种和耐污种,故常称为“水下哨兵”[5],因此可以根据其群落特征的变化了解周围环境的动态变化.指示物种法评价淡水生态系统的健康研究已经取得了一些进展,也已经成为生态系统健康研究的基本常见方法.大型底栖动物群落结构参数(如多样性和丰度)能有效地指示湖泊环境的变化[6].由于各类底栖动物对环境条件的适应性以及对污染程度的耐受力和敏感程度不同,可利用底栖动物的种群结构、优势种类、数量等参数来反映环境质量状况.底栖动物的群落结构、时空变化以及物种多样性等特征对合理利用湖泊资源、改善湖泊水质具有重要意义.
大型底栖动物的空间分布既不是随机的也不是有规律的,而是呈斑块状分布或者呈马赛克状分布(样本方差显著大于样本平均值),不同样本间差异较大[7].以往对太湖底栖动物的调查是将太湖划分为不同湖区,选取32个样点进行采样调查[8-11],但这不能反映太湖底栖动物群落结构的全貌,为此本研究根据太湖的湖盆形状、出入流状况等特点将太湖划分为116个小样方(图1)进行调查,以获得更加全面的太湖大型底栖动物信息及其与环境因子之间的关系.本研究可为太湖生态系统的深入研究提供详实的数据,为太湖水环境治理提供参考依据.
1 材料与方法
1.1 采样点布设与样品采集
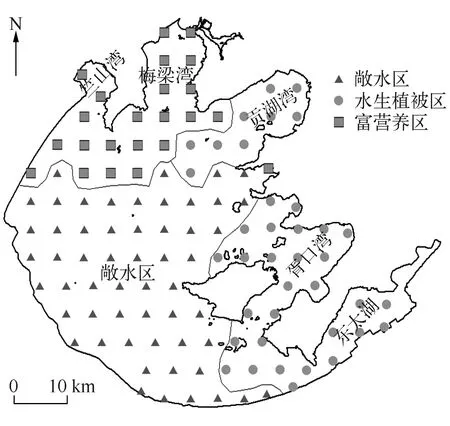
图1 太湖大型底栖动物调查点位及聚类组空间分布Fig.1 Distribution of sampling sites and spatial distribution of affinity groups in Lake Taihu
太湖(30°55′40″~31°32′58″N,119°52′32″~120°36′10″E)是我国第3大淡水湖,位于长江三角洲太湖平原上,面积2338km2,平均水深1.9m[12].太湖流域人口稠密、经济发达,加上近年来以牺牲环境为代价的发展方式,极大程度地改变了太湖生源要素的循环规律,加速太湖富营养化进程.太湖生态系统结构功能退化,蓝藻频频暴发,水质性缺水日趋严重,并造成巨大经济损失,严重制约着区域社会和经济的可持续发展.太湖的富营养化问题自1988年以来就比较突出,1990s以来水华频繁暴发,主要集中在太湖北部的梅梁湾、竺山湾.近年来水华范围向大太湖扩展,大浦口、贡山湾以及马山南部一带都出现了大面积的水华[13-15].2007年的监测结果显示,太湖湖心区出现严重的蓝藻水华[16].近几年来,太湖水华暴发的趋势有增无减[17],严重阻碍了周边地区的生产、生活活动,也对湖泊生态系统生物类群产生了极大的影响.这些都源于太湖水生态系统的功能紊乱[18].
为全面调查太湖底栖动物群落结构与空间分布,将全湖分割成116个5km×5km的样方,采样点位于样方的中心.在2014年1月和6月,太湖分别处于低水位和高水位时,进行野外环境参数监测和样品采集(图1).现场测定水体透明度(SD)、水深(WD)、泥深(SeD),使用YSI 6600V2型多参数水质监测仪测定水体底层水温(WT)、pH、电导率(Cond)、溶解氧饱和度(DO%)、浊度(Tur)、溶解性固体总量(TDS),同时采集水样和表层沉积物样品并冷藏保存,带回实验室.现场使用0.0625m2的改良彼得森采泥器,在每个采样点附近3个不同位置分别抓取一下记为一个样品,现场用60目尼龙筛网筛洗干净之后,将网内留下的残渣装入保鲜袋带回实验室.现场估测采样点附近区域水生植物覆盖情况,按覆盖度为0、1%~25%、26%~50%、51%~75%和76%~100%,水生植物覆盖度指数(Macrophytes)分别赋值为0~4.

将沉积物残渣放在白色解剖盘中,将底栖动物逐一挑出,样本用10%的福尔马林保存.利用解剖镜和显微镜,将标本鉴定至尽可能低的分类单元[20-22],然后用滤纸吸去表面固定液,置于万分之一电子天平上称重,并将结果折算成单位面积的密度和生物量.
1.2 数据分析
数据分析之前,对底栖动物密度、生物量进行对数转换,以降低密度或生物量占优势的个别物种对群落结构的影响权重,对环境因子参数进行方差为1的标准化转换.
采用ArcGIS 10.2软件绘制底栖动物的空间分布图,将底栖动物按照纲分成双壳纲(Bivalvia)、腹足纲(Gastropoda)、甲壳纲(Crustacea)、寡毛纲(Oligochaeta)和多毛纲(Polychaeta)5个类群;另外根据蔡永久等[8,11]的调查可知太湖昆虫纲以摇蚊科(Chironomidae)占优势,将昆虫纲里的摇蚊科单独列为1个类群;将出现次数较少的蛭纲和其他昆虫合为其它类群.
对采样点环境变量进行PCA主成分分析,并利用Spearman相关性分析,剔除相关性较差的环境变量.基于各采样点环境变量的Bray-Curtis相似性测度系数,采用加权成对平均法(weighted pair group method using arithmetic averages)对116个采样点进行聚类分析.基于聚类分析结果,利用ANOSIM(one-way analysis of similarities)检验各聚类组环境变量的差异性.
为评价各湖泊营养状态,参照蔡庆华等改进的湖泊富营养化评价综合模型计算各点的营养状态指数(TSI)[23].比较不同湖区的TSI指数、优势物种密度和生物量、优势度(Y)、相对重要性指数(IRI)、多样性指数和均匀度指数,并用K-优势曲线评估各湖区大型底栖动物的生物多样性.利用SIMPER分析(similarity percentages)找出对组内相似性贡献最大的种类,分析软件采用PRIMER 5.0[24].
用K-优势曲线来评估各组大型底栖动物的多样性[25],同时结合多样性指数比较各聚类组的多样性.
Shannon-Wiener多样性指数H′[26]:
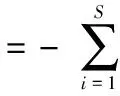
(1)
Pielou均匀度指数J[27]:
J=H′/Hmax=H′/lnS
(2)
式中,S为群落内的种类总数,ni为第i个种的个体数,N表示所有种类总个体数.
2 结果
2.1 太湖生态环境特征的空间变化

图2 太湖116个采样点环境因子主成分分析Fig.2 Principal component analysis of 116 sampling sites in Lake Taihu


2.2 太湖大型底栖动物群落结构
2.2.1 太湖大型底栖动物组成、平均密度及生物量 本次调查获得232份样品,共鉴定到大型底栖动物55种,隶属7纲18目27科52属(表2),其中软体动物腹足纲6科8属9种(16.4%)、双壳类4科10属10种(18.2%),甲壳纲4科6属6种(10.9%),寡毛纲2科3属4种(7.3%),多毛纲4科4属4种(7.3%),摇蚊科幼虫12属15种(27.3%),其他类6种(10.9%),这些都是长江中下游的常见种.
平均每个采样点采集到大型底栖动物8.5种,最大值出现在胥口湾(16种).出现率最高的是河蚬(83.6%),其次分别是寡鳃齿吻沙蚕(64.7%)、铜锈环棱螺(62.1%)、太湖大螯蜚(60.3%)、拟背尾水虱(58.6%)、背蚓虫(54.3%)、苏氏尾鳃蚓(50.0%)和霍甫水丝蚓(46.6%).全湖底栖动物平均密度和生物量分别为405.5ind./m2和146.6g/m2.
2.2.2 太湖大型底栖动物密度的空间分布 大型底栖动物平均密度空间差异较大(图3),最高值出现在太湖北部的梅梁湾、竺山湾、河口及南太湖沿岸带,并在大浦河口达到最大(5886.7ind./m2),在湖心区域平均密度相对较低.底栖动物平均生物量空间变化也较大(图3),生物量最高值出现在梅梁湾、竺山湾,从湾口向湖心区域延伸生物量逐渐降低.双壳纲、甲壳纲及腹足纲是现阶段太湖底栖动物的优势类群,其在各采样点的密度和生物量占全湖总密度和生物量比例的平均值分别为52.0%和99.4%,但在各个湖区的分布和优势程度有着显著差异.
软体动物在全湖均有出现,主要分布在贡湖湾、西部湖区、东太湖及东部湖湾,河蚬和铜锈环棱螺是软体动物的优势种,占软体动物总密度和生物量的78.94%和87.24%,但空间分布格局差异较大.河蚬除在贡湖湾和东太湖湖区分布较少以外,在全湖广泛分布,全湖平均密度和生物量在所有底栖动物中最高,分别达到100.0ind./m2和105.5g/m2,最大密度和生物量分别为1943.0ind./m2和1085.3g/m2.铜锈环棱螺密度最高值出现在胥口湾和南太湖(全湖平均密度和生物量分别为13.0ind./m2和21.8g/m2,最大密度和生物量分别为93.3ind./m2和176.1g/m2),同时在东部湖湾及贡湖湾密度也较高(83.0ind./m2),而湖心和西部湖区铜锈环棱螺分布较少(<10.0ind./m2).
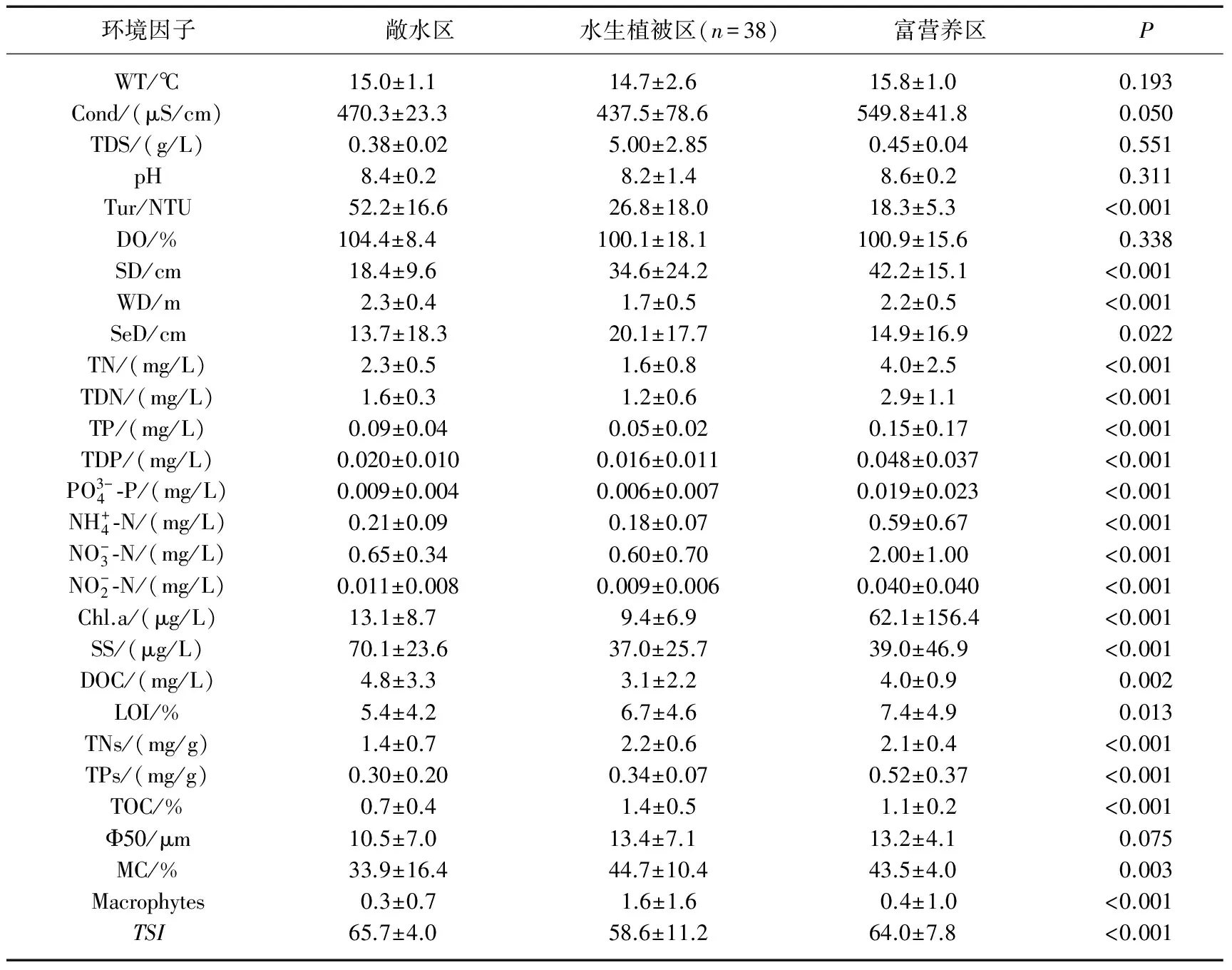
表1 太湖各聚类组水体和沉积物理化参数方差分析*
*P<0.05表示各区差异显著,P>0.05表示各区差异不显著;P值无单位.
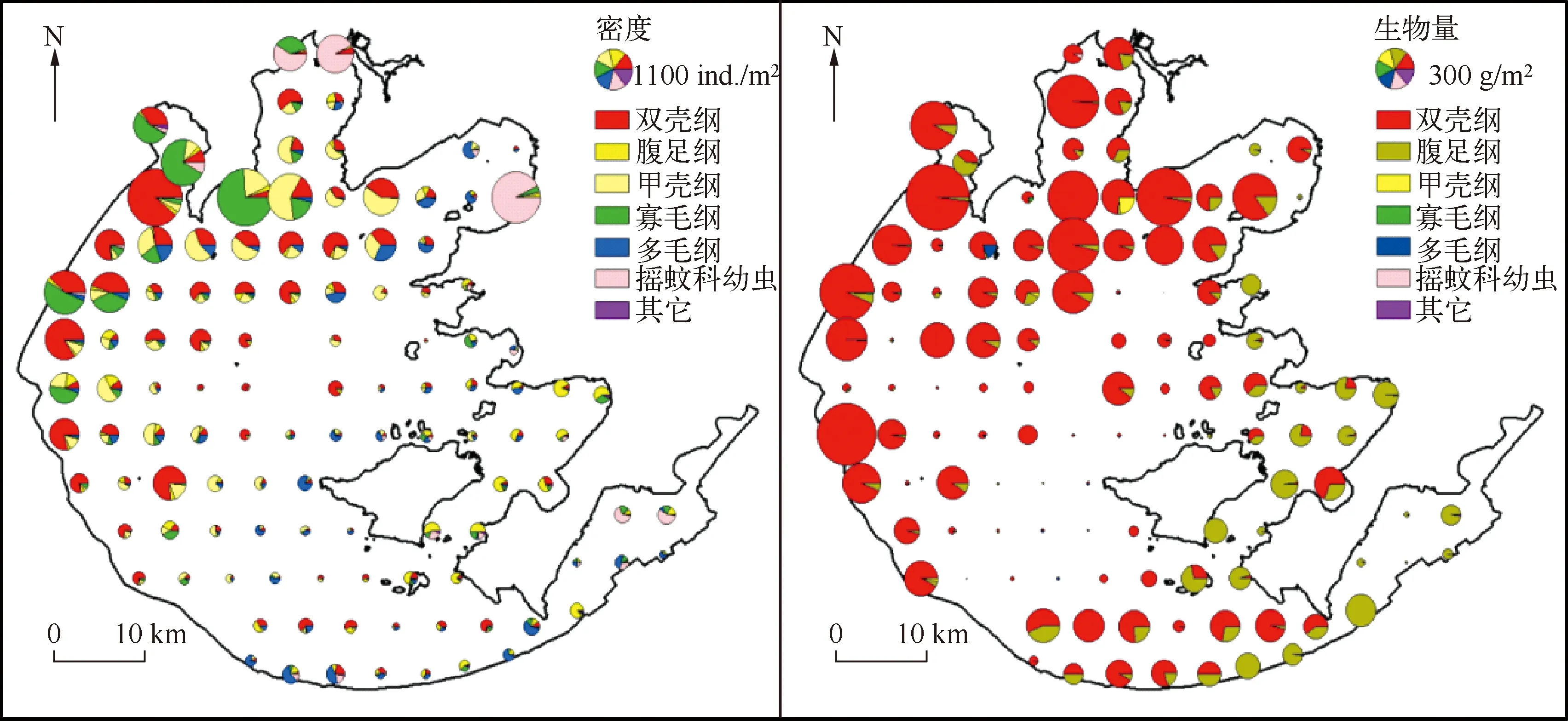
图3 太湖大型底栖动物7个类群密度和生物量的空间分布Fig.3 Spatial distribution patterns of density and biomass for seven macrozoobentho groups in Lake Taihu
表2 太湖大型底栖动物种类组成、出现频率、密度、生物量、优势度和IRI指数*
Tab.2 The species composition, frequency, density, biomass, dominance index andIRIindex of macrozoobenthos in Lake Taihu

物种出现频率/%密度/(ind./m2)生物量/(g/m2)YIRI寡毛纲 霍甫水丝蚓(Limnodrilushoffmeisterii)46.655.00.1648.36650.63 巨毛水丝蚓(L.grandisetosus)5.27.00.08.698.70 苏氏尾鳃蚓(Branchiurasowerbyi)50.015.00.2186.24191.84 头鳃蚓属一种(Branchiodrilussp.)6.00.00.00.310.31多毛纲 寡鳃齿吻沙蚕(Nephtysoligobranchia)64.717.00.1282.68287.52 日本沙蚕(Nereisjaponica)22.43.00.017.7718.07 背蚓虫(NotomastuslatericeusSars)54.38.00.4111.42124.40 缨鳃虫(Sabellapavonina)12.91.00.02.823.04蛭纲 泽蛭(Helobdellafusca)2.60.00.00.060.06 宽身舌蛭(Glossiphonialata)8.61.00.01.321.34甲壳纲 太湖大螯蜚(Grandidierellaaihuensis)60.344.00.5668.60690.90 蜾贏蜚属一种(Corophiumsp.)1.70.00.00.040.04 秀丽白虾(Exopalaemonmodestus)1.70.00.10.030.09 日本沼虾(Macrobrachiumnipponense)3.40.00.10.130.27 中华齿米虾(Neocaridinadenticulatesinensis)2.60.00.00.190.21 拟背尾水虱属一种(Paranthurasp.)58.618.00.2270.80277.10昆虫纲 羽摇蚊(Chironomusplumosus)11.21.00.03.753.80 菱跗摇蚊属一种(Clinotanypussp.)2.60.00.00.170.17 林间环足摇蚊(Cricotopussylvestris)4.31.00.00.750.75 隐摇蚊属一种(Cryptochironomussp.)14.71.00.04.454.46 真开氏摇蚊属一种(Eukiefferiellasp.)1.70.00.00.060.06 浅白雕翅摇蚊(Lyptotendipespallens)0.90.00.00.030.03 德永雕翅摇蚊(G.tokunagai)2.60.00.00.060.06 多巴小摇蚊(Microchironomustabarui)5.250.00.066.1166.15 软铗小摇蚊(M.tener)1.70.00.00.050.05 拟突摇蚊属一种(Paracladiussp.)1.70.00.00.030.03 小云多足摇蚊(Ploypedilumnubeculosum)0.90.00.00.010.01 梯形多足摇蚊(P.scalaenum)6.91.00.01.451.47 红裸须摇蚊(Propsilocerusakamusi)13.820.00.170.6471.36 前突摇蚊属一种(Procladiussp.)10.31.00.01.941.94 中国长足摇蚊(Tanypuschinensis)14.76.00.023.7723.97 细蟌属一种(Agrionemissp.)3.40.00.00.100.10 新叶春蜓属一种(Sinictinogomphussp.)1.70.00.00.030.04 开臂蜻属一种(Zyxommasp.)0.90.00.00.010.01 细蜉属一种(Caenissp.)4.30.00.00.190.19 石蛾科一种(Dolophilodessp.)0.90.00.00.010.01双壳纲 背角无齿蚌(Anodontawoodiana)3.40.00.90.102.11 扭蚌(Arconaialanceolata)2.60.01.90.063.42 三角帆蚌(Hyriopsiscumingii)2.60.08.10.0614.40 背瘤丽蚌(Lamprotulaleai)0.90.05.00.012.94 短褶矛蚌(Lanceolariagrayana)0.90.00.00.010.01 圆顶珠蚌(Uniodouglasiae)1.70.00.20.030.21 中国淡水蛏(Novaculinachinensis)16.41.00.25.487.33 河蚬(Corbiculafluminea)83.6100.0105.52121.088140.72 湖球蚬(Sphaeriumlacustre)43.113.00.4144.56156.85 淡水壳菜(Limnopernafortunei)5.20.00.00.300.34腹足纲 铜锈环棱螺(Bellamyaaeruginosa)62.113.021.8204.551128.47 方格短沟蜷(Semisulcospiracancellata)11.22.00.44.657.87 光滑狭口螺(Stenothyraglabra)46.68.00.195.8499.24 大沼螺(Parafossaruluseximius)5.20.00.10.400.57 纹沼螺(P.striatulus)8.61.00.11.571.99 长角涵螺(Alocinmalongicornis)17.22.00.28.0010.16 尖口圆扁螺(Hippeutiscantori)2.60.00.00.320.33 大脐圆扁螺(H.umbilicalis)2.60.00.00.060.06 椭圆萝卜螺(Radixswinhoei)7.81.00.11.922.23
*IRI=(相对生物量+相对丰度)×物种出现频率.密度和生物量数据为全湖平均值.
寡毛纲分布较为普遍,其密度最高值出现在竺山湾及大浦河河口,而在其他区域密度较低.优势度分析表明霍甫水丝蚓是颤蚓类的优势种,占颤蚓类总密度的74.8%,霍甫水丝蚓全湖平均密度和生物量分别为55.0ind./m2和0.1g/m2,最大值均出现在大浦河河口,分别达到3880.0ind./m2和2.7g/m2.值得注意的是,霍甫水丝蚓平均密度呈自敞水区向梅梁湾深处不断升高的趋势.
除西部沿岸带外,多毛纲的寡鳃齿吻沙蚕在全湖均有发现,全湖平均密度和生物量分别为17.0ind./m2和0.1g/m2,在敞水湖区和南太湖湖区密度较高,最高值可达213.0ind./m2,但生物量在梅梁湾最高,达2.4g/m2,较大个体分布在北部营养水平较高的湖区.
摇蚊幼虫在太湖大型底栖动物总密度中所占比例很低(0.1%),且主要分布在梅梁湾、竺山湾、贡湖湾和东太湖的沿岸带.其中梅梁湾、竺山湾种类较少,但密度较高,其优势种为中国长足摇蚊和红裸须摇蚊,平均密度为303.0ind./m2,占摇蚊总密度的94.0%;东太湖和东部湖湾摇蚊幼虫密度较低(<34.0ind./m2),但种类丰富度相对较高.
太湖大螯蜚和拟背尾水虱属一种是甲壳纲中优势度较高的物种,全湖平均密度分别为44.0和18.0ind./m2,最大密度分别为1227.0和181.0ind./m2,主要分布在梅梁湾、贡湖湾及西部湖区,而在东部湖湾和东太湖密度很低(<10.0ind./m2).
2.2.3 太湖大型底栖动物群落结构和多样性 基于环境因子的聚类分析结果,利用Bray-Curtis相似性指数计算3个湖区底栖动物群落相似性水平,结果表明3种类型湖区底栖动物群落结构具有显著性差异,敞水区与水生植被区、敞水区与富营养区、水生植被区与富营养区的相似性百分比分别为80.57%、80.3%、86.95%.敞水区的特征种为河蚬、拟背尾水虱属一种、太湖大螯蜚、寡鳃齿吻沙蚕和背蚓虫,SIMPER分析表明这5个种类对组内相似性贡献率最大(累积达到86.33%).水生植被区的特征种主要是铜锈环棱螺、寡鳃齿吻沙蚕、河蚬、苏氏尾鳃蚓、背蚓虫和长角涵螺,其对组内相似性的累积贡献率为80.11%.富营养区特征种为河蚬、太湖大螯蜚、拟背尾水虱属一种、霍甫水丝蚓以及铜锈环棱螺,其对组内相似性的累积贡献率为82.25%(表3).

图4 太湖各聚类组大型底栖动物K-优势曲线、H′、J和TSI指数Fig.4 K-dominant curves, Shannon-Wiener diversity, Pielou evenness index of macrozoobentho community and TSI index for each affinity group in Lake Taihu
K-优势曲线(图4)显示,水生植被区曲线位于其他曲线之下,且明显长于其他曲线,说明水生植被区物种丰富度高于敞水区和富营养区,且物种的个体分布更均匀.敞水区曲线低于富营养区,但曲线长度相当,两区内物种数相同,但敞水区的物种均匀度指数较富营养区高.Shannon-Wiener指数和Pielou指数分析表明,各聚类组底栖动物多样性具有显著差异,其多样性与K-优势曲线结果一致,多样性顺序为水生植被区>敞水区>富营养区(one-way ANOVA,P<0.05).
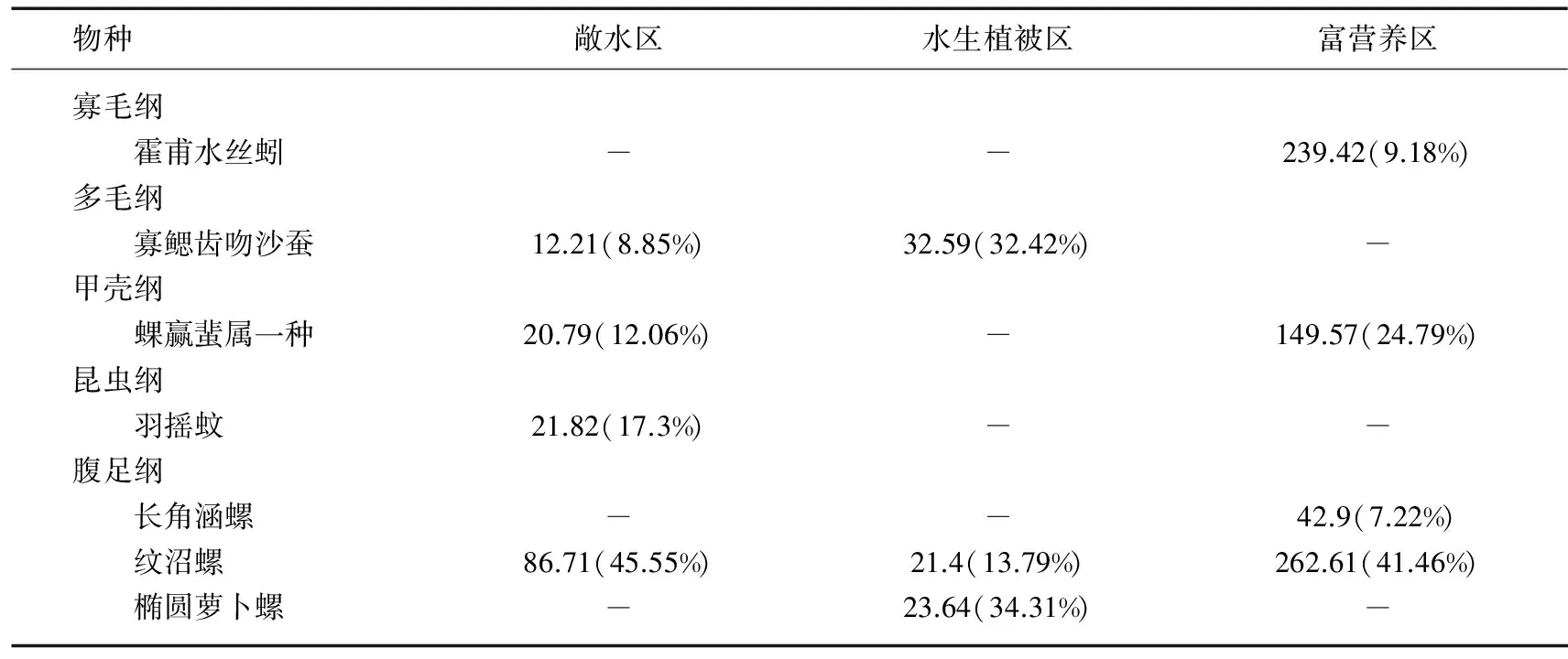
表3 太湖不同类型湖区底栖动物群落特征种类平均密度及其对组内相似性贡献百分比*
*括号外数据为平均密度(单位为ind./m2),括号内数据为相似性贡献百分比.
2.3 群落结构与环境因子的相关性分析



图5 太湖大型底栖动物优势种与环境因子关系的典范对应分析Fig.5 The CCA biplots showing the relationship between dominant species and environmental factors in Lake Taihu
3 讨论
3.1 太湖大型底栖动物群落结构历史变化
1960s以来太湖不断受到生活、工业污水的影响,水质由Ⅰ~Ⅱ类不断恶化至劣Ⅴ类,水生植被分布面积不断缩减,在局部湖湾甚至消亡,逐渐被压缩到东部湖湾地区[28],底栖动物群落组成与结构也发生了显著变化.1960s以来,对太湖进行了数次的底栖动物全湖大调查[8-10,29-30],结果表明底栖动物种类数最高记录为59种.本研究的两次调查共鉴定出55种,而且冬、夏季两次采样获得的底栖动物物种种类也不完全相同,冬季物种数低于夏季.《中国湖泊志》中记录的太湖大型底栖动物密度和生物量分别为187.0ind./m2和78.6g/m2,优势物种为河蚬、霍甫水丝蚓、光滑狭口螺、摇蚊幼虫、颤蚓、沙蚕、环棱螺和中国圆田螺[30].蔡永久等[11]记录了太湖40种大型底栖动物,平均密度和生物量分别为3771.8ind./m2和141.9g/m2,优势种为霍甫水丝蚓、中华河蚓、河蚬、铜锈环棱螺、中国长足摇蚊和钩虾属一种(表4).

表4 历次调查中太湖底栖动物的物种数、优势种类、平均密度和平均生物量
本研究调查发现腹足纲、双壳纲和甲壳纲种类增多,寡毛纲种类有所减少.河蚬一直是太湖的优势物种,中华河蚓和中国长足摇蚊的优势度有所降低,而寡鳃齿吻沙蚕和拟背尾水虱属一种的优势度升高,成为太湖的优势物种.底栖动物的平均密度和生物量都显著增加,分别达到405.5ind./m2和146.6g/m2.霍甫水丝蚓集中分布在竺山湾和大浦河河口湖区,但密度和生物量分别由最高的17080ind./m2和68.2g/m2显著降低到本次调查的3880.0ind./m2和5.218g/m2(2次监测的平均值).与蔡永久等[8]对太湖32个采样点一周年的调查相比,本研究获得的底栖动物种类更多,平均密度和生物量都显著增加,但优势种物种组成没有变化.
3.2 太湖大型底栖动物空间格局及生境特征分析
本次调查结果表明,太湖水生态环境在空间上具有显著差异,聚类分析将全湖分为3个区,即敞水区、水生植物区和富营养区,结合采样点的大型底栖动物特征发现,各区底栖动物群落结构差异显著.敞水区大型底栖动物优势种为河蚬、拟背尾水虱、太湖大螯蜚和寡鳃齿吻沙蚕.该区沉积物属于粉砂、黏土质粉砂类型,粒径范围较广[33],受风浪影响较大,底泥扰动强烈[34-35],水体含氧量较高,这些特征更有利于河蚬的滤食,因此河蚬密度高值出现在该区.
根据现场记录和历史调查[36-38],水生植被区位于东部湖湾区贡湖湾、胥口湾和东太湖,大型底栖动物优势种为铜锈环棱螺、河蚬和寡鳃齿吻沙蚕.水生植物是许多周丛生物生存的基础,生活在植物根际上面的细菌、真菌、藻类、原生动物、轮虫、线虫、大型底栖动物构成周丛生物群落,形成一个错综复杂的食物网[39].根据螺-草互利理论(mutualistic theory),水生植物为底栖软体动物提供栖息、捕食和躲避天敌场所[40-43].
富营养区位于梅梁湾、竺山湾及大浦河河口,该区域受入湖污水影响较大,是污染最严重、水华暴发最频繁的区域[33,35].秦伯强等的研究表明,受动力作用影响较大的悬浮物在冬季偏北风作用下, 湾口的浓度远高于湾内,虽然敞水区的TSI营养指数低于富营养区,但因为采样期间湖心区风浪较大,透明度低于其它湖区,该区富营养水平更高[34].这样的生境状况中耐污能力较强的种类生存能力更强,从而使其在竞争中处于优势地位,直接表现为寡毛纲颤蚓类在该区域占绝对优势,同时耐污能力较强的中国长足摇蚊和摇蚊属幼虫也集中分布在该区域.
3.3 太湖大型底栖动物多样性及影响因子
底栖动物群落受多种环境因素的影响,这些环境因素通常表现出较强的时空异质性[44].不同的区域环境状况不同,影响底栖动物群落分布的环境因素也不同[45].本文通过环境因子的CCA分析,发现水生植物、水深、沉积物有机质、电导率等是影响太湖底栖动物物种分布的主要影响因子.
沉水植物和漂浮植物主要分布在水质相对较好的东部湖湾内,而且较其他湖区具有更高的多样性[38],其为底栖动物提供了更加多样的栖息、繁殖场所,也有利于底栖动物逃避其他动物的捕食,从而增加了可供更多底栖动物生存的生境空间,底栖动物多样性较高.水生植物能够改变底质-水界面的水动力状况,影响底栖动物的附着和饵料有机碎屑的沉积[46].闫云君等在研究草型和藻型湖泊底栖动物群落结构时也发现草型湖泊底栖动物多样性显著高于藻型湖泊[47].敞水区和富营养区基本无水草分布,因此很多依靠水草生存及庇护的种类在该区域的密度和生物量很低,甚至未出现.
湖泊表层沉积物是大型底栖动物的栖息地,为大型底栖动物提供穴居、躲避捕食和不利环境影响的场所,也为食底泥者提供充足饵料[48].粒径大小决定沉积物类型,沉积物粒径大小也是影响底栖动物群落结构的主要因素之一[49].沉积物粒径大小与有机质和有机污染物的富集有关,粒径较小的沉积物更易结合有机质,进而对底栖生物产生影响[50].段学花等研究底质对底栖动物多样性的影响时也发现,颗粒粒径大、孔隙率大的底质具有更高的生物多样性[51].有机质通常与软底质结合,较细的底质中有机质含量较高,底栖动物丰度也较高.饵料有机质是影响底栖动物群落分布的限制性因子之一,底栖动物的生物量和分布格局与食物来源密切相关[52].
湖心区底栖动物均匀度显著高于富营养区,分析其原因,可能是湖心区表层沉积物为砂质淤泥,其粒径范围较广的底质不仅为附生生物提供了很大的附着面积,其形成的众多小生境也为底栖动物提供了生存空间和庇护场所,从而增加了某些种类的生存机会.相比之下,富营养区沉积物粒径偏细[33,35],粒径范围较窄,使得底质生境的异质性较低,难以支持更多种类的生存,而且有机质丰富、分解作用强烈导致该区域溶解氧较低,限制了敏感种类的生存,而耐污能力较强的颤蚓类则大量繁殖,成为绝对优势种,从而导致物种均匀度相对较低.
3.4 富营养化对太湖大型底栖动物群落的影响
在陆地和水生态系统中,多数较小尺度的研究却得出物种多样性的单峰分布,即在中度营养水平的生境中具有最高的物种多样性[53].一般来说,中等营养水平下生物群落结构最复杂,物种多样性最高,而极端贫营养和超富营养条件下群落结构简单、多样性低[54].龚志军等研究水体富营养化对武汉东湖大型底栖动物多样性影响时发现多样性与水体营养水平呈相反的趋势,富营养化导致多样性明显降低[53].熊金林等在研究湖北4个不同营养水平湖泊大型底栖动物群落结构时也发现,大型底栖动物种类数、物种多样性与湖泊富营养程度呈负相关[55].
太湖是典型的富营养化湖泊,且各湖区营养水平差异较大[28],各湖区大型底栖动物群落结构的差异在一定程度上反映了富营养化对底栖动物群落结构的影响.梅梁湾是太湖的典型富营养化湖湾,伴随着水生植被分布面积不断缩减直至消亡,大型底栖动物群落优势种也从河蚬、环棱螺变成摇蚊属幼虫和水丝蚓[56],其原因是随着营养水平的不断升高,小个体的耐污种类(主要是寡毛类和摇蚊幼虫)密度不断升高,而耐污能力较差的软体动物密度不断降低.
从K-优势曲线可以看出,水生植被区的物种丰富度高于其它湖区,且物种的个体分布更均匀.敞水区的曲线低于富营养区,但曲线长度相当.在太湖的富营养状态下,物种多样性随湖区营养水平增加而降低,即底栖动物多样性随着水体营养水平的增加而降低.底栖动物总密度和生物量随营养水平升高而升高.富营养湖区水体营养盐浓度更高,沉积物TNs、TPs含量也高于其它湖区,为底栖动物提供了较其它湖区更充足的食物,总生物量和密度高于其它湖区.从水生植被区到敞水区再到富营养区,底栖动物物种多样性随营养水平升高而降低,但总密度和生物量显著增加.
本研究表明,现阶段太湖处于富营养水平,底栖动物多样性与营养状态呈显著负相关,即底栖动物群落随营养水平升高而趋于简单化,而物种密度和生物量与营养水平呈正相关.太湖北部梅梁湾、竺山湾及河口以寡毛纲颤蚓类为绝对优势种,底栖动物多样性最低,到了贡湖湾、湖心及西湖区优势种变为瓣鳃纲河蚬和迁移能力较强的拟背尾水虱、太湖大螯蜚、寡鳃齿吻沙蚕,在水生植物丰富的东部湖湾和东太湖多样性最高,优势种为腹足纲螺类.分析结果表明营养水平、底质类型以及水生植被的分布是决定太湖大型底栖动物群落结构及多样性的关键因子.
致谢:感谢汤祥明、邵克强、吴挺峰老师在采样过程中的指导和帮助,感谢邓建明、牛城、胡洋师兄,周永强、刘颢、王振、丁胜荣在采样过程中的帮助,感谢李枫和薛静琛老师在采样过程中提供的后方支援,让辛苦的采样工作变得快乐且丰富.
[1] 彭松耀.黄东海大型底栖动物群落结构特征[学位论文].北京:中国科学院海洋研究所,2013.
[2] 许木启,张知彬.我国无脊椎动物生态学研究进展概述.动物学报,2002,48(5): 689-694.
[3] Masero JA, Pérez-González M, Basadre Metal. Food supply for waders(Aves: Charadrii) in an estuarine area in the Bay of Cadiz(SW Iberian Peninsula).ActaOecologica, 1999, 20(4): 429-434.
[4] Rhoads DC, Young DK. The influence of deposit-feeding organisms on sediment stability and community trophic structure.JournalofMarineResearch, 1970, 28(2): 150-178.
[5] Yan YJ, Liang YL, Wang HZ. Annual production of five species of Chironomidae(Diptera) in Houhu Lake, a typical algal lake(Wuhan, China).ChineseJournalofOceanologyandLimnology, 1999, 17(2): 112-118.
[6] Dauvin JC, Ruellet T. The estuarine quality paradox: is it possible to define an ecological quality status for specific modified and naturally stressed estuarine ecosystems?MarinePollutionBulletin, 2009, 59(1): 38-47.
[7] Underwood A, Chapman M. Scales of spatial patterns of distribution of intertidal invertebrates.Oecologia, 1996, 107(2): 212-224.
[8] 蔡永久,龚志军,秦伯强.太湖大型底栖动物群落结构及多样性.生物多样性,2010,18(1): 50-59.
[9] 蔡 炜,蔡永久,龚志军等.太湖河蚬时空格局.湖泊科学,2010,22(5): 714-722.DOI 10.18307/2010.0513.
[10] 李 艳,蔡永久,秦伯强等.太湖霍甫水丝蚓(LimnodrilushoffmeisteriClaparede)的时空格局.湖泊科学,2012,24(3): 450-459.DOI 10.18307/2012.0318.
[11] 蔡永久,龚志军,秦伯强.太湖软体动物现存量及空间分布格局(2006-2007年).湖泊科学,2009,21(5): 713-719.DOI 10.18307/2009.0516.
[12] Qin B. Hydrodynamics of Lake Taihu, China.Ambio, 1999, 8: 668-672.
[13] 秦伯强,吴庆龙,高俊峰等.太湖地区的水资源与水环境——问题、原因与管理.自然资源学报,2002,17(2): 221-228.
[14] 秦伯强,王小冬,汤祥明等.太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策.地球科学进展,2007,22(9): 896-906.
[15] 朱广伟,高 光,秦伯强等.浅水湖泊沉积物中磷的地球化学特征.水科学进展,2003,14(6): 714-719.
[16] 段洪涛,张寿选,张渊智.太湖蓝藻水华遥感监测方法.湖泊科学,2008,20(2): 145-152.DOI 10.18307/2008.0202.
[17] Zhu G, Wang F, Zhang Y. Hypoxia and its environmental influences in large, shallow, and eutrophic Lake Taihu, China.VerhandlungenderInternationalenVereinigungfürTheoretischeundAngewandteLimnologie, 2008, 30(3): 361-365.
[18] Rapport DJ. Ecosystem health: an emerging integrative science. In: Rapport DJ, Gaudet CL, Calow P eds. Evaluating and monitoring the health of large-scale ecosystems. Berlin: Springer, 1995: 5-31.
[19] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4版.北京:中国环境科学出版社,2002.
[20] 刘月英.中国经济动物志:淡水软体动物.北京:科学出版社,1979.
[21] Morse JC, Yang LF, Tian LX. Aquatic insects of China useful for monitoring water quality. Nanjing: Hohai University Press, 1994.
[22] 刘建康.高级水生生物学.北京:科学出版社,1999.
[23] 蔡庆华,刘建康,King L.评价湖泊富营养化的一个综合模型.应用生态学报,2002,13(12): 1674-1678.
[24] 周 红,张志男.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用.青岛海洋大学学报,2003,33(1): 58-64.
[25] Warwick RM. A new method for detecting pollution effects on marine macrobenthic communities.MarineBiology, 1986, 92: 557-562.
[26] Simpson EH. Measurement of diversity.Nature, 1949, 163: 688.
[27] Smith B, Wilson JB. A consumer's guide to evenness indices.Oikos, 1996, 76(1): 70-82.
[28] 朱广伟.太湖富营养化现状及原因分析.湖泊科学,2008,20(1): 21-26.DOI 10.18307/2008.0103.
[29] 秦伯强.太湖地区中国太湖水动力学研究.AMBIO-人类环境杂志,1999,8: 668-672.
[30] 王苏民,窦鸿身.中国湖泊志.北京:科学出版社,1998: 261-268.
[31] 秦伯强,胡维平,陈伟民等.太湖水环境演化过程与机理.北京:科学出版社,2004: 275-282.
[32] 蔡启铭.太湖环境生态研究(一).北京:气象出版社,1998: 55-62.
[33] 黃漪平.太湖水环境及其污染控制.北京:科学出版社,2001: 72-82.
[34] 秦伯强,胡维平,陈伟民等.太湖梅梁湾水动力及相关过程的研究.湖泊科学,2000,12(4): 327-335.DOI 10.18307/2000.0406.
[35] 秦伯强,胡维平,高 光等.太湖沉积物悬浮的动力机制及内源释放的概念性模式.科学通报,2003,48(17): 1822-1831.
[36] 雷泽湘.太湖大型水生植被及其环境效应研究[学位论文].广州:暨南大学,2006.
[37] 谷孝鸿,张圣照,白秀玲等.东太湖水生植物群落结构的演变及其沼泽化.生态学报,2005,25(7): 1541-1548.
[38] 刘伟龙,胡维平,陈永根等.西太湖水生植物时空变化.生态学报,2013,27(1): 159-170.
[39] Carpenter SR, Lodge DM. Effects of submersed macrophytes on ecosystem processes.AquaticBotany, 1986, 26: 341-370.
[40] Thomas J. Mutualistic interactions in freshwater modular systems with molluscan components.AdvancesinEcologicalResearch, 1990, 20: 125-178.
[41] Jones MM, Tuomisto H, Borcard Detal. Explaining variation in tropical plant community composition: influence of environmental and spatial data quality.Oecologia, 2008, 155(3): 593-604.
[42] Underwood GJC, Thomas JD, Baker JH. An experimental investigation of interactions in snail-macrophyte-epiphyte systems.Oecologia, 1992, 91: 582-595.
[43] Thomas JD, Eaton P. The spatio-temporal patterns and ecological significance of free amino acids and humic substances in contrasting oligotrophic and eutrophic freshwater ecosystems.Hydrobiologia, 1996, 332: 183-211.
[44] Chapman PM, Wang F. Assessing sediment contamination in estuaries.EnvironmentalToxicologyandChemistry, 2001, 20(1): 3-22.
[45] Ysebaert T, Herman PM. Spatial and temporal variation in benthic macrofauna and relationships with environmental variables in an estuarine, intertidal soft-sediment environment.MarineEcologyProgressSeries, 2002,244(4):105-124.
[46] Barry JP, Dayton PK. Physical heterogeneity and the organization of marine communities.EcologicalHeterogeneity, 1991, 86: 270-320.
[47] 闫云君,李晓宇,梁彦龄.草型湖泊和藻型湖泊中大型底栖动物群落结构的比较.湖泊科学,2005,17(6): 176-182.DOI 10.18307/2005.0614.
[48] MacIntyre HL, Geider RJ, Miller DC. Microphytobenthos: the ecological role of the “secret garden” of unvegetated, shallow-water marine habitats. I. Distribution, abundance and primary production.Estuaries, 1996, 19(2): 186-201.
[49] Van Hoey G, Degraer S, Vincx M. Macrobenthic community structure of soft-bottom sediments at the Belgian Continental Shelf.Estuarine,CoastalandShelfScience, 2004, 59(4): 599-613.
[50] Thompson B, Lowe S. Assessment of macrobenthos response to sediment contamination in the San Francisco Estuary, California, USA.EnvironmentalToxicologyandChemistry, 2004, 23(9): 2178-2187.
[51] 段学花,王兆印,田世民.河床底质对大型底栖动物多样性影响的野外试验.清华大学学报:自然科学版,2007,47(9): 1553-1556.
[52] Peeters ET, Gylstra R, Vos JH. Benthic macroinvertebrate community structure in relation to food and environmental variables.Hydrobiologia, 2004, 519(1/2/3): 103-115.
[53] 龚志军,谢 平,唐汇娟等.水体富营养化对大型底栖动物群落结构及多样性的影响.水生生物学报,2001,25(3): 210-216.
[54] Gong ZJ, Xie P. Impact of eutrophication on biodiversity of the macrozoobenthos community in a Chinese shallow lake.JournalofFreshwaterEcology, 2001, 16(2): 171-178.
[55] 熊金林,梅兴国,胡传林.不同污染程度湖泊底栖动物群落结构及多样性比较.湖泊科学,2003,15(2): 160-168.DOI 10.18307/2003.0210.
[56] 秦伯强,罗潋葱.太湖生态环境演化及其原因分析.第四纪研究,2004,24(5): 561-568.
Community structure of macrozoobenthos and the evaluation of water environment in Lake Taihu
XU Hao1,2, CAI Yongjiu1, TANG Xiangming1, SHAO Keqiang1, QIN Boqiang1& GONG Zhijun1
(1:StateKeyLaboratoryofLakeScienceandEnvironment,NanjingInstituteofGeographyandLimnology,ChineseAcademyofSciences,Nanjing210008,P.R.China)
(2:UniversityofChineseAcademyofSciences,Beijing100049,P.R.China)
To characterize the community structure of macrozoobenthos and to examine their relationships with environmental factors,macrozoobenthos were investigated at 116 sites of Lake Taihu in winter and summer of 2014. A total of 55 species were recorded, belonging to 3 phyla, 7 classes, 18 orders and 27 families. The mean density and biomass of macrozoobenthos were 405.5 ind./m2and 146.6 g/m2, respectively.Corbiculafluminea,Bellamyaaeruginosa,Limnodrilushoffmeisteri,Grandidierellaaihuensis,NephtysoligobranchiaandParanthurasp. were the dominant species in Lake Taihu. The 116 sampling sites were classified into three groups based on cluster analysis using environmental factors. One-way ANOVA showed that environmental factors differed significantly among the three groups. Analysis of similarities and non-metric multidimensional scaling showed that macrozoobenthic assemblages exhibited remarkable difference among the three groups. Canonical correspondence analysis demonstrated that macrozoobenthic community structure was highly correlated with habitat-specific differences in water depth, total nitrogen, total phosphorus, ammonium nitrogen, macrophytes, dissolved organic carbon and Φ50. From the east and southwest to the north area of Lake Taihu, the diversity indexes of macrozoobenthos decreased but the density and biomass increased with the increase of trophic status index. Our results showed that the trophic level, bottom sediment type and macrophytes coverage were the key factors regulating community structure and diversity of macrozoobenthos.
Lake Taihu; macrozoobenthos; community structure; bioassessment; biodiversity
*中国科学院南京地理与湖泊研究所“一三五”战略发展规划项目(NIGLAS2012135002)、国家自然科学基金重点项目(41230744,31300396)和江苏省自然科学基金项目(BK20131055)联合资助.2014-11-28收稿;2015-01-27收修改稿.许浩(1986~),男,硕士研究生;E-mail:si2178281828@126.com.
J.LakeSci.(湖泊科学), 2015, 27(5): 840-852
DOI 10.18307/2015.0510
©2015 byJournalofLakeSciences
**通信作者; E-mail: zjgong@niglas.ac.cn.

