外源ABA对水稻种子萌发及相关miRNA表达的影响
张 凯,雷振山,王亚莉
(信阳农林学院,河南 信阳464000)
种子的萌发是作物生长的关键时期,种子发芽时期和质量好坏直接影响农作物的生长和经济效益。在以往的研究中,如何促进种子的萌发一直是人们关注的主要话题,但是,抑制种子的萌发同样具有实用价值和研究意义。例如,水稻在收获前如遇高温多湿天气,往往发生穗上萌发[1],这不仅造成水稻产量下降,同时还影响种子质量和经济效益,因此,如何防止种子穗上萌发已是杂交水稻生产实际中亟需解决的问题。种子的萌发受许多因素的影响,包括环境因子、激素水平、种子活力等[2],其中,激素对种子萌发的影响一直是研究热点。ABA通常被认为是抑制型植物激素,与植株衰老和器官(叶、蕾、铃)脱落有密切联系[3]。但近年来的一些研究发现,ABA对大豆和水稻等作物子粒的休眠和萌发具有调控作用[4-5],GA可以促进基因表达,增加植物种子水解酶的合成而促进种子萌发。已有研究表明,内源ABA可通过抑制水解酶的含量而诱导种子休眠[6]。miRNA是一类长21~25 bp具有调控功能的非编码小分子RNA。研究表明,OsmiR156能够负调控水稻种子的产量和穗分枝数[7-8]。与其相反,OsmiR397正调控种子的发育,研究显示,过表达OsmiR397能够增大水稻种子的体积,进而提高水稻的产量[9]。在拟南芥中,ABA通过诱导与拟南芥种子发育相关miR159的表达,抑制miR159两个靶基因的表达,进而影响拟南芥种子的萌发[10]。同样作为模式植物的水稻,其种子的发育同样受到miRNA的精细调控[10-12],且已有水稻种子发育相关的miRNA被分离和鉴定;但尚未有关于ABA对种子发育相关的miRNA表达量的影响及其调控种子活力、影响种子萌发的研究报道。为此,本研究分析了外源施加不同质量浓度ABA对于水稻种子萌发、内源ABA含量和内源GA含量和与种子发育相关的OsmiR156和OsmiR397表达量的影响,旨在进一步揭示ABA对水稻种子萌发的生理和分子效应,为深入认识种子萌发的分子调控机制提供新的思路。
1 材料与方法
1.1 材料
收集河南省2014年大田种植的由信阳市农科所通过培矮64 S×豫粳3号杂交培育而成的粳稻品种两优信粳1号种子,4℃储藏备用。试剂ABA购至sigma公司。
1.2 试验方法
1.2.1 种子萌发活力测定 选取健康饱满的水稻种子经0.5%NaClO消毒25 min后,反复冲洗干净。用不同质量浓度 (0,10,20,40,80 mg·L-1)ABA浸种24 h,浸后的种子用清水冲洗干净,然后于30℃恒温箱内培养6 d。第2天开始发芽计数,计数时把发芽合格的种子从发芽床中拣出,记录每天拣出种子数,即为新发芽种子数,直至6 d。分别在第3天的统计种子的发芽势,在第6天用游标卡尺分别测量根和地上部分的长度,统计发芽率、发芽指数和活力指数[13]。种子以100粒为1重复,试验重复4次。
1.2.2 通过采用高效液相色谱法测定种子内源ABA和GA质量浓度 样品提取:称取1.0 g左右经ABA浸种24 h后水稻种子,液氮研磨,加入含有5 mL铜试剂(30 mg·L-1)的冷乙腈,在4℃冰箱中提取 12 h,5 000 r·min-1离心 15 min,取上清液。再重复提取2次,最后合并上清液。在37~40℃条件下进行旋转蒸发直干,用2 mL三氯甲烷和0.4 mol·L-1磷酸缓冲液 2 mL,以去除色素,重复3次,合并溶液,取上清液,加入150 mg聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)除去酯类,10 000 r·min-1离心 15 min,然后在 37 ~40 ℃ 条件下进行旋转蒸发直干,用1 mL流动相[V(甲醇)∶V(乙腈)∶V(0.6%乙酸)=50∶45∶5]溶解,用孔径为0.45 μm的有机滤膜过滤,上机分析。所用分析柱为 Symmetry C18(150 mm ×4.6 mm,5 μm),柱温为25 ℃,流动相流速0.4 mL·min-1,检测波长为254 nm。
1.2.3 种子miRNA含量提取及表达量检测 总RNA提取:称取1.0 g左右经不同质量浓度ABA浸种24 h后水稻种子,液氮研磨,装入1.5 mL EP管中;然后参照TAKARA公司RNA提取试剂盒(RNAiso Plus)说明提取水稻种子总RNA。
cDNA的合成:取1μg总 RNA,按照 TaKARA公司One Step PrimeScript MiRNA cDNA Synthesis Kit说明进行cDNA第1条链的合成。cDNA合成后先通过普通PCR进行检验逆转录是否成功,然后把剩余cDNA存放于-80℃备用。
半定量RT-PCR验证OsmiR156和OsmiR397的表达量变化:为了准确检测 OsmiR156和OsmiR397的表达量,以水稻U6做为内参照基因,对不同的模板样品进行均一化处理。然后对各样品中OsmiR156和OsmiR397进行RT-PCR检测。引物 采 用 前 人 研 究 报 道 的 OsmiR156[8]和OsmiR397[9]正向引物,引物序列如下:U6正向引物:5'-CGATAAAATTGGAACGATACAGA-3';反向引物:5'-ATTTGGACCATTTCTCGATTTGT-3';OsmiR397正向引物:5'-GTTCATCAACGCTGCACTCAA-3',OsmiR156 正向引物:GTGCTCACTCTCTTCTGTCA,反向引物由试剂盒提供。反应程序如下:94℃ 预变性1 min,94℃ 变性30 s,55℃退火30 s,7 2 ℃ 延伸 30 s,72 ℃ 延伸 10 min。取 1 μL转录产物用1%胶检测。
2 结果与分析
2.1 外源ABA对水稻种子发芽指标的影响
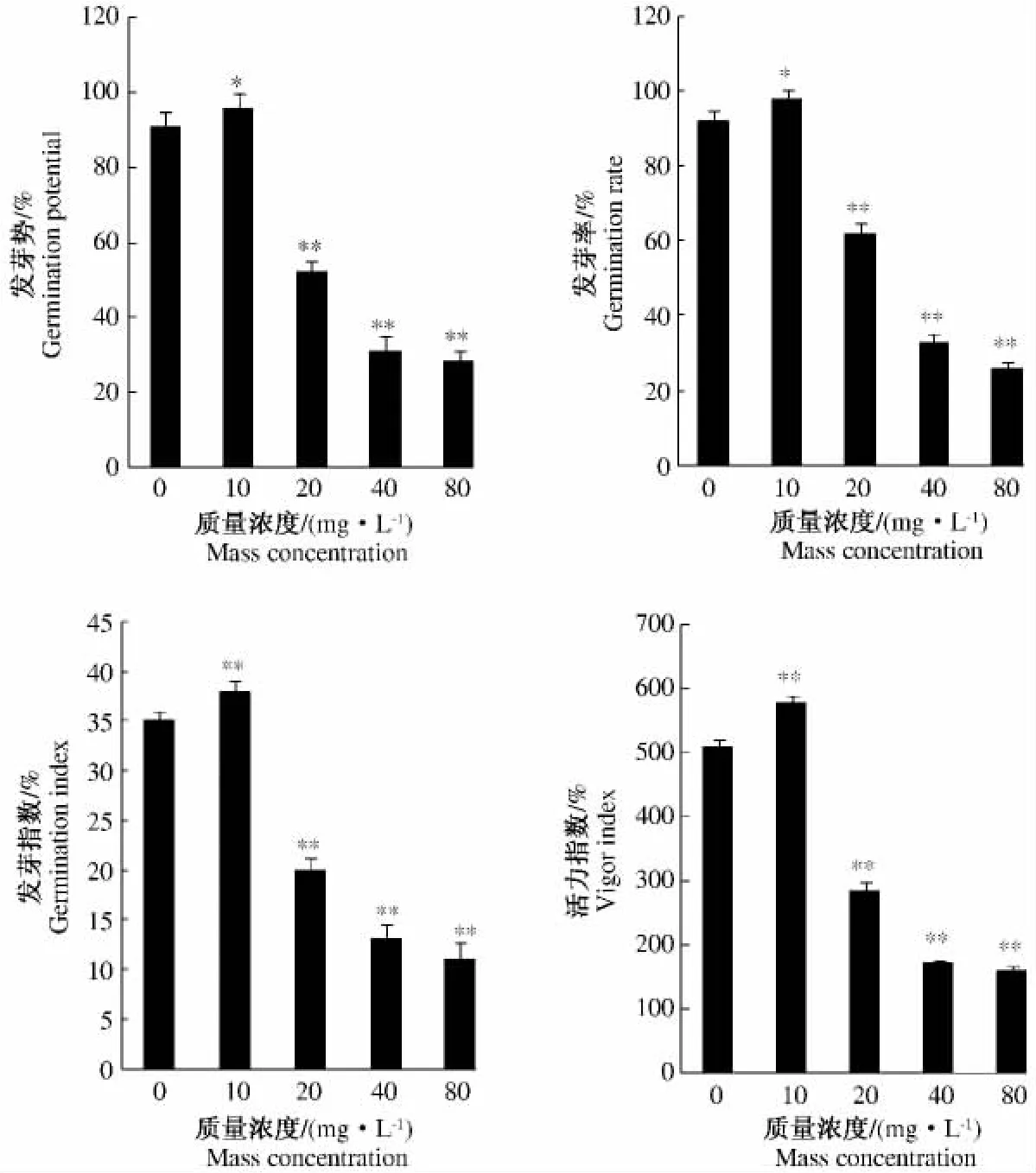
图1 不同质量浓度ABA处理对水稻种子萌发的影响Fig.1 Effects of treatment with different concentrations of ABA on the vigor of rice seeds
经外源ABA浸泡处理后,水稻种子的发芽势发芽率、发芽指数和活力指数有明显影响(图1)。质量浓度10 mg·L-1的ABA处理种子的发芽势比对照显著提高了6.2%;发芽率、相对发芽率分别比对照提高了5.8%和6.5%,而且种子的活力指数也提高7.1%,与对照差异达到显著水平。然而随着ABA质量浓度的提高,水稻种子的发芽势、发芽率、发芽指数和活力指数明显下降,并且与CK差异达极显著水平。同时各处理间处理质量浓度越高,发芽势越低,抑制萌发效果越好。尤其当ABA质量浓度达到40 mg·L-1与低于该质量浓度的各处理(包括 CK)差异达极显著水平,而与80 mg·L-1处理差异不显著,发芽率和种子活力分别降低到78.5%和67.7%,结果表明,不同质量浓度ABA处理对水稻种子萌发的影响表现为低质量浓度促进发芽,高质量浓度抑制发芽。
2.2 外源ABA对水稻种子内源ABA和GA质量浓度的影响
水稻种子经不同质量浓度外源ABA浸泡处理后,内源ABA和GA含量出现明显变化。表现为低质量浓度处理使种子内源ABA降低,高质量浓度处理使种子内源ABA含量升高,而GA表现为相反的趋势。结果如图2所示,外源ABA质量浓度低于20 mg·L-1时,内源ABA含量与CK相比显著降低,并随质量浓度提高而降低;但当外源ABA质量浓度高于20 mg·L-1时,内源ABA含量与对CK比显著增加。增加幅度最大为40 mg·L-1,比CK增加1.78倍,并且与CK差异达极显著水平。当外源ABA质量浓度进一步提高达到80 mg·L-1时,内源 ABA的增加趋势则不明显。对于内源GA来说,各处理的GA含量均显著降低。与CK相比,质量浓度10 mg·L-1降低幅度最小,质量浓度80 mg·L-1降低幅度最大。进一步分析内源ABA与GA含量的比值发现,经过不同质量浓度的ABA处理以后,各处理水稻种子内源ABA/GA的值均高于CK。而且随着外源ABA质量浓度的提高,这个比值逐渐提高。与CK相比,质量浓度10 mg·L-1增加幅度较小,为2.43倍,而质量浓度80 mg·L-1增幅达到CK的21.84倍(图3)。
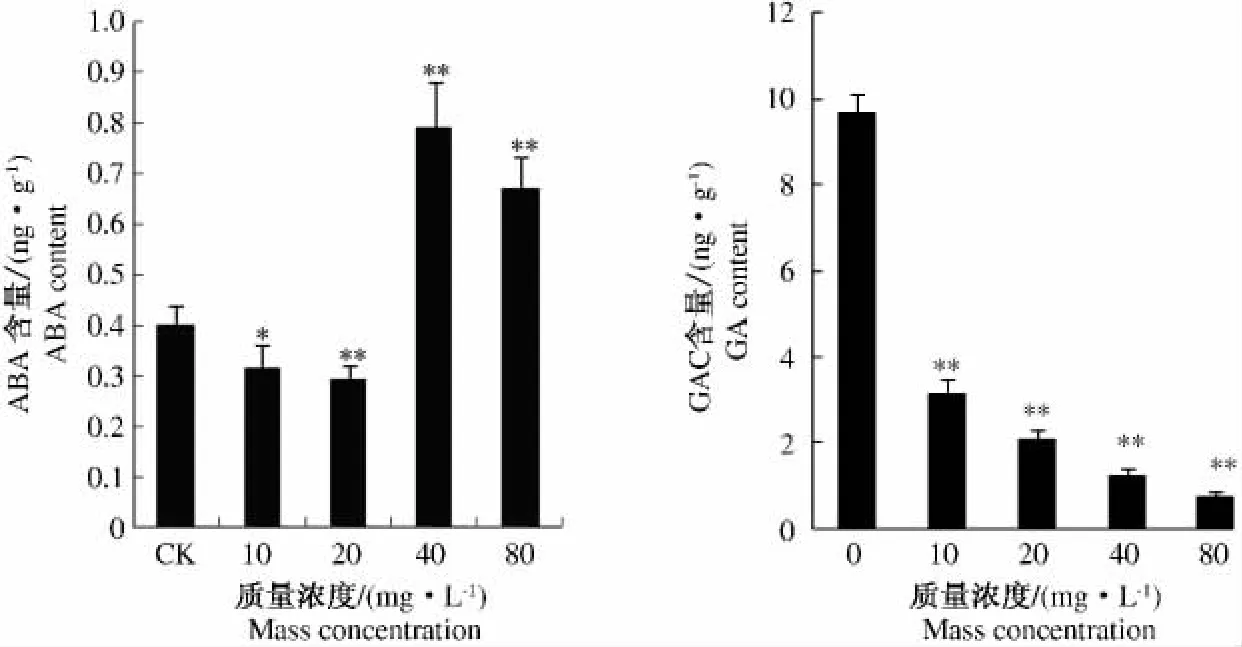
图2 不同质量浓度ABA处理对水稻种子ABA和GA含量的影响Fig.2 Effects of treatment with different concentrations of ABA on the levels of GA and ABA in rice seeds
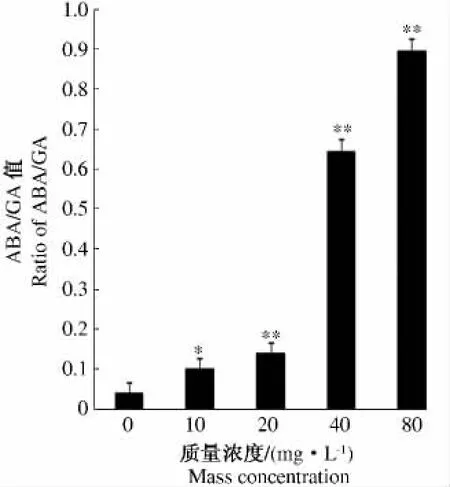
图3 不同质量浓度外源ABA处理后水稻种子内源ABA/GA值Fig.3 Effects of treatment with different concentrations of ABA on the levels of ABA/GA in rice seeds
2.3 不同质量浓度外源ABA处理对水稻种子中OSmiR156和OSmiR397表达量的影响
RT-PCR如图4结果所示,水稻种子经10 mg·L-1的ABA浸泡处理后,促进种子发育的OSmiR397的表达量明显较对照升高,表明质量浓度10 mg·L-1ABA浸泡提高了水稻种子的活力,增强种子萌发的潜力。这与质量浓度10 mg·L-1ABA处理促进种子萌发的结果相印证,并为其提供了分子水平的证据。但当外源ABA质量浓度高于40 mg·L-1时,OSmiR397的表达量较对照相比下降了,而且随着 ABA质量浓度的升高,OSmiR397的表达量随之下降,尤其当质量浓度达到80 mg·L-1时,OSmiR397的表达量几乎检测不到。另一方面,ABA对于OSmiR156的表达有明显抑制作用,且随着外源ABA质量浓度的提高,抑制作用越明显。这表明ABA对于调控OSmiR156和OSmiR397表达呈现不同的机制。
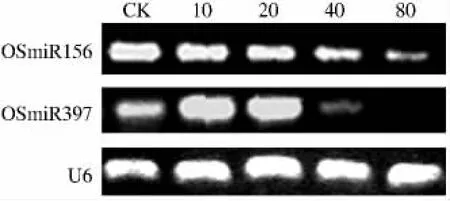
图4 RT-PCR分析不同质量浓度ABA处理对水稻种子OSmiR156和OSmiR397表达量的影响Fig.4 RT-PCR analysis the effects of treatment with different concentrations of ABA on the expression levels OSmiR156 and OSmiR397 on t in rice seeds
3 讨论
除了环境因子对种子的萌发就有显著影响外,植物激素对种子萌发的影响也十分剧烈[2,10]。作为一种重要的植物激素,ABA对调节水稻种子的萌发起着重要的作用。已有的研究表明,GA则可诱导产生或激活α-淀粉酶等水解酶而促进种子的萌发,ABA可以调节或抑制一些水解酶的活性而有利于淀粉和蛋白质的合成和积累而不利于种子的萌发[14,15]。黄宇等[16]认为,一定质量浓度的ABA对于水稻种子的萌发和幼苗生长有显著的促进作用。徐福乐等认为,一定质量浓度ABA浸种能够延缓或抑制作物种子的萌发进程,但不影响作物种子的最终萌发率,而低质量浓度ABA可以促进种子萌发,促进幼苗根的伸长,增加根鲜质量和根叶比[17]。
本研究结果显示,经外源ABA处理后,在小于等于10 mg·L-1的低质量浓度下ABA促进种子的萌发,这与前人的研究结果相一致。而大于或等于20 mg·L-1质量浓度下,种子的萌发率明显降低。并且一定范围内质量浓度越大,降低越明显。而且分析与种子萌发密切相关的内源激素ABA和GA发现,外源ABA处理对于种子内源激素影响也很明显,尤其会导致ABA/GA的比值升高,一定范围质量浓度越高,升高幅度越明显。而已有的研究证明ABA/GA 比值高则不利于种子萌发[15-17],进一步检测与种子发育相关的miRNA表达量的变化发现,低于等于20 mg·L-1质量浓度外源ABA处理能够提高与种子发育正相关OSmiR397的表达,预示着种子活力的提高,反之,高于20 mg·L-1质量浓度能够抑制其表达,表明种子活力降低。这也与萌发试验的结果相一致。而OSmiR156的表达在ABA处理后一直呈下降趋势。表明与OSmiR397响应ABA调控的模式不完全一致,ABA负调控OSmiR156的表达。这种负调控模式与拟南芥中ABA诱导miR159的表达模式相反[8]。
综上所述,外源ABA喷施在水稻的生产上具有广阔的应用前景。外源施加低质量浓度的ABA能够很好促进种子的萌发,提高成苗率;外源施加高质量浓度的ABA能够显著降低种子的萌发,这可能很好地解决水稻穗上萌发等问题。所以,进一步地做好ABA试验、推广、应用工作对于提高水稻的产量和品质具有重要的意义。
[1] 王晓峰.种子的胚胎萌发[J].植物生理学通讯 ,1999,35(2):89-95.
[2] FINCH-SAVAGE W E,LEUBNER-METZGER G.Seed dormancy and the control of germination[J].New Phytologist,2006,171(3):501 -523.
[3] DAVIES,PETER J.Plant hormones:physiology,biochemistry and molecular biology[M].Netherlands:Kluwer Academic Publishers,1995:1 -35.
[4] LIU X,HERBERT SJ,BAATH K,et al.Soybean(Glycine max)seed growth characteristics in response to light enrichment and shading[J].Plant soil environment,2006,52(4):178 -185.
[5] 周述波,贺立红,林 伟,等.外源GA3,ABA对杂交水稻亲本穗上发芽的生理影响[J].湖北农业科学,2011,50(21):4330-4333.
[6] 黄益洪,汤日圣,叶晓青,等.脱落酸(ABA)对白粒小麦种子萌发及幼苗生长的影响[J].麦类作物学报,2009,29(3):503 -507.
[7] KOTARO M, MAYUKOI, ATSUSHIM.etal.OsSPL14 promotes panicle branching and higher grain productivity in rice[J].National Genetics,2010,42(6):545-549.
[8] JIAO Y,WANG Y H,XUE D W,et al.Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J].National Genetics,2010,42(6):541-544.
[9] ZHANG Y C,YU Y,WANG C Y,et al.Overexpression of microRNA OsmiR397 improves rice yield by increasing grain size and promoting panicle branching[J].National Genetics,2013,31(9):848 -852.
[10] REYES J L,CHUA N H.ABA induction of miR159 control transcript levels of two MYB factors during Arabidopsis seed germination[J].Plant Journal,2007,49(4):592-606.
[11] LIU P P,MONTGOMERY T A,FAHIGREN N,et al.Repression of auxin response factor 10 by microRNA 160 is critical for seed germination and post-germination stages[J].Plant Journal,2007,52(1):133 - 146.
[12] NONOGAKI H.Repression of transcription factors by microRNA during seed germination and postgermination:another level of molecular repression in seeds[J].Plant Signal& Behavior,2008,3(1):65 -67.
[13]孙 锋.木霉发酵产物对抗虫棉种子萌发及苗期生长的影响[J].作物杂志,2009(2):33-35.
[14]杨卫兵,王振林,尹燕枰,等.外源ABA和GA对小麦子粒内源激素含量及其灌浆进程的影响[J].中国农业科学,2011,44(13):2673 -2682.
[15]杨东清,李玉玲,倪英丽,等.外源ABA和6-BA对不同持绿型小麦子粒灌浆进程及蛋白质含量影响[J].作物学报,2014,40(2):301-312.
[16]黄 宇,苏以荣,谢小立,等.ABA对双季早稻参量的影响[J].湖南农业科学,2001(1):23-24.
[17]徐福乐,罗立津.ABA对作物种子萌发和幼苗生长的影响[J].福建农业科技,2007(6):69-71.

