城市缓流水体生物膜群落与环境因子响应关系*
金梦婷,朱 亮1,,3,朱 彧,潘兴华,5
(1:河海大学浅水湖泊综合治理与资源开发教育部重点实验室,南京 210098) (2:河海大学环境学院,南京 210098) (3:河海大学水利工程科学与水文水资源国家重点实验室,南京 210098) (4:河海大学港口海岸与近海工程学院,南京 210098) (5:南京大学盐城环保技术与工程研究院,盐城 224000)
城市缓流水体生物膜群落与环境因子响应关系*
金梦婷2,朱 亮1,2,3**,朱 彧4,潘兴华2,5
(1:河海大学浅水湖泊综合治理与资源开发教育部重点实验室,南京 210098) (2:河海大学环境学院,南京 210098) (3:河海大学水利工程科学与水文水资源国家重点实验室,南京 210098) (4:河海大学港口海岸与近海工程学院,南京 210098) (5:南京大学盐城环保技术与工程研究院,盐城 224000)
以南京市秦淮河、石头城护城河、乌龙潭、玄武湖4个水体为研究对象,采用磷脂脂肪酸(PLFA)法对城市缓流水体生物膜群落特征进行分组研究.通过SPSS、CANOCO软件分析水体生物膜群落与环境因子的响应关系,结果表明:(1) 温度及水体营养盐含量的降低会导致水体微生物新陈代谢缓慢,微生物大量死亡.静态水体生物膜中微生物量的变化范围是9.16×106~2.74×108cells/g,流动水体生物膜中为1.69×107~7.77×107cells/g,静态水体中生物量的下降趋势比流动水体中显著,可能是由于水体的流动加强了营养盐在固液相之间的质量传递,削弱了水体温度及营养盐含量变化对流动水体生物膜中微生物生长的影响程度.(2) 功能菌群G-、G+、真菌是微生物菌群的主要成分,3者比重为:G->真菌>G+.随温度的降低(T≥8.4℃),静态水体中主要功能菌群总含量变化波动较大,其波动范围为27.41%~66.20%,流动水体中主要功能菌群总含量的变化范围较小,为43.09%~68.25%,差异的主要贡献者是G-和真菌.(3) 静态水体中环境因子温度、硝态氮、COD是功能菌群的主要影响因子,氮元素是流动水体中功能菌群的显著影响因子.
生物膜;环境因子;微生物量;功能菌群
自然水体生物膜主要指水体中大量微生物以附着形式存在于表层沉积物、岩石表面以及岸带,并以水体中的营养物质为养分不断地生长繁殖,通过微生物胞外聚合物对细胞的粘附、凝聚形成的,具有一定结构的微生物膜[1-2].自然水体中,生物膜微生物对水体物质循环及能量流动起着极其重要的作用,同时生物膜特征的变化也受水体环境因子、营养元素的影响[3-4].目前,有关水流条件对生物膜中微生物群落结构的研究主要集中在特定微生境下,如Beyenal等[5]通过考察流速对生物膜的影响,指出在低流速环境条件下生长的生物膜密度低,扩散性好,但不能抵抗高的水力剪切力;在高流速环境条件下生长的生物膜密度高,能抵抗高的水力剪切力,但扩散性差.生物反应器中生物膜结构研究发现[6],反应器的结构、水力剪切力、HRT、扰动程度、相界面湍动均会对生物膜结构产生影响.楼菊青[7]在研究移动床生物膜反应器水力特性的实验发现过快的水流循环速度会造成挂膜困难甚至会导致生物膜大量脱落,从而降低反应器效率.Celmer等[8]发现增大搅拌强度能够提高反硝化细菌的活性,使反硝化速率增大,随着生物膜反应器运行时间变化,反应器内微生物的丰度和种群变化也发生改变.田鑫等[9]讨论了不同水力及营养条件对沼泽红假单胞菌生物膜表面覆盖率、膜厚、干重和密度的影响,结果表明不同水力及营养条件对生物膜生长速率及结构具有重要影响.而对河流水体自然生物膜中微生物群落结构影响方面的研究甚少,因此,研究改善和提高水体生物膜适宜的水流条件不仅是当前河流治理和保护的迫切需要,而且也是值得深入研究和探讨的重要科学问题.
近年来磷脂脂肪酸(phospholipid fatty acid,PLFA)谱图分析法[10-14]、Biolog法[15]、PCR-变性梯度凝胶电泳(DGGE)以及荧光原位杂交技术(FISH)等生物化学和分子生物学方法[16-17]对微生物群落结构分析起了积极的推动作用.其中,PLFA技术在对技术和仪器条件要求相对较低的情况下可以确定生态环境中微生物的生物量分布,更重要的是,从磷脂类化合物的组成成分中还可以得到较完整的“存活”微生物群落在数量和结构方面的重要信息,如真菌、革兰氏阳性菌(G+)及革兰氏阴性菌(G-)等微生物群落.自White等[18]最先将PLFA技术应用于研究河口沉积物中微生物生物量的变化以来,PLFA技术已广泛应用于堆肥样品、海洋沉积物和土壤微生物群落研究[10-14],但目前应用于水体生物膜微生物群落结构分析还鲜见报道.本文以南京市的静态、流动水体(包括乌龙潭、石头城护城河、玄武湖、秦淮河)为研究对象,采用PLFA法检测、分析不同时段两组水体生物膜微生物群落特征,探讨不同水体水质、温度与微生物群落结构特征之间的响应关系,以及水流状态对不同水体生物膜群落特征引起的差异,为水体生态修复提供依据.
1 材料与方法
1.1 采样点设置

图1 采样点位图Fig.1 Satellite map of sampling sites
水样采集遵循《水和废水监测分析方法》(第四版)中地表水的采集要求,采用有机玻璃水质采样器采集各断面水样,并现场加酸固定使pH<2,装入塑料瓶内运回并贮存于冰箱内4℃备用.水体生物膜采用原位采集的方法[19],用不锈钢利器将附着在河道岩壁上的生物膜刮入盛有微量矿物盐溶液的塑料瓶内,低温保存并转移至实验室.并在现场对水体温度(T)及溶解氧含量(DO)进行测定,溶解氧测定采用便携式溶解氧测定仪,仪器型号为LDOTMHQ10.
1.2 实验方法

PLFA提取:将生物膜和沉积物样品置于锥形瓶中,依次加入磷酸盐缓冲溶液7.2ml、氯仿8ml、甲醇16ml,振荡器振摇60min,静置12h;再加入磷酸盐缓冲溶液7.2ml、氯仿8ml,振摇30min,静置过夜;离心3min(2500转/min)分离水相、氯仿相及固体相,移出氯仿相,并用氮气将其吹干;氯仿相过硅胶(6ml,500mg)层析柱,依次用氯仿、丙酮、甲醇洗涤层析柱,收集甲醇洗涤液,用氮气吹干;用1ml体积比为1∶1的甲醇和甲苯混合溶液与1ml 0.2mol/L的KOH甲醇溶液溶解样品,并在30~35℃的水浴中保温15min,冷却至室温,再加2ml体积比为4∶1的正己烷、氯仿混合溶液,用乙酸将溶液定容调至中性,加2ml纯水,振摇1min,去水相,取底部正己烷相进行气相色谱(GC)测试.
GC条件:处理后的样品采用MIDI方法测定PLFA,用PLFA菌种鉴定系统测定提取的FAME.色谱条件:进样口250℃,检测器300℃,载气(氢气)流速30ml/min.升温程序:初始温度170℃,以5℃/min速度升温至260℃,维持18min,再以40℃/min的速度升温至310℃,保持1.5min,以C19作为内标[23].
2 结果与讨论
2.1 上覆水温度及营养盐分布
2012年9、10、11、12月分别对7个断面进行监测,得到上覆水水温、溶解氧及营养盐分布情况,详见表1和表2.根据水体流速的差异,将研究断面分为静态水体和流动水体,其中W1#、W2#、H#、X3#为静态水体断面,X1#、X2#、Q#为流动水体断面.

表1 静态水体不同月份上覆水环境因子变化

表2 流动水体不同月份上覆水环境因子变化
2.2 生物膜群落结构
3.3 肘关节的应用 肱骨外上髁炎是由于长期劳累、外伤、撕裂伤或前臂伸肌总腱部分撕伤,引起局部损伤性炎症肿胀,刺激或挤压神经感受器而引起疼痛[28]。González-Iglesias等[29]对肱骨外上髁炎的攀登者进行MWM治疗,有良好的治疗效果。另研究表明对肱骨外上髁患者来说MWM介入后受试者的无痛苦握力和最大握力均显著增加[30]。
2.2.1 生物膜微生物量分布及脂肪酸组成分析 采用Sherlock MIS系统得出PLFA的响应量,通过系统对内标十九烷酸甲酯的响应量及摩尔浓度计算出各点PLFA的摩尔浓度.PLFA与生物量之间的转换系数一般为2×104~6×104cells/pmol PLFA[18],本文取4×104cells/pmol,计算得到各监测点生物膜微生物总量及其变化趋势见表3.

表3 不同水体生物膜中微生物量的变化(cells/g)
静态水体生物膜样品中微生物量的变化范围为9.16×106~2.74×108cells/g,流动水体生物膜样品中为1.69×107~7.77×107cells/g.静态水体生物膜微生物量各月份间变化较大,且各监测点微生物量随着时间的变化基本呈逐渐降低的趋势;流动水体生物膜微生物量随月份的变化规律不明显,X1#与X2#点的微生物量差异不大,Q#点的微生物量在10、12月有所突变;分析其与静态水体差异的原因,可能是流动水体中水流剪切力的增加,加强了生物膜传质能力,使得生物膜微生物量保持在107的数量级.
通过对生物膜中微生物的脂肪酸检测得到:4个水体中测得的PLFA共有91种,其中静态水体中检测到16种特异性的PLFA,分别是:11∶00、11∶0 anteiso、11∶0 iso 3OH、11∶0 2OH、12∶0 iso、13∶0 anteiso、14∶0 anteiso、15∶0 3OH、14∶0 3OH/16∶1 iso I、15∶1 anteiso A、16∶1 iso G、17∶1 w7c、17∶0 iso 3OH、17∶0 2OH、18∶1 w5c、20∶00,表征的主要微生物有G-和脱硫叶菌等;流动水体中检测到9种特异性的脂肪酸,分别是:10∶0 iso、9∶0 3OH、14∶1 w5c、15∶0 2OH、16∶0 3OH、18∶1 iso H、19∶0 cyclo w10c/19w6、20∶0 iso、20∶2 w6,9c,表征的主要微生物有黄杆菌,G-和原生动物等.
2.2.2 生物膜功能菌群含量分布 PLFA分子的首官能团和侧链中通常隐含着样品中微生物的类型信息.因此,PLFA技术在微生物群落组成的确定方面有很大的实用价值.不同菌种的PLFA特征谱图不同[25],在高度专一性基础上具有多样性,可以作为微生物群落的标记物[24,26-27].
微生物群落的研究中,PLFA一般能定性地粗略区分G+、G-、原生动物、放线菌及真菌等,见表4.

表4 指示各种微生物类型的PLFA标记物[28-32]
本文分别统计了3类可以指示功能菌群的PLFA丰度分布:G-、G+和真菌,G-包含的PLFA种类有16∶1 w9c、16∶1 w7c、16∶1 w5c、18∶1 w5c、18∶1 w7c、17∶0 cyclo、19∶0 cyclo w8c、19∶0 cyclo w10c/19w6;G+包含的PLFA种类有15∶0 iso、15∶0 anteiso、16∶0 iso、16∶0 10-methyl、15∶0 iso 3OH、17∶0 iso、17∶0 anteiso;真菌包含的PLFA种类有18∶3 w6c(6,9,12)、18∶2 w6,9c、18∶1 w9c.功能菌群丰度统计见图2,各采样点的G-含量相对比较多,真菌次之,G+最少.静态水体与流动水体中各菌群含量呈现不一样的规律.

图2 静态水体和流动水体功能菌群相对含量Fig.2 Content of functional bacteria in static water and running water
静态水体中G-的含量为11.11%~46.14%,其中16∶1w7c、16∶1w5c、18∶1w7c所指示的微生物是G-的主要成分并存在于每个样品中.在9、10、11月3个调查时段内,真菌的含量均少于G-,真菌含量变化范围在10.12%~26.80%之间;12月份的调查样品中真菌的含量高于G-,真菌的变化范围为20.92%~30.66%;3种脂肪酸中18∶2w6,9c、18∶1w9c是其含量的主要贡献者.G+在3组成分中含量最少,含量为0.88%~10.38%;在统计的几种脂肪酸中15∶0iso和16∶0iso是其主要成分.4个调查时段中W1#、W2#生物膜中主要功能菌群的含量呈现锯齿形的变化规律,呈现这种变化主要是由于G-和真菌含量发生大的变化,而H#、X3#呈现逐渐增加的变化规律,H#的变化主要是由G-和真菌引起的,X3#的变化则主要由G-的含量大幅度增加造成的.4组水体中主要功能菌群含量的变化范围为27.41%~66.20%.
流动水体中G-的含量变化不明显,且各监测点之间的含量差异也不大,含量变化范围为24.63%~44.54%,其中16∶1w9c、16∶1w7c、16∶1w5c、18∶1w7c为G-含量的主要贡献者,存在于每一个检测样品中,且16∶1w7c的含量居多,达到10.14%~26.19%.各调查时段内,真菌含量基本均小于G-,含量范围为8.44%~36.71%,随着时间的变化,真菌的含量变化规律不明显.G+含量在3类主要菌群中最少,含量变化为1.63%~9.70%,贡献率较大的脂肪酸为15∶0iso,随着季节的变化,G+的含量有所降低.4个调查时段内,流动水体的主要功能菌群量变化波动不大,变化范围为43.09%~68.25%.
2.3 生物膜群落结构与环境因子的响应关系

*表示在0.05水平(双侧)上显著相关,**表示在0.01水平(双侧)上显著相关.
2.3.2 生物膜功能菌群与环境因子的响应关系 将水环境营养要素作为环境变量、PLFA种类数据代表微生物群落主要功能菌群组成信息,利用CANOCO for windows 4.5对静态水体、流动水体采样断面环境营养要素与微生物主要功能菌群进行冗余分析,分析结果见图3.图中,箭头分别表示各指标沿程增加的方向,PLFA指标标线与环境因子标线之间夹角的余弦值为两者间的相关性大小,投影方向与环境因子标线方向一致表示呈正相关,方向相反则为负相关,物种箭头长度表示的是在排序空间内的物种变化量的比例,环境因子箭头标线的长短表示其对于PLFA群落结构影响程度的大小.

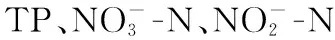
3 结论
1) 在调查月份中,水体温度逐月降低,使得水体微生物新陈代谢缓慢,生长、繁殖能力下降,由于上覆水营养盐浓度降低,微生物可吸收利用的物质减少,大量微生物死亡,致使静态水体中生物膜微生物量不断减少,微生物数量级从108降低到106.流动水体微生物量与水体温度、上覆水营养盐没有显著的响应关系,而水流剪切力的增加,加强了生物膜传质能力,使得流动水体生物膜微生物量保持在107的数量级.
2) 在调查水体中,功能菌群(G-、G+、真菌)含量可达到微生物总量的27.41%以上,其中G-比重相对较大,真菌次之,革兰氏阳性菌(G+)最小.随着温度的降低,静态水体中功能菌群的总含量波动较大,其波动范围为27.41%~66.20%,而流动水体中功能菌群的总含量波动较小,在43.09%~68.25%之间,差异的主要贡献者为G-和真菌.G-中脂肪酸16∶1 w7c/161 w6c、16∶1 w5c的含量较多,G+中脂肪酸15∶0iso是其主要成分,而18∶2 w6,9c/18∶0 ante、18∶1 w9c是真菌含量的主要贡献者.
[1] 付长营,方 涛,邓南圣.天然水体中生物膜对水环境中磷的生物地球化学过程影响.地球科学与环境学报,2006,28(3):97-101.
[2] 黄敏婷,陆 春.生物膜胞外聚合物的检测技术与功能的研究进展.微生物学杂志,2010,30(6):82-85.
[3] Hoellein TJ, Arango CP, Yana Z. Spatial variability in nutrient concentration and biofilm nutrient limitation in an urban watershed.Biogeochemistry, 2011,106(2):265-280.
[4] 李 鱼,董德明,刘 亮等.自然水体生物膜及其在水环境中的作用.环境科学动态,2004,(4):16-19.
[5] Beyenal H, Lewandowski Z. Internal and external mass transfer in biofilms grown at various flow velocities.BiotechnologyProgress, 2008,18(1):55-61.
[6] Mudliar S, Banerjee S, Vaidya A. Steady state model for evaluation of external and internal mass transfer effects in an immobilized biofilm.BioresourceTechnology, 2008,99(9):3468-3474.
[7] 楼菊青.新型移动床生物膜反应器水力特性的研究.环境科学与技术,2007,30(9):31-35.
[8] Celmer D, Oleszkiewicz JA, Cicek N. Impact of shear force on the biofilm structure and performance of a membrane biofilm reactor for tertiary hydrogen-driven denitrification of municipal wastewater.WaterResearch, 2008,42:3057-3065.
[9] 田 鑫,廖 强,党 楠等.营养及水力条件影响光合细菌生物膜生长特性实验.中国生物工程杂志,2009,29(4):67-72.
[10] Medeiros PM. Fernandes MF, Dick RPetal. Seasonal variations in sugar contents and microbial community in a ryegrass soil.Chemosphere, 2006,65(5):832-839.
[11] Hackl E,Pfeffer M, Donat Cetal. Cpmposition of the microbial communities in the mineral soil under different types of nature forest.SoilBiologyandBiochemistry, 2005,37(4):661-671.
[12] PuglisI E,Nicelli M, Capri Eetal. A soil slteration index based on phospholipid fatty acid.Chemosphere, 2005,6(11):1548-1557.
[13] Crdovakrelyos AL, Cao Y,Green PGetal. Diversity, composition, and geographical distribution of microbial communities in California salt marsh sediments.AppliedandEnvironmentalMicrobiology, 2006,72(5):3357-3366.
[14] Syakti AD,Mazzella N, Nerini Detal. Phospholipid fatty acid of a marine sedimentary microbial community in a laboratory microcosm:response to petroleum hydrocarbon contamination.OrganicGeochemistry, 2006,37(11):1617-1628.
[15] Mondini C,Insam H. Community level physiological profiling as a tool to evaluate compost maturnity: a kinetic approach.EuropeanJournalofSoilBiology, 2003,39(3):141-148.
[16] Green SJ,Michejr FC,Hadar Yetal. Similarity of bacterial communities in sawdust-and straw-amend cow manure composts.FEMSMicrobiologyLetters, 2004,233(1):115-123.
[17] Cahyani VR, Matsuya K, Asakawa Setal. Succession and phylogenetic profile of eukaryotic communities in the composting process of rice straw estimated by PCR-DGGE analysis.BiologyandFertilityofSoils, 2004,40(5):334-344.
[18] White DC, Davis WM, Nickels JSetal. Determination of the sedimentary microbial biomass by extractible lipid phosphate.Oecologia,1979,40:51-62.
[19] Behra R, Landwehrjohann R, Vogal Letal. Copper and zinc content of periphyton from two rivers as a function of dissolved metal concentration.AquaticSciences,2002,64(3):300-306.
[20] 朱 亮,孙凌宇,储如花等.城市纳污河流沉积物微生物群落结构特征.水科学进展,2013,24(1):132-137.
[21] 陈开林,陈开梅.麝香草酚比色法检测硝酸盐的改进.海峡预防医学杂志,2004,10(3):49-50.
[22] Buyer JS, Sasser M. High throughput phospholipid fatty acid analysis of soils.AppliedSoilEcology, 2012,61:127-130.
[23] Liu Y, Yao H, Huang C. Assessing the effect of air-drying and storage on microbial biomass and community structure in paddy soils.PlantandSoil, 2009,317:213-221.
[24] Tunlid A, Baird BH, Trexler MBetal. Determination of phospholipids ester-linked fatty acid and poly β-hydroxybutyrate for the stimulation of bacterial biomass and activity in the rhizosphere of the rape plantBrassicanapus(L.).Microbiol,1985,31(12):1113-1119.
[25] Marschner P. Soil microbial community structure and function assessed by FAME, PLFA and DGGE-Advantages and limitations.SoilBiology,2007,11:181-200.
[26] Guezennec J, Ortega-Morales O, Raguenes Getal. Bacterial colonization of artificial substrate in the vicinity of deep-sea hydrothermal vents.FEMSMicrobiologyEcology,1998,26:89-99.
[27] Tunlid A, White DC. Biochemical analysis of biomass, community structure, nutritional status, and metabolic activity of microbial communities in soil.SoilBiochemistry,1992,7:229-262.
[28] Leckie SE. Methods of microbial community profiling and their application to forest soils.ForestEcologyandManagement,2005,220:88-106.
[29] Kucera JM, Dick RP. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence.MicrobialEcology,2008,55: 500-511.
[30] Heike Rutter. Phospholipid analysis as a tool to study complex microbial communities in marine sediments.JournalofMicrobiologicalMethods,2002,48:149-160.
[31] Liu Y, Yao H, Huang C. Assessing the effect of air-drying and storage on microbial biomass and community structure in paddy soils.PlantandSoil,2009,317:213-221.
[32] Mentzer JL, Goodman RM, Balser TC. Microbial response over time to hydrologic and fertilization treatments in a simulated wet prairie.PlantandSoil,2006,284:85-100.
[33] 朱 亮,赵林多,刘 钢等.大运河沉积微生物群落结构特征分析.中国矿业大学学报,2010,39(2):295-301.
[34] 吴愉萍.基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[学位论文].杭州:浙江大学,2009.
[35] 王亚芬.应用磷脂脂肪酸技术解析人工湿地微生物群落结构的研究[学位论文].北京:中国科学院研究生院,2007.
Relationship between the biofilm microbial communities and the environmental factors of municipal slow-flow water
JIN Mengting2, ZHU Liang1,2,3, ZHU Yu4& PAN Xinghua2,5
(1:KeyLaboratoryofIntegratedRegulationandResourceDevelopmentonShallowLakes,MinistryofEducation,HohaiUniversity,Nanjing210098,P.R.China)(2:CollegeofEnvironment,HohaiUniversity,Nanjing210098,P.R.China)(3:StateKeyLaboratoryofHydrology-waterResourcesandHydraulicEngineering,HohaiUniversity,Nanjing210098,P.R.China)(4:CollegeofHarbour,CoastalandOffshoreEngineering,HohaiUniversity,Nanjing210098,P.R.China)(5:YanchengInstituteofEnvironmentalTechnologyandEngineering,NanjingUniversity,Yancheng224000,P.R.China)
The objective of this paper was to study the biofilm microbial communities from Qinhuai River, Stone town moat, Lake Wulong and Lake Xuanwu of Nanjing using phospholipid fatty acid (PLFA) method. (1) It was found that the decreasing of temperature and nutrients concentration led to the slowing down of the metabolism rate and even the death of microorganisms. The microbial biomass ranged from 9.16×106to 2.74×108cells/g in static water, while in running water, it ranged from 1.69×107to 7.77×107cells/g. The decline of microbial biomass in static water could be attributed to the higher transfer resistance. (2) G-, G+ and fungi mainly comprised the microbial community in the order: G->fungi>G+. As temperature decreasing (T≥8.4℃), the content of functional bacteria in static water fluctuated from 27.41% to 66.20%, while in running water it fluctuated from 43.09% to 68.25%. The difference might be caused by G- and fungi. (3) In static water, temperature, concentration of nitrate and COD largely influenced the growth of functional bacteria, while in running water the concentration of nitrogen was critical.
Biofilm; environmental factors; microbial biomass; functional bacteria
*国家水体污染控制与治理科技重大专项项目(2009ZX07317-007-04)资助.2014-02-18收稿;2014-04-11收修改稿.金梦婷(1990~),女,硕士研究生;E-mail:jinmtciel@163.com.
**通信作者;E-mail:zhulianghhu@163.com.

