电针合谷穴对实验性牙髓痛大鼠三叉神经节P2X2、P2X3受体的影响
陈莉,张英,严琴,乐凯
(1.湖北中医药大学,武汉 430065;2.江汉大学,武汉 430056)
牙髓痛为口腔疾患中常见的症状之一,可见于西医学的龋齿、牙髓炎、根尖周围炎和牙本质过敏等。中医学称之为“骨槽风”“牙咬痛”“牙宣”。针刺合谷穴对牙髓痛具有良好的镇痛作用[1-3],但其作用机理尚未明确。
三磷酸腺苷(adenosine triphosphate, ATP)不仅是细胞内最重要的能量分子,也是组织细胞间信息传递的信号分子[4]。疼痛、伤害性刺激使损伤细胞和应激细胞释放大量ATP,引起P2X受体兴奋激活,诱发动作电位沿着神经轴突向中枢神经系统传递,产生痛觉[5]。有研究[6-8]表明,ATP及其作用的受体特别是P2X2和P2X3受体参与了伤害性信息的传递。
电针合谷穴治疗牙髓痛的作用与 P2X2、P2X3受体的关系目前还不明确。本实验以大肠杆菌内毒素(LPS)诱导的牙髓痛大鼠为研究对象,采用RT-PCR检测三叉神经节P2X2、P2X3受体mRNA的表达量,以探索电针合谷穴治疗牙髓痛的可能机制,现报告如下。
1 材料与方法
1.1 实验动物
42只健康成年雄性SD大鼠,体重为180~250 g,均牙体、牙列完整,无龋坏、牙齿畸形及牙周病,咬合正常,由武汉大学动物实验中心提供[许可证号SCXK(鄂)2008-0004]。
随机分为正常组(N组)、对照组(C组)、牙髓痛组(M组)、拮抗剂组(A组)、电针组(E组)和拮抗剂+电针组(AE组),每组7只。
1.2 主要药品与仪器
微量移液器(德国Eppendorf公司),Realtime PCR仪(美国ABI公司),冷冻离心机(美国Sigma公司),大肠杆菌内毒素(上海禾丰制药,生产批号120801),A-317491(美国Sigma公司),Trizol(美国Invitrogen公司),氯仿、异丙醇、无水乙醇(沪试公司),PrimeScript RT reagent Kit、SYBR Premix Ex TaqTM Ⅱ(日本TAKARA公司),β-actin引物(上海生工公司),P2X3引物(上海生工公司)。
1.3 动物造模及治疗方法
1.3.1 N组
不做任何处理。
1.3.2 C组
在钻好的牙髓腔内注入与 M组等量的生理盐水,浸润5~6 min后用牙科填料将牙洞封闭。
1.3.3 M组
用小型电钻或手钻(钻头直径约1 mm)在上颌一侧第一和第二磨牙上钻孔,深入牙髓腔并暴露牙髓,用微量注射器注入浓度为 5 μg/μL的LPS溶液(每孔注入约1~3 μL), 浸润5~6 min后用牙科填料将牙洞封闭[9]。
1.3.4 A组
同 M组造模后,在注射器注入 LPS溶液时,将A-317491(0.5 mg/kg)同时注射进牙髓。
1.3.5 E组
取双侧合谷穴[10]。针刺后接电针治疗仪,选连续波,频率为2 Hz,强度为1 mA,留针30 min。每日1次,共治疗3次。
1.3.6 AE组
同M组造模后,采用拮抗剂配合电针治疗。拮抗剂治疗同A租,电针治疗同E组。
1.4 样本采集
大鼠腹腔注射 10%的水合氯醛麻醉后断颈处死,立即取出三叉神经节。
1.5 行为学分析
观察每组大鼠开始治疗第1天至最后1天的体重变化及外观变化。观察每组造模后30 min行为学变化,包括大鼠身体和头部梳理、挖掘和探究、直立动作。
1.6 RT-PCR检测三叉神经节P2X2、P2X3受体mRNA表达
1.6.1 逆转录反应
采用 Trizol RNA提取试剂盒提取三叉神经节总RNA。将 4 μL 5×RT Buffer、2 μL dNTP、1 μL Oliga(dT)18、1 μL RNase Inhibitor、1 μL ReverTra Ace和1 μg RNA加RNase free H2O调至20 μL。42℃ 20 min,将mRNA逆转录为cDNA;95℃ 5 min灭活逆转录酶后-20℃保存。
1.6.2 实时荧光定量检测P2X2、P2X3的mRNA
采用 SYBR Green荧光染料法针对 P2X2、P2X3的 mRNA进行实时 RT-PCR检测,吸取逆转录反应产物10 μL引物上下游各2 μL,加缓冲液10 μL、ddH2O 4 μL以及 SYBR Green荧光染料 1 μL,放入荧光定量PCR仪,50℃持续 2 min,接着 95℃持续 10 min,然后95℃持续15 s;退火1 min后,95℃持续15 s,然后60℃持续15 s,最后95℃持续15 s。如上进行45个循环,经4℃延伸10 min。设置阴性对照和β-actin内参照。对P2X2、P2X3受体CT值进行标准化,得到各组P2X2、P2X3受体mRNA相对表达量。
1.7 统计学方法
所有数据采用SPSS19.0统计软件进行分析,实验结果以均数±标准差表示,多组两两比较用单因素方差(One-Way ANOVA)分析,组间析因分析用LSD检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠行为学及体重变化情况
正常大鼠皮毛光润,行动自如,体重稳定增长。LPS造模后,大鼠皮毛萎缩无光泽,行动迟缓,并有跛足现象出现,体重增加不明显。观察注射后30 min大鼠的行为变化可以发现,造模大鼠身体和头部梳理、挖掘和探究、直立动作次数明显增多,各组大鼠行为学及体重变化情况见表1、2。
由表1、2可见,M组、A组、E组和AE组行为学变化均显著高于C组和N组(P<0.01);A组、E组和AE组行为学变化均显著低于M组(P<0.01)。

表1 各组大鼠行为学变化比较
由表2可见,C组体重显著低于N组(P<0.01);M组、A组、E组和AE组体重均显著低于C组和N组(P<0.01);E组、AE组体重均显著高于 M组和 A组(P<0.01,P<0.05);A组体重稍高于M组(P<0.05);AE组体重显著高于E组(P<0.01)。
表2 各组大鼠体重变化比较 (±s,g)
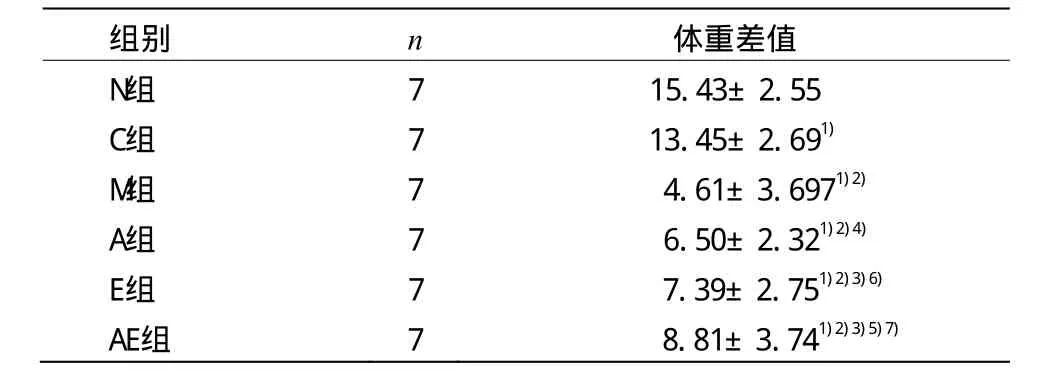
表2 各组大鼠体重变化比较 (±s,g)
注:与N组比较1)P<0.01;与C组比较2)P<0.01;与M组比较3)P<0.01,4)P<0.05;与A组比较5)P<0.01,6)P<0.05,与E组比较7)P<0.01
组别 n 体重差值N组 7 15.43±2.55 C组 7 13.45±2.691)M组 7 4.61±3.6971)2)A组 7 6.50±2.321)2)4)E组 7 7.39±2.751)2)3)6)AE组 7 8.81±3.741)2)3)5)7)
2.2 各组大鼠三叉神经节P2X2、P2X3受体mRNA表达比较
由表3可见,M组、A组和E组P2X3受体mRNA表达量均高于C组(P<0.05),且显著高于N组(P<0.01);A组、E组和AE组P2X3受体mRNA表达量显著低于M组(P<0.01);AE组P2X3受体mRNA表达量明显低于E组(P<0.01);A组 P2X3受体 mRNA表达量低于 E组(P>0.05);AE组P2X3受体mRNA表达量稍高于C组及N组(P>0.05)。
表3 各组大鼠三叉神经节P2X3受体mRNA相对表达量比较(±s)
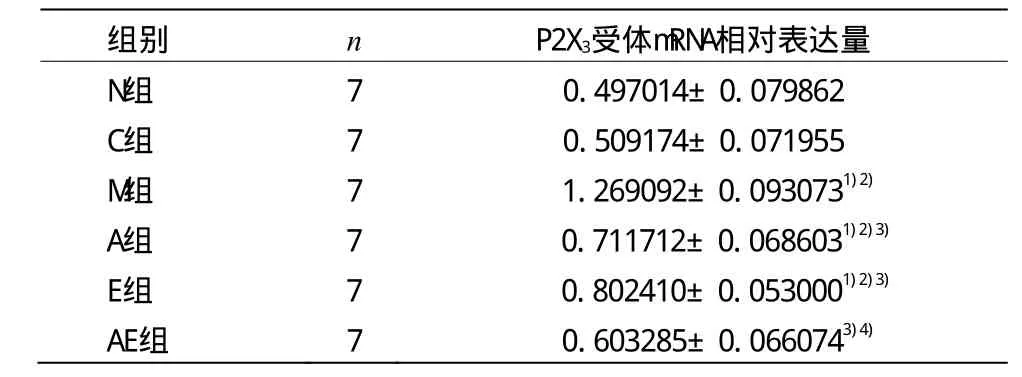
表3 各组大鼠三叉神经节P2X3受体mRNA相对表达量比较(±s)
注:与N组比较1)P<0.01;与C组比较2)P<0.05;与M组比较3)P<0.01;与E组比较4)P<0.01
组别 n P2X3受体mRNA相对表达量N组 7 0.497014±0.079862 C组 7 0.509174±0.071955 M组 7 1.269092±0.0930731)2)A组 7 0.711712±0.0686031)2)3)E组 7 0.802410±0.0530001)2)3)AE组 7 0.603285±0.0660743)4)
表4 各组大鼠三叉神经节P2X2受体mRNA相对表达量比较(±s)
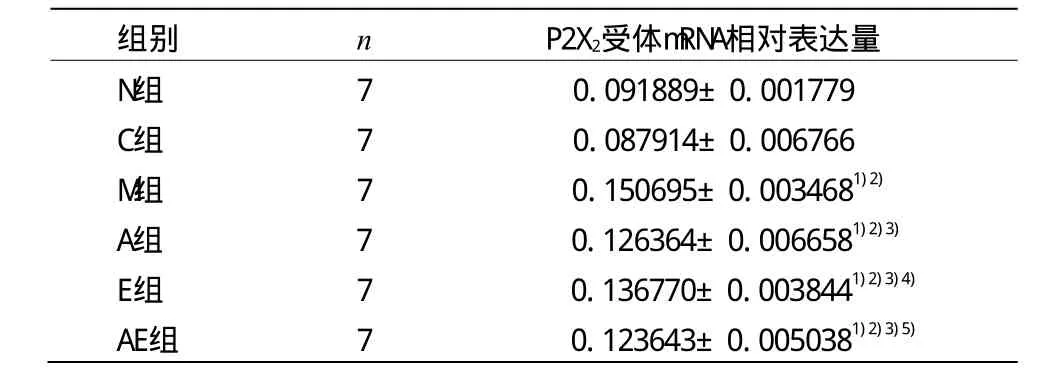
表4 各组大鼠三叉神经节P2X2受体mRNA相对表达量比较(±s)
注:与N组比较1)P<0.01;与C组比较2)P<0.01;与M组比较3)P<0.05;与A组比较4)P<0.05;与E组比较5)P<0.05
组别 n P2X2受体mRNA相对表达量N组 7 0.091889±0.001779 C组 7 0.087914±0.006766 M组 7 0.150695±0.0034681)2)A组 7 0.126364±0.0066581)2)3)E组 7 0.136770±0.0038441)2)3)4)AE组 7 0.123643±0.0050381)2)3)5)
由表4可见,M组、A组、E组和AE组P2X2受体mRNA表达量均显著高于N组和C组(P<0.01);A组、E组和AE组P2X2受体mRNA表达量低于M组(P<0.05);A组P2X2受体 mRNA表达量低于 E组(P<0.05);E组 P2X2受体mRNA表达量高于AE组(P<0.05)。
3 讨论
ATP作为一种重要的神经递质从感觉神经末梢释放,与伤害感受器上一些表达疼痛的分子结合从而参与疼痛的信息传递[11]。研究表明,P2X受体活化是ATP参与疼痛的机制,作用于疼痛的发生和发展[12-13]。P2X作为配体门控非选择性阳离子通道受体[14]有7种亚型(P2X1-7),其中 P2X3受体在疼痛信息的传递起重要作用[15-17]。当疼痛、伤害性剌激引发细胞以及感觉神经末梢的ATP大量释放,引起P2X3受体激活和兴奋,进而诱发动作电位沿着神经系统传递,产生疼痛。有研究[3-5]证实,ATP及其作用的受体特别是P2X2和P2X3受体参与了伤害性信息的传递。牙髓痛是由牙髓的神经末梢传导至外周感受器三叉神经节的感受神经元,经收集后传入下一级神经元,最后到中枢相应部位,由大脑皮层作出痛反应。P2X3受体在三叉神经节高表达,尤其是选择性地表达在中、小细胞上[18]。P2X2、P2X3受体高选择性地表达于中、小直径三叉神经元中[19]。
LPS注射制备的炎性牙髓痛模型具有一定优势[9]。大鼠注入LPS到牙髓腔后使外周伤害性感受器敏感性增强,继而神经末梢的ATP大量释放,引起P2X3受体激活和兴奋,诱发动作电位沿着神经系统传入三叉神经节和中枢神经系统,从而产生痛觉。A-317491是 P2X3受体特异性拮抗剂,它的应用也可推断 ATP和P2X3受体与牙髓痛的传递有关。
本实验结果显示,M组大鼠三叉神经节P2X2、P2X3受体mRNA表达量均显著高于C组(P<0.01)。A组大鼠三叉神经节P2X2受体和P2X3受体mRNA表达量均低于M组(P<0.05,P<0.01),这和其他研究者的实验结果[20]一致,说明A-317491作为P2X3受体的特异性拮抗剂,可抑制 P2X3受体的表达,可推断 A-317491对 P2X2受体有一定的拮抗作用,证实P2X2、P2X3受体参与牙髓痛的痛觉的形成与传递。
合谷是手阳明大肠经的原穴,出自《灵枢·本输》,善治头面、五官疾患,是针灸临床治疗牙痛的效穴[21-22]。针刺合谷穴治疗牙髓痛可能就是通过激活脑区而发挥作用[23],通过刺激中央后回中下部感觉区、中央前回下部运动区、第二感觉运动区、小脑及锥体外系等多个脑区,并且诱导颞叶脑组织血流量和血流容积的增加发挥镇痛作用。针刺镇痛与ATP、P2X受体之间的关系也开始被关注[24]。
本实验结果表明,E组三叉神经节P2X2受体和P2X3受体mRNA表达量均低于M组(P<0.05,P<0.01),提示电针合谷穴可能通过抑制 P2X2、P2X3受体的表达起到有效的镇痛作用。A组大鼠三叉神经节P2X2受体mRNA表达量低于E组(P<0.05),提示A组在抑制P2X2受体的表达优于E组;而A组在抑制P2X3受体的表达虽低于 E组,但两组比较差异无统计学意义(P>0.05),推断两组在抑制P2X3受体表达的作用相仿。
从以上实验结果可以推断在拮抗剂与电针合谷对P2X2、P2X3受体起抑制作用的前提下,拮抗剂与电针合谷在抑制 P2X3受体作用大概一致,拮抗剂在抑制 P2X2受体优于电针合谷,这可能与局部使用A-317491可阻断由ɑ,β-亚甲基三磷酸腺苷及P2X激动剂诱导的传入神经活化和机械致敏反应有关,它作为一种外周作用嘌呤受体阻滞剂,能有效阻断 P2X2、P2X3受体介导的ATP炎性机械痛觉过敏反应[25],因而拮抗剂对 P2X2有较好的抑制作用。
本实验结果显示,AE组大鼠三叉神经节P2X2受体和 P2X3受体 mRNA表达量均低于 M组(P<0.05,P<0.01),提示拮抗剂配合电针能有效抑制P2X2、P2X3受体。AE组大鼠三叉神经节P2X2受体和P2X3受体mRNA表达量均低于E组(P<0.05, P<0.01),推测拮抗剂配合电针抑制P2X2、P2X3受体优于单纯电针治疗。而AE组大鼠三叉神经节P2X3受体mRNA表达稍高于N组和C组(P>0.05),推断拮抗剂配合电针在抑制P2X3受体表达显示出拮抗剂与电针的协同优势。
综上所述,P2X2、P2X3受体参与了实验性牙髓痛的产生与传导,电针对牙髓痛的镇痛作用与 P2X2、P2X3受体参与密切相关,这可能是电针合谷穴镇痛的机制之一,电针合谷穴如何调节 P2X3受体的信号转导还有待进一步研究。
[1]王兵,张翠英,张军岐,等.针刺合谷穴治疗牙痛的临床研究[J].上海针灸杂志,2006,25(8):6-9.
[2]贾婕楠.合谷穴配合中成药治疗牙痛 86例[J].针灸临床杂志,2006,22(3):40.
[3]杨振杰,吴富东,谭奇纹.“面口合谷收”在针灸临床的运用[J].山东中医药大学学报,2011,35(6):566-569.
[4]Ralevic V, Burnstock G. Receptors for purines and pyrimidines[J].Pharmacol Rev, 1998,50(3):413-422.
[5]Wismer CT, Faltynek CR, Jarvis MF, et al. Distinct neurochemical mechanisms are activated following administration of different P2X receptor agonists into the hindpaw of a rat[J]. Brain Res,2003,965(1-2):187-193.
[6]Wang Y, Li G, Liang S, et al. Role of P2X3 receptor in myocardial ischemia injury and nociceptive sensory transmission[J]. Auton Neurosci,2008,139(1-2):30-37.
[7]Zhang C, Li G, Liang S, et al. Myocardial ischemic nociceptive signaling mediated by P2X3 receptor in rat stellate ganglion neurons[J]. Brain Res Bull, 2008,75(1):77-82.
[8]李桂林,梁尚栋,徐昌水,等.颈上交感神经节细胞 P2X3受体介导心肌痛伤害性信息作用的电生理研究[J].中国药理学通报,2007,23(2):193-198.
[9]顾斌,刘洪臣,郭宏,等.大鼠急性牙髓炎动物模型的建立[J].中华老年口腔医学杂志,2009,7(5):304-307.
[10]李忠仁.实验针灸学[M].第 2版,北京:中国中医药出版社,2007:256.
[11]Donnelly-Roberts D, McGaraughty S, Shieh CC, et a1. Painful purinergic receptors[J]. J Pharmacol Exp Ther, 2008,324(2):409-415.
[12]Ohnishi T, Matsumura S, Ito S. Translocation of neuronal nitric oxide synthase to the plasma membrane by ATP is mediated by P2X and P2Y receptors[J]. Mol Pain, 2009,5:40.
[13]刘晓红,阮怀珍.ATP、P2X受体在痛觉调制中的作用及其与其它递质、受体的相互关系[J].神经解剖学杂志,2008,24(4):436-438.
[14]Burnstock G. Physiology and pathophysiology of purinergic neurotransmission[J]. Physiol Rev, 2007,87(2):659-797.
[15]Kuroda H, Shibukawa Y, Soya M, et al. Expression of P2X1and P2X4receptors in rat trigeminal ganglion neurons[J]. Neuroreport, 2012,23(13):752-756.
[16]Gunosewoyo H, Kassiou M. P2X purinergic receptor ligands: recently patented compounds[J]. Expert Opin Ther Pat, 2010,20(5):625-646.
[17]Jarvis MF. The neural-glial purinergic receptor ensemble in chronic pain states[J]. Trends Neurosci, 2010,33(1):48-57.
[18]Xiang Z, Bo X, Burnstock G. Localization of ATP-gated P2X receptor immunoreactivity in rat sensory and sympathetic ganglia[J].Neuorsci Lett, 1998,256(2):105-108.
[19]Shinoda M, Kawahima K, Ozaki N, et a1. P2X3 receptor mediates heat hyperalgesia in a rat model of trigeminal neuropathic pain[J]. J Pain, 2007,8(7):588-597.
[20]Jarvis MF, Burgard EC, McGaranghty S, et al. A-317491, a novel potent and selective non-nucleotide antagonist of P2X3 and P2X2/3 receptors, reduces chronic inflammatory and neuropathic pain in the rat[J]. Proc Natl Acad Sci U S A, 2002,99(26):17179-17184.
[21]蔡定均,刘旭光,赵征宇,等.合谷穴的主治病症研究思路[J].成都中医药大学学报,2011,34(1):5-6.
[22]韩健勇,尤艳利.浅谈合谷穴临床镇痛作用[J].针灸临床杂志,2011, 27(1):70-72.
[23]李落意,赵斌,杨骏,等.“面口合谷收”神经生理机制的 fMRI研究[J].中国中西医结合影像学杂志,2012,10(1):13-22.
[24]聂坤.P2X受体、ATP和针刺的信号转换[J].上海针灸杂志,2009,28(5):298-300.
[25]Wu G, Whiteside GT, Lee G, et al. A-317491, a selective P2X3/P2X2/3 receptor antagonist, reverses inflammatory mechanical hyperalgesia through action at peripheral receptors in rats[J]. Eur J Pharmacol, 2004,504(1-2):45-53.

