胰尾部副脾表皮样囊肿的CT和MRI影像学诊断分析
王健 胡红杰
·短篇论著·
胰尾部副脾表皮样囊肿的CT和MRI影像学诊断分析
王健 胡红杰
胰尾部副脾表皮样囊肿(epidermoid cyst in intrapancreatic accessory spleen, ECIPAS)是一种非肿瘤性胰腺囊肿,较为罕见,1980年Davidson等[1]报道了第一例。术前明确诊断ECIPAS可以避免不必要的手术,或为需要手术者提供合适的外科手术方式,避免不必要的创伤。随着CT和MRI检查技术的进步以及图像质量的提高,越来越多的ECIPAS被检查出来。本研究收集了6例经手术病理证实的ECIPAS,并结合文献分析其CT和MRI影像特点,旨在提高术前诊断的正确率。
一、资料与方法
1.一般资料:收集2005年3月至2015年1月浙江大学附属邵逸夫医院手术并经病理证实的6例ECIPAS患者,其中男性1例,女性5例,年龄23~57岁,平均(46±12)岁。1例因乏力1年就诊,5例为体检发现。所有患者均无腹痛、恶心、呕吐、体重下降等临床不适。无急性胰腺炎及腹部创伤病史。手术方式为胰体尾切除3例,胰体尾联合脾切除3例。
2.影像学检查:术前6例患者均行CT增强检查,4例行MRI增强检查。CT检查采用64排螺旋CT机。患者检查前禁食4 h,检查前30 min喝500~800 ml水,检查时再喝250~300 ml水以充分膨胀胃和十二指肠。采用非离子型对比剂欧乃派克300 mg I/ml 从上肘静脉以2.5~3.0 ml/s的速度注射,剂量2 ml/kg。平扫时屏气,注射后25、60~70 s扫描获取动脉期、门静脉期对比增强图像。扫描参数:管电压120 kV,管电流260 mA,层厚4 mm,连续无间断扫描。
MRI检查采用Siemens 1.5T Sonata MR扫描仪。T2WI采用横断位抑脂快速自旋回波序列(TR 3 000~4 500 ms,TE 70~90 ms,激发角度15°)和冠状位Turefisp序列(TR 3.91 ms,TE 1.96 ms,激发角度70°)。4例同时行DWI检查,采用呼吸触发平面回波成像序列,参数为TR/TE 2 100 ms/127 ms,层厚7 mm,矩阵320×224,激励次数4~6次,FOV 300 mm×400 mm,梯度因子(b)取0、100、600 s/mm2组合。动态增强扫描序列为屏气法三维容积插值序列,TR/TE 3.49 ms/1.02 ms,重建层厚均为5 mm。MRI动态增强扫描前均先行平扫,而后静脉内高压团注15 ml钆喷酸葡胺,注射速率为3.0 ml/s,动态增强扫描方案同CT检查。
3.影像分析:由两位有腹部工作经验的主治和主任医师读片。影像分析的内容主要包括:(1)肿块部位;(2)肿块大小;(3)边缘是否光整;(4)肿块形态;(5)有无实质成分;(6)囊腔特征;(7)囊壁强化特征。如果读片结果不一致,则通过协商达成一致意见,如果影像学表现与病理结果不一致,以病理结果为准。
二、结果
1.一般情况:6例ECIPAS患者肿块均为单发且位于胰尾部,边缘光整,呈椭圆形或类圆形,大小18~47 mm,平均(28±11)mm。4例多房,2例单房。5例囊性,1例囊实性,囊壁厚1~3 mm。术前6例患者均误诊。5例囊性者中4例误诊为囊腺瘤,1例误诊为囊肿;1例囊实性者误诊为实性假乳头状瘤。患者均经腹腔镜手术,3例为胰体尾切除,3例为胰体尾联合脾切除,术后病理均证实为ECIPAS。
2.ECIPAS的CT表现:CT平扫表现为椭圆形或类圆形的低密度灶,1例囊实性,5例囊性。囊性肿块的密度均匀,囊液CT值为23~34 HU,平均27 HU。6例囊壁均显示不清,增强后动脉期囊壁均显示清晰,明显环形强化,囊壁CT值为121~155 HU,平均134 HU,强化程度均高于同层面胰腺,与脾脏相似,其中1例囊壁见由脾动脉分支供血;静脉期囊壁强化程度略有下降,CT值为111~138 HU,平均124 HU,但胰腺强化程度减低较囊壁明显,因此囊壁显示更加清晰,明显高于同层面的胰腺,与脾脏相仿。其中1例囊实性者实性成分平扫CT值38.89 HU(图1A),增强后实性成分轻度强化(图1B、1C),动脉期CT值48.73 HU,静脉期CT值53.18 HU。6例肿瘤中4例呈多房表现,肿瘤内见线样强化的纤维间隔,肿瘤外胰腺组织形态、密度均正常,胰管均无扩张。
3.ECIPAS的MRI表现:4例行T1WI、T2WI、DWI序列检查及增强检查。3例T1WI 呈低信号(图2A),1例呈等高信号;4例T2WI均呈高信号(图2B);3例内见低信号的纤维间隔。DWI上囊液弥散受限呈较高信号,囊壁呈环形低信号(图2C)。增强后动脉期囊壁呈环形强化,囊壁强化程度与同层面的胰腺和脾脏相似(图2D),静脉期和(或)延迟期囊壁进一步强化,囊壁强化程度明显高于同层面的胰腺,与脾脏相仿(图2E)。3例多房肿块内可见明显强化的线样纤维分隔;1例单房及4例囊液均无强化;1例囊壁见由脾动脉分支供血。
4.实验室检查:6例患者CA19-9均升高,为76~196 U/ml,平均(116±47) U/ml;1例CEA升高,为5.52 ng/ml;CA153、CA125、铁蛋白均为阴性,术后这些肿瘤指标均恢复正常。
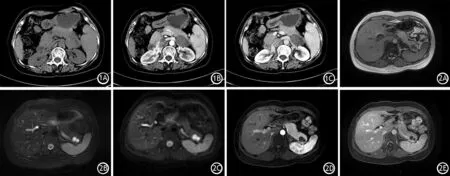
图1 囊实性ECIPAS的CT平扫(1A)、增强动脉期(1B)、静脉期(1C)征象 图2 囊实性ECIPAS的MRI的T1WI(2A)、T2WI(2B)、DWI(2C)、增强动脉期(2D)和延迟期(2E)的表现
5.病理检查:肉眼见肿瘤薄壁半透明状,切面呈单房或多房囊性,囊壁厚1~3 mm,内壁灰白光滑,部分囊内见灰色质软物质。镜下见囊壁由脾组织和纤维组织构成。4例见多个大小不等的囊腔,2例单房。囊液多浑浊,内含数量不一的胆固醇结晶和泡沫细胞。1例囊实性肿瘤的实性成分内含退变组织伴胆固醇结晶。
讨论 副脾指正常脾脏以外存在的、与主脾结构相似,有一定功能的脾组织。据不完全统计,10%的人存在副脾[2]。副脾通常大小1 cm左右,但小者仅在显微镜下可看见,大者可达9 cm。常位于脾门附近,胰尾为第二好发部位,约占1%~2%,临床上非常少见[3]。ECIPAS则非常罕见,到目前为止,据Zavras等[4]的统计,国外目前仅有34篇报道,合计37例患者。此外,Hu等[5]又报道了7例。国内仅有3篇报道,共4例患者[3,6-7]。本组报道6例。
表皮样囊肿起源于胚胎外胚层,由复层鳞状上皮附于一层纤维结缔组织而构成的囊肿。ECIPAS的形成原因主要有3种理论:(1)组织起源学说,认为正常脾组织的荚膜间皮内陷入胰腺并囊变、组织转化形成[8-9];(2)胎儿时期残留在胰腺内的脾组织囊变或由胰腺鳞状上皮组织转化形成[10];(3)来源于胰导管上皮的胎芽畸变或为胰导管突入到胰尾副脾内[11-12]。但胰胆管与ECIPAS的形成无关[13-15]。
汇总国内外48例患者及本组6例资料,54里患者中男性22例,女性32例,男女比例为1∶1.45,年龄12~70岁,平均45岁。32例(59.3%)患者无任何临床症状,22例患者有症状,最常见为腹痛,共15例,少见的症状有恶心、呕吐、腹部不适、乏力、腹胀、胸痛及发热。所有肿瘤均位于胰尾部,大小1.4~12.6 cm。54例患者中40例检测血CA19-9,23例(57.6%)升高。Hwang等[16]认为可能是囊壁内的鳞状上皮细胞分泌所致。
所有报道的ECIPAS均为良性,未见恶性变的相关报道。该肿瘤比较罕见,术前诊断正确率较低,误诊率高达90%以上。CT和MRI检查仅1例被正确诊断[17]和1例被强烈怀疑[18]。对于较小且无症状的肿瘤,术前若能正确诊断,可不必手术[18-19]。
CT平扫显示肿瘤均为单发,位于胰尾部,密度偏低;多为囊性灶,囊壁显示不清;胰腺组织正常,胰管无扩张。增强动脉期见囊壁明显强化,强化程度高于同层面胰腺,与脾脏相似,静脉期略有下降,但仍明显高于胰腺组织,与脾脏相仿,囊液均无明显强化。囊壁明显强化与囊壁由脾组织和少量纤维组织构成相关。本组1例囊壁见供血动脉,这在以往报道中未曾提及过。1例囊实性肿块的实性成分轻度强化,术后病理证实实性成分为退变组织伴胆固醇结晶。以往病例报道中鲜有实性成分强化者。
MRI检查肿瘤T1WI呈低信号,T2WI呈高信号,DWI上弥散受限呈较高信号。增强后囊壁显示清晰,内壁光滑,动脉期囊壁明显强化,静脉期及延迟期进一步强化,强化程度明显高于胰腺,与同层面的脾脏相似,囊液无强化。多房型肿块内可见明显强化的线样纤维间隔。本组1例患者的肿瘤在T1WI上呈等高信号,这与囊液内含大量胆固醇和少量出血有关,3例多房者的囊内纤维间隔增强后亦明显强化,1例囊壁见由脾动脉分支供血,囊壁构成成分及血供特征使其强化方式具有一定特征性。因此认识肿瘤囊壁的构成、血供特点和强化特征对正确诊断本病非常重要,对临床手术方式的选择亦有一定的指导作用。对无任何临床症状者,当肿瘤较小且囊壁较厚时建议随访观察。
ECIPAS需与以下肿瘤鉴别。(1)浆液性囊腺瘤和黏液性囊腺瘤。浆液性囊腺瘤表现为多房的囊性肿块,囊内可见实性部分和纤维间隔,中央部有时见星状的瘢痕、钙化,病变中心的钙化特别是放射状钙化具有特征性诊断意义;黏液性囊腺瘤可呈分叶状,囊壁较厚,内有纤维间隔和实性结节,有时可见囊壁和囊内钙化。增强扫描肿瘤壁、纤维间隔和实体肿瘤部分均较明显强化。(2)胰腺真性囊肿和假性囊肿。真性囊肿表现为壁薄,低密度,单房,无分隔的先天性囊肿或与胰导管相连的潴留性囊肿;假性囊肿影像学表现与真性囊肿相似,但临床多有外伤和胰腺炎病史。囊肿铁蛋白多有升高。(3)胰腺癌囊性变。表现为胰腺肿大、局部肿块、胰管扩张和远端胰腺萎缩等。囊性变多位于中心或偏中心,可伴周围浸润和淋巴结转移。(4)实性假乳头状瘤。肿瘤为囊实性结构,增强后实性成分动脉期轻度强化,门静脉期明显强化,囊性部分无强化,可有分叶,不伴有胰管和胆总管的扩张。
总之,ECIPAS极其罕见,CT和MRI表现具有一定的特征。当肿瘤发生在胰尾部,呈椭圆形或类圆形,增强后静脉期或延迟期囊壁的强化程度明显高于胰腺,与脾脏相似,则应考虑ECIPAS,若同时CA19-9升高则需高度怀疑ECIPAS。
[1] Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen [J]. Dig Dis Sci, 1980, 25(12):964-967.
[2] Servais EL,Sarkaria IS,Solomon GJ, et al. Giant epidermoid cyst within an intrapancreatic accessory spleen mimicking a cystic neoplasm of the pancreas:case report and review of the literature [J].Pancreas,2008, 36(1):98-100.
[3] 方剑锋,王宁,鲁葆春. 胰尾部副脾表皮样囊肿一例 [J]. 中华普通外科杂志,2011, 26(4):331.
[4] Zavras N, Machairas N, Foukas P, et al. Epidermoid cyst of an intrapancreatic accessory spleen: a case report and literature review [J]. World J Surg Oncol, 2014,12(7):92.
[5] Hu S, Zhu L, Song Q, et al. Epidermoid cyst in intrapancreatic accessory spleen: computed tomography findings and clinical manifestation [J]. Abdom Imaging, 2012, 37(5):828-833.
[6] 徐丽梨,费健,朱坚,等.胰尾部副脾表皮样囊肿二例及文献复习 [J]. 中华胰腺病杂志, 2011, 11(4):288-290.
[7] 张晋夏,崔全才. 胰腺内副脾巨大表皮样囊肿一例[J].诊断病理学杂志,2004, 11(5):291.
[8] Ough YD, Nah HR, Wood DA. Mesothelial cysts of the spleen with squamous metaplasia[J]. Am J Clin Pathol,1981, 76(5):666-669.
[9] Bürrig KF. Epithelial (true) splenic cysts. Pathogenesis of the mesothelial and so-called epidermoid cyst of the spleen.[J]. Am J Surg Pathol,1988, 12(4):275-281.
[10] Lifschitz-Mercer B, Open M, Kushnir I, et al. Epidermoid cyst of the spleen: a cytokeratin profile with comparison to other squamous epithelia[J]. Virchows Arh,1994,424(2):213-216.
[11] Morohoshi T, Hamamoto T, Kunimura T, et al. Epidermoid cyst derived from an accessory spleen in the pancreas: A case report with review survey[J]. Acta Pathol Jpn,1991, 41(12): 916-921.
[12] Tateyama H, Tada T, Murase T, et al. Lymphoepithelial cyst and epidermoid cyst of the accessory spleen in the pancreas[J]. Mod Pathol, 1998, 11(12):1171-1177.
[13] Yokomizo H, Hifumi M, Yamane T, et al. Epidermoid cyst of an accessory spleen at the pancreatic tail: diagnostic value of MRI[J]. Abdom Imaging, 2002, 27(5):557-559.
[14] Yamanishi H, Kumagi T, Yokota T, et al. Epithelial cyst arising in an intrapancreatic accessory spleen: a diagnostic dilemma[J]. Intern Med, 2011, 50(18):1947-1952.
[15] Iwasaki Y, Tagaya N, Nakagawa A, et al. Laparoscopic resection of epidermoid cyst arising from an intrapancreatic accessory spleen: a case report with review of the literature[J]. Surg Laparosc Endosc Percutan Tech, 2011, 21(5):e275-e279.
[16] Hwang HS, Lee SS, Kim SC, et al. Intrapancreatic accessory spleen: clinicopathologic analysis of 12 cases[J]. Pancreas, 2011, 40(6):956-965.
[17] Itano O, Shiraga N, Kouta E, et al. Epidermoid cyst originating from an intrapancreatic accessory spleen[J]. J Hepatobil Pancreas Surg, 2008, 15(4):436-439.
[18] Itano O, Chiba N, Wada T, et al. Laparoscopic resection of an epidermoid cyst originating from an intrapancreatic accessory spleen: report of a case[J]. Surg Today , 2010, 40(1):72-75.
[19] Motosugi U, Yamaguchi H, Ichikawa T, et al. Epidermoid cyst in intrapancreatic accessory spleen: radiological findings including superparamagnetic iron oxide-enhanced magnetic resonance imaging[J]. J Comput Assist Tomogr, 2010, 34(2):217-222.
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2015.03.018
310016 杭州,杭州市江干区人民医院放射科(王健);浙江大学医学院附属邵逸夫医院(胡红杰)
胡红杰,Email:119202405@qq.com
2015-02-20)

