接种BmNPV后抗性品种和非抗性品种家蚕组织中2种酶活性的比较研究
李龙 张蕾 张东阳 刘泽玉 徐安英 钱荷英 武国华
摘要 [目的] 探讨抗性品种和非抗性品种家蚕接种家蚕核型多角体病毒(BmNPV)后体内羧酸酯酶(CarE)和乙酰胆碱酯酶(AchE)活性的变化规律。[方法]对抗性品种及其对照品种家蚕添食BmNPV,测定并比较中肠和血液中羧酸酯酶和乙酰胆碱酯酶的活性变化。[结果] 家蚕接种BmNPV后,抗性品种的中肠中羧酸酯酶活性上升,而对照品种羧酸酯酶活性先升高,然后从第3天开始活性降低。抗性品种前2 d中肠的乙酰胆碱酯酶活性降低,而对照品种与之相反。家蚕接种BmNPV后,抗性品种在第2天血液羧酸酯酶活性有所升高,此后基本保持不变,而非抗性品种在第3天羧酸酯酶活性升高后下降;抗性品种血液乙酰胆碱酯酶活性升高,对照品种前2 d乙酰胆碱酯酶升高后降低。[结论]抗性品种在感染BmNPV病毒后其中肠中羧酸酯酶活性高于未感染的抗性品种,表明抗性品种对感染病毒做出了有效应答和防御;而在感染病毒后抗性品种的中肠与血液中乙酰胆碱酯酶活性均变化相对较小。据此推测,抗性品种在感染病毒后仍保持了相对稳定的代谢过程。
关键词 家蚕;BmNPV;羧酸酯酶;乙酰胆碱酯酶
中图分类号 S88 文献标识码 A 文章编号 0517-6611(2015)11-123-04
家蚕(Bombyx mori)是一种具有较高经济价值的昆虫,同时也是鳞翅目的模式生物。家蚕幼虫易受到多种病原微生物的入侵,其中家蚕核型多角体病毒(Bombyx mori nuclear polyhedrosis virus, BmNPV)是养蚕过程中经常遇到的也是危害巨大的一种病原体。由BmNPV侵染引起的家蚕核型多角体病毒病传染性极强,死亡率高,且难以控制,可给蚕业生产造成巨大的经济损失,一直是蚕桑产业的防控和研究的重点之一[1-2]。BmNPV主要在家蚕细胞核内增殖,随着病毒增多细胞开始核膨胀,随后细胞膨大破裂,从而使病毒及细胞碎片游离于血液中[3]。家蚕感染病毒后会出现体色变为乳白,腹面尤其明显,刺破体皮会流出乳白色的脓汁,体节肿胀,狂躁不安,四处爬行。目前已有许多关于家蚕与BmNPV感染、抗性的研究,并培育出抗BmNPV家蚕品种投入到蚕桑生产中[4]。中国农业科学院蚕业研究所培育的家蚕抗性品种871C×872C的半致死浓度(LC50)在10.9数量级,比对照品种高出4~5个数量级[5]。然而,家蚕对BmNPV的抗性机制至今尚不完全清楚。
一般认为,家蚕经口接种BmNPV感染的最初部位是中肠,且中肠是家蚕抗BmNPV的第一道防线[6-7]。研究发现,家蚕对BmNPV的抗性的第1阶段可能是家蚕中肠细胞受体蛋白阻止病毒侵染家蚕细胞,第2阶段可能是中肠细胞内的某些抗病毒蛋白阻止了病毒的复制和增殖[8-10]。血液作为家蚕重要的免疫防御组织,在受到病毒入侵时也会发生相应的变化,如通过血细胞对病毒进行吞噬,产生能够抑制或消灭病毒的物质,从而发挥重要的防御功能[11]。病毒入侵会影响家蚕正常的生理代谢,尤其会引起其体内多种酶活性发生变化[12-13]。羧酸酯酶和乙酰胆碱酯酶是家蚕体内重要的代谢酶,与家蚕的生理状态相关。研究表明,家蚕中肠羧酸酯酶活性与家蚕对浓核病毒的抗性有关,接种浓核病毒12 h后抗性品系中肠羧酸酯酶活力升高[14]。谢洪霞等[15]研究发现家蚕感染BmNPV后蚕体内羧酸酯酶和乙酰胆碱酯酶活性发生变化。因此,羧酸酯酶和乙酰胆碱酯酶的活性可以反映家蚕代谢是否稳定,用来判断家蚕是否受到病毒侵害。但是,不同家蚕品种对BmNPV的抗性存在较大差异[16],目前对于家蚕感染BmNPV后体内羧酸酯酶和乙酰胆碱酯酶活性的变化规律还不明确。
笔者以新近选育的具有较强BmNPV抗性的家蚕品种洞庭C×碧波C为研究对象,与对照品种洞庭×碧波进行比较研究。用5龄家蚕幼虫经口添食BmNPV,研究感染BmNPV后抗性品种及其对照品种之间中肠和血液中羧酸酯酶和乙酰胆碱酯酶活性的变化规律。
1 材料与方法
1.1 供试材料
抗BmNPV家蚕品种洞庭C×碧波C、对照品种洞庭×碧波,均由江苏科技大学蚕业研究所提供。抗性品种的遗传背景与对照种99.9%相同,但带有抗病基因。BmNPV病毒由江苏科技大学蚕业研究所病理室提供,浓度为1.0×10.9多角体/ml。
1.2 仪器与试剂
BioTek PowerWave XS2酶标仪;法国Millipore公司Milli-Q超纯水仪;乙酰胆碱酯酶测试盒,购自南京建成生物工程研究所;α-乙酸奈酯(α-NA 分析纯);α-萘酚(分析纯);固蓝B盐(分析纯);十二烷基硫酸钠(SDS;分析纯);4-硝基苯酚棕榈酸酯(P-NPP;分析纯);4-硝基苯酚(p-NP;分析纯);无水碳酸钠(分析纯);无水乙醇(分析纯);磷酸氢二钠(分析纯);磷酸二氢钠(分析纯)。
1.3 病毒接种及样品制备
抗性品种和对照品种家蚕饲养至5龄,分别分为2组,其中1组在5龄起蚕时经口添食接种BmNPV病毒液,每头添食10 μl,另1组作为正常对照。4种处理(抗性品种接种病毒、抗性品种正常、对照品种接种病毒、对照品种正常),每24 h取1次中肠和血液,至添毒后第5天,将采集血液于4 ℃下12 000 r/min离心20 min,取上清液保存,置于-80 ℃冰箱中保存备用。
1.4 家蚕体内酶活性的测定
①酶液制备:中肠组织用冰冷的0.04 mol/L磷酸盐缓冲液(pH 7.0)2 ml作为提取液研磨匀浆,匀浆液于4 ℃下12 000 r/min离心20 min,取上清液作为中肠酶液。
②羧酸酯酶活性的测定方法参照Van Asperen法[17-18]。取稀释10倍的中肠酶液10 μl或稀释10倍的血液30 μl,加入3 ml 0.04 mol/L磷酸盐缓冲液(pH 7.0)及0.5 ml 3×10-4 mol/L α-乙酸奈酯液(用0.04 mol/L pH 7.0磷酸盐缓冲液配制),37 ℃水浴中反应30 min,加入50 μl显色剂(1%固蓝B盐和5%SDS按2∶5混合),室温下放置10 min后于600 nm处测定吸光度。用0.04 mol/L pH7.0磷酸盐缓冲液作空白调零,通过建立α-萘酚标准曲线计算酶液中羧酸酯酶活性。在上述试验条件下,以每分钟水解α-乙酸奈酯产生1 nmol α-萘酚所需的酶量定为1个酶活力单位。每个样品设3个重复。③乙酰胆碱酯酶活性测定使用乙酰胆碱酯酶测试盒。
2 结果与分析
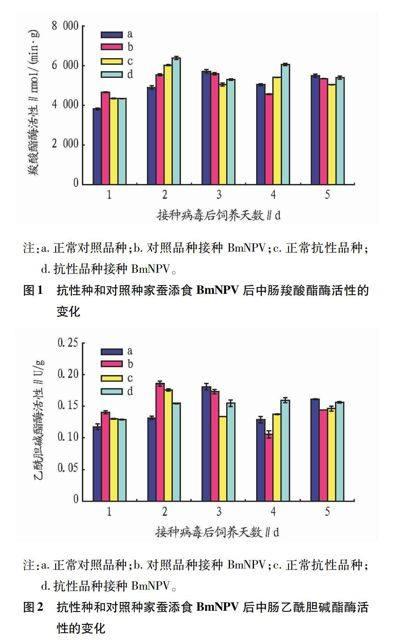
2.1 中肠2种酶活性的变化
2.1.1 中肠羧酸酯酶活性的变化。
测定了抗性品种及其对照品种5龄家蚕添食BmNPV第1~5天中肠羧酸酯酶活性。从图1可以看出,抗性家蚕接种第2天开始比未接种BmNPV的家蚕羧酸酯酶活性明显升高。对照品种家蚕接种BmNPV后第1、2天与正常对照品种家蚕相比羧酸酯酶活性明显增强,但第3、4、5天羧酸酯酶活性明显降低。
2.1.2 中肠乙酰胆碱酯酶活性的变化。
测定了抗性品种及对照品种5龄家蚕添食BmNPV第1~5天中肠乙酰胆碱酯酶活性。从图2可以看出,抗性品种在接种BmNPV病毒后其活性并未发生较大变化。对照品种在接种BmNPV后第1、2天乙酰胆碱酯酶活性明显高于未接种家蚕,而第3~5天乙酰胆碱酯酶活性明显低于未接种家蚕,这种变化趋势和对照品种接种BmNPV后中肠中羧酸酯酶活性变化规律基本一致。
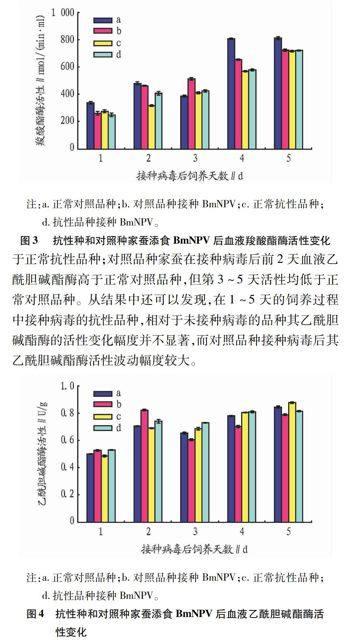
2.2 血液中2种酶活性的变化
2.2.1 血液羧酸酯酶活性的变化。
测定了抗性品种及对照品种家蚕5龄添食BmNPV第1~5天血液羧酸酯酶活性。从图3可以看出,正常品种在接种病毒后,除第3天以外血液中羧酸酯酶活力均低于正常对照品种。抗性品种在接种病毒后,第1、3、4、5天血液中的羧酸酯酶活性与正常抗性品种差距不大,而第2天羧酸酯酶活性要高于正常抗性品种。另外,血液中的羧酸酯酶活性要远低于中肠中的羧酸酯酶活性。
2.2.2 血液乙酰胆碱酯酶活性的变化。
测定了抗性品种及对照品种家蚕5龄添食BmNPV第1~5天血液乙酰胆碱酯酶活性。从图4可以看出,抗性品种家蚕接种病毒后第1~4天血液乙酰胆碱酯酶均高于正常抗性品种,而第5天活性低于正常抗性品种;对照品种家蚕在接种病毒后前2天血液乙酰胆碱酯酶高于正常对照品种,但第3~5天活性均低于正常对照品种。从结果中还可以发现,在1~5天的饲养过程中接种病毒的抗性品种,相对于未接种病毒的品种其乙酰胆碱酯酶的活性变化幅度并不显著,而对照品种接种病毒后其乙酰胆碱酯酶活性波动幅度较大。
3 讨论
在家蚕感染BmNPV的研究中,一般将BmNPV在蚕体内的增殖大体分为4个时期[19-20]: 接种后36 h内的隐潜期、接种后36~60 h的缓慢增殖期、接种后64~84 h的高速增殖期以及接种84 h以后的稳定增殖期。一般鳞翅目昆虫经口感染NPV后,中肠组织的细胞先被感染,然后再蔓延到其他组织,进入血淋巴最后导致昆虫死亡[21-22]。笔者选用的家蚕品种是抗病品种洞庭C×碧波C和其对照品种洞庭×碧波,这2种家蚕除了理论上存在抗性基因差异外,其余99.9%的遗传背景是相同的。在试验过程中也发现,对照品种接种BmNPV后第3天血液开始出现浑浊,到第5天所有对照品种家蚕都呈现体色发白,腹面部尤其明显,且血液成乳白浓稠状态。这说明对照品种染病明显,而抗性品种接种病毒后无此现象,表明此抗性品种确实对BmNPV具有很好的抗性。
国内外研究表明,羧酸酯酶能有效地催化水解酯类和酰胺类化合物,参与多种药物、环境毒物及致癌物的解毒和代谢,并与脂质的运输和代谢有关[23],同时它们也是昆虫与抗性相关的重要解毒代谢酶。乙酰胆碱酯酶是神经递质乙酰胆碱的水解酶,其活性变化能够反映出细胞的代谢状态。如果乙酰胆碱酯酶活性发生较大变化,也预示着家蚕的整个代谢及生理过程受到了较大的干扰和影响。
在试验过程中,由于中肠是家蚕最先接触病毒感染的组织,因此中肠内酶活性的变化更能反映BmNPV对家蚕生理状态的影响。通过对抗性品种和对照品种接种BmNPV后中肠羧酸酯酶和乙酰胆碱酯酶的活力测定和比较,发现抗性品种接种病毒后羧酸酯酶活性均高于正常抗性品种,而对照品种接种BmNPV后第1、2天羧酸酯酶活性明显高于正常对照品种,第3~5天羧酸酯酶活性明显低于正常对照品种。对照品种在接种第3天羧酸酯酶活性发生明显转变,推测这可能与BmNPV的感染有关,病毒入侵后导致对照品种在感染第2、3天中肠细胞大量破裂,BmNPV扩散至血液等其他组织。试验过程中也发现,对照品种接种BmNPV第3天血液开始变浑浊,说明细胞破裂,病毒与细胞碎片游离于血液中。这说明中肠羧酸酯酶活力提高可能与家蚕对BmNPV的抗性有关,也可能还与BmNPV的感染刺激有关,这与谢洪霞[15]等的研究结果病毒感染后蚕体内羧酸酯酶活性升高相似。从乙酰胆碱酯酶的活性来看,抗性品种接种病毒后中肠中乙酰胆碱酯酶活性波动较小,说明抗性品种的代谢过程所受的影响较小,家蚕保持了相对稳定的生活状态;对照品种接种病毒后,其乙酰胆碱酯酶活性波动较大,这可能与BmNPV病毒感染造成的细胞破裂,家蚕的代谢过程受到严重干扰有关。
抗性品种和非抗性品种在接种病毒后第1天血液羧酸酯酶活性均有所下降,可能与病毒侵染有关,但抗性品种在接种第2天血液羧酸酯酶活性升高后活性基本保持不变,这可能是由于抗性品种对BmNPV产生抗性所致,使BmNPV没有继续侵染或延缓了BmNPV的侵染。非抗性品种在接种第3天羧酸酯酶活性升高之后活性明显下降,这可能与对照品种受到病毒感染有关。另外,在感染病毒后抗性品种血液中的乙酰胆碱酯酶并未受到显著影响,其活性保持了相对稳定的状态;受到病毒感染后,对照品种家蚕的乙酰胆碱酯酶活性波动较大,在感染后第2天对照品种血液中乙酰胆碱酯酶活性发生了显著升高,这与对照品种感染后第2天中肠中乙酰胆碱酯酶活性升高有一定对应性,它也预示着家蚕的正常生理活动与代谢过程受到了严重影响。
参考文献
[1]浙江大学. 家蚕病理学[M]. 北京: 中国农业出版社, 2001: 36-53.
[2] 黄桂辉, 黎明, 李尧方. 家蚕病毒病的发病规律及综合防治措施[J]. 现代农业科技, 2012(17): 266-274.
[3] 吕鸿声.昆虫病毒分子生物学[M].北京: 中国农业科技出版社, 1998: 1-15.
[4] 李木旺. 家蚕抗核型多角体病毒病、浓核病的种质创新及RAPD分子标记的研究[D]. 北京: 中国农业科学院, 2001.
[5] 李文学, 青学刚, 刘俊凤, 等. 家蚕品种871C×872C对BmNPV抗性鉴定研究[J]. 西南农业学报, 2011, 24(2): 779-781.
[6] CORY J S, MYERS J H. The ecology and evolution of insect baculoviruses[J]. Annu Rev Ecol Syst, 2003, 34: 239-272.
[7] RAHMAN M M, GOPINATHAN K P. Systemic and in vitroinfection process of Bombyx mori nucleopolyhedrovirus[J]. Virus Research, 2004, 101(2): 109-118.
[8] KANGAYAM M P, HIROSHI N, SEIICHI F, et a1. A lipase isolated from the silkworm Bombyx mori shows antiviral activity against nucleopolyhedrovirus[J]. Journal of Virology, 2003, 77: 10725-10729.
[9] HIROSHI N, EIKO T, KANGAYAN M P, et a1. Antiviral activity of a serine protease from the digestive juice of larvae against nucleopolyhedrovirus [J]. Virology, 2004, 321: 154-162.
[10] 姚慧鹏, 何芳青, 郭爱芹, 等. 中国野桑蚕抗病毒蛋白基因(Lipase)的克隆与活性鉴定[J]. 蚕业科学, 2008, 34(3): 466-471.
[11] 吕鸿声. 昆虫免疫学原理[M]. 上海: 上海科学技术出版社, 2008: 97-123.
[12] 刘震, 鲍先巡, 尤征英, 等. 家蚕对BmNPV抗病性与中肠消化酶活性的关系[J]. 安徽农业大学学报, 2009, 36(3): 489-492.
[13] BABU K R, RAMAKRISHNA S, REDDY Y H K, et a1. Metabolic alterations and molecular mechanism in silkworm larvae during viral infection: A review[J]. Afr J Biotechnol, 2009, 8(6): 899-907.
[14] 高贵田, 陈克平, 姚勤, 等. 抗浓核病毒中国株家蚕品系中肠羧酸酯酶活力变化和基因表达差异的研究[J]. 中国农业科学, 2007, 40(5): 1042-1049.
[15] 谢洪霞, 涂增, 万永继, 等. 不同饲料饲养对家蚕抗核型多角体病毒的能力以及体内3种代谢酶活性的影响[J]. 蚕业科学, 2009, 35(3): 642-647.
[16] 陈克平, 林昌麒, 姚勤. 家蚕对核型多角体病的抗性及遗传规律的研究[J]. 蚕业科学, 1996,22(3):160-164.
[17] ASPEREN K V. A study of housefly esterases by mean of asensifive colorimetric method[J]. Jins Physiol, 1962, 8: 401-406.
[18] THOMAS V. Comparison of lipases by different assays[J]. Enzyme Microbiology Technology, 1992,14: 631-635.
[19] 徐家萍, 刘明辉, 孙帆. 家蚕核型多角体病的抗性机制研究进展[J]. 中国蚕业, 2006, 27(2): 8-14.
[20] 华南农业大学. 蚕病学[M]. 2版.北京: 农业出版社,1993: 5-21.
[21] ENGELHARD E K, VOLKMAN L E. Developmental resistance in fourth instar Trichoplusia niorally inoculated with Autographa californicaM nuclear polyhedrosis virus[J]. Virology, 1995, 209: 384-389.
[22] KIRKPATRICK B A, WASHBURN J O, VOLKMAN L E. AcMNPV pathogenesis and developmental resistance in fifth instarHeliothis virescens[J]. J Invertebr Pathol, 1998, 72: 63-72.
[23] 滕霞, 孙曼霁. 羧酸酯酶研究进展[J]. 生命科学, 2003, 15(1): 31-35.

