从海绵Pseudoceratina purpurea中分离的化合物及其结构鉴定
王海鸣 李支薇 田光超 任祥祥
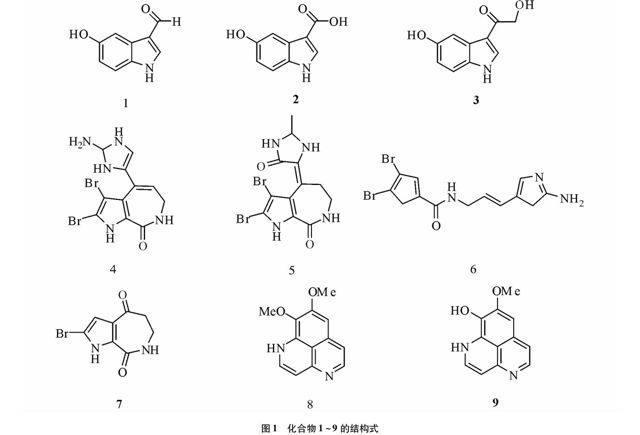
摘要 对海绵Pseudoceratina purpurea的化学成分进行系统研究。采用多种分离手段对海绵Pseudoceratina purpurea进行化学成分的分离,运用多种波谱分析手段和与文献报道对比的方法,对分离得到的化合物进行结构鉴定。从海绵Pseudoceratina purpurea中共分离得到9个化合物,经鉴定为hyrtiosin A (1),5-羟基-1H-吲哚-3-羧酸 (2),11-hydroxy-12-(5-hydroxy-1H-indole-3-yl)-ethanone (3),Stevensine (4),Spongiacidin A (5),Oroidin (6),2-bromoaldisine (7),Aaptamine (8),demethylaaptamine (9)。所有化合物均为首次从海绵Pseudoceratina purpurea中分离得到。
关键词 海绵Pseudoceratina purpurea;化合物;结构鉴定
中图分类号 S188;R284.1文献标识码A文章编号 0517-6611(2015)11-005-03
海洋中蕴藏着非常丰富的海洋天然生物资源,是一个巨大的天然产物宝库。海绵是其中最原始的低等生物[1-2]。近年来,国内外对海绵的研究非常活跃,已从不同海域不同海绵中分离出数百种结构新颖的化学成分。目前为止,海洋生物中新化合物的最大来源仍是海绵[3]。我国南海环境特殊,凭借其低污染和物种丰富等优势,成为海洋生物研究者们竞相前往寻求原料的首选[4]。据文献报道,维隆格海绵目海绵Verongiida含有丰富的溴代衍生物,而目前关于该目海绵Pseudoceratina purpurea的报道尚少。为寻求具有抗肿瘤、抗病毒等活性的化合物,笔者从南海采集海绵Pseudoceratina purpurea进行系统的化学成分研究,采用1H NMR、13C NMR、UV、ESI-MS等分析手段及与文献报道对比方法,对从该海绵中获得的单体化合物进行结构鉴定。
1 材料与方法
1.1 试验仪器和材料
Waters 2695高效液相色谱仪(二极管阵列检测器,分析柱:4.6 mm×150 mm,半制备柱:10 mm×250 mm,5 μm,Phenomenex,美国Waters公司);Brucker Avance 600 型核磁共振波谱仪(德国Bruker公司); Lambda 35紫外可见分光光度计(美国Perkin-Elmer公司);N-1100V-W旋转蒸发仪(日本东京理化株式会社);LCQDecaXP ESI质谱仪(美国Finnigan公司);Sephadex LH-20(美国GE Healthcare公司);柱层析硅胶(青岛海洋化工有限公司生产);其他所用试剂均为分析纯。
1.2 生物材料采样于海南省文昌县附近海域,湿重5 kg。经荷兰阿姆斯特丹大学动物学博物院Rob van Soest 博士鉴定为海绵Pseudoceratina purpurea,标本现存于广州广电计量检测股份有限公司藻种室。
1.3 分离纯化室温下用乙醇-二氯甲烷(2∶1,V∶V)浸提3次,每次10 d,将所得的粗提物加1体积水混悬,依次采用有机溶剂乙酸乙酯和正丁醇萃取,减压回收萃取溶剂,得到乙酸乙酯部萃取物28.11 g和正丁醇部萃取物13.15 g。对乙酸乙酯部萃取物和正丁醇部萃取物采用Sephadex LH-20、硅胶柱色谱和半制备高效液相色谱等方法进行分离、纯化。
1.4 化合物1~9的结构鉴定运用1H NMR、13C NMR、UV、ESI-MS等分析手段及与文献报道对比方法,对获得的单体化合物1~9进行结构鉴定。
2 结果与分析
2.1 化合物1~9的分离纯化乙酸乙酯部萃取物(28.11 g) 采用正相硅胶层析 (Pet:=(10∶0)~(0∶10),V∶V)分离,然后根据薄层色谱检测结果合并近似流份,共得到9个分离部位(A~I)。部位C使用Sephadex LH-20(MeOH)再次分离,根据薄层色谱检测结果合并近似流份,得到3个子分离部位C-1、C-2和C-3。C-2使用Sephadex LH-20(MeOH)再次分离,得到2个流份C-2-1和C-2-2,再用HPLC(MeOH∶H2O = 7∶93,V∶V)对C-2-1进行分离,得到化合物1(2.7 mg)和化合物2(3.6 mg)。E组分使用正相硅胶色谱 (CHCl3∶Me2CO=(1∶0)~(0∶1),V/V)细化分离,得到4个子分离部位E-1~E-4。子部位E-4经半制备HPLC (MeOH∶H2O=25∶75,V∶V)进行分离,得到化合物3 (6.7 mg)和化合物4 (1.8 mg)。F组分使用正相硅胶色谱 (CHCl3:Me2CO=(1∶0)~(0∶1),V∶V)再次分离,得到5个子分离部位F-1~F-5。F-2用半制备HPLC (MeOH∶H2O=5∶95,V∶V)分离,得化合物5 (1.6 mg)和化合物6 (1.3 mg)。F-3直接采用半制备HPLC (流动相MeOH∶H2O=35∶65,V∶V)进行分离,得化合物7 (2 mg)。
正丁醇萃取物(13.15 g)采用正相硅胶层析,得到4个分离部位(J-1~J-4)。J-3用半制备HPLC (MeOH∶H2O=15∶85,V∶V)进行分离,得到化合物8 (2.6 mg)和化合物9 (3.1 mg)。
2.2 化合物1~9结构鉴定 化合物1~9的结构见图1。化合物1白色无定形粉末;ESI-MS m/z 161 [M+H]+;1H NMR (600 MHz,DMSO) δH:11.90 (br,H-NH),9.87 (s,H-10),8.13(brd, J = 3.0 Hz,H-2),7.40 (d,J = 2.5 Hz,H-4),7.26 (d,J = 8.8 Hz,H-7),6.74 (dd,J = 2.5,8.8 Hz,H-6); 13C NMR (150 MHz,CD3OD) δC:184.2 (d,C-10),152.1 (s,C-5),138.1 (d,C-2),133.2 (s,C-8),125.3 (s,C-9),117.3 (s,C-3),113.2 (d,C-7),113.1 (t,C-6),104.4 (d,C-4)。以上数据与文献[5]对照基本一致,因此将化合物1鉴定为hyrtiosin A。
化合物2白色无定形粉末;ESI-MS m/z 177 [M+H]+;1H NMR (600 MHz,DMSO) δH:11.83 (brs,H-NH),7.90(brd, J = 3.0 Hz,H-2),7.55 (d,J = 2.5 Hz,H-4),7.24 (d,J = 8.8 Hz,H-7),6.75 (dd,J = 2.5,8.8 Hz,H-6); 13C NMR (150 MHz,CD3OD) δC:193.6 (d,C-10),152.0 (s,C-5),138.1 (d,C-2),130.0 (s,C-8),125.5 (s,C-9),128.2 (s,C-3),111.4 (d,C-7),113.0 (t,C-6),104.4(d,C-4)。以上数据与文献[5]对照基本一致,因此将化合物2鉴定为5-羟基-1H-吲哚-3-羧酸。
化合物3白色无定形粉末;ESI-MS m/z 191 [M+H]+;1H NMR (600 MHz,DMSO) δH:11.72 (brs,H-NH),8.00 (brd,J = 3.0 Hz,H-2),7.52 (d,J = 1.8 Hz,H-4),7.33 (d,J = 8.8 Hz,H-7),6.73 (dd,J = 2.5,8.8 Hz,H-6); 13C NMR (150 MHz,CD3OD) δC:196.3 (d,C-10),152.1 (s,C-5),133.0 (s,C-8),130.1 (d,C-2),126.5 (s,C-9),114.2 (s,C-3),112.4 (d,C-7),112.0 (t,C-6),105.4(d,C-4)。以上数据与文献[5]对照基本一致,因此将化合物3鉴定为11-hydroxy-12-(5-hydroxy-1H-indole-3-yl)-ethanone。
化合物4橙色无定形固体;UV ёmax 224,235 nm; ESI-MS m/z 386,388,390 [M+H]+;1H NMR (600 MHz,DMSO) δH:6.81 (s,H-12),6.24 (t,J = 6.9 Hz,H-9),3.56 (d, J = 7.0 Hz,H-8);13C NMR (150 MHz,CD3OD) δC:161.2 (s,C-6),126.1 (s,C-9),120.8 (s,C-10)。以上数据与文献[6]对照基本一致,因此将化合物4鉴定为Stevensine。
化合物5黄色无定形固体;UV ёmax 272,332 nm; ESI-MS m/z 402,404,406 [M+H]+;1H NMR (600 MHz,DMSO) δH:3.40 (brs,H-8),3.43 (brs,H-9)。以上数据与文献[7]对照基本一致,因此将化合物5鉴定为Spongiacidin A。
化合物6浅黄色油状物;UVёmax 276,215 nm; ESI-MS m/z 386,388,390 [M+H]+;1H NMR (600 MHz,DMSO) δH:12.70 (brs,H-NH),10.43 ( brt,J = 5.6,5.5 Hz,H-NH),8.53(brt,J = 5.0,10.1 Hz,H-NH),7.60 (brs,H-NH2),7.06(s,H-4),6.81 (s,H-15),6.21 (brd,J = 16.3 Hz,H-10),6.12(dd,J = 10.0,15.7,5.0 Hz,H-9),3.93 (brt,J = 5.0,11.3 Hz,H-8); 13C NMR (150 MHz,CD3OD) δC:158.4 (s,C-6),148.2 (s,C-13),128.3 (s,C-5),128.1 (s,C-11),128.0 (s,C-9),117.2( d,C-10),112.4 (s,C-4),111.6 (s,C-15),104.2(s,C-3),39.9 (t,C-8)。以上数据与文献[8]对照基本一致,因此将化合物6鉴定为Oroidin。
化合物7白色粉末;ESI-MS m/z 224,310 [M+H]+;1H NMR (600 MHz,DMSO) δH:6.60 (s,H-3),3.52 (dd,J = 2.5,3.15 Hz,H-8),2.80 (dd,J = 2.53,3.15 Hz,H-9); 13C NMR (150 MHz,CD3OD) δC:194.0 (s,C-10),161.1 (s,C-6),129.3 (s,C-5),124.4 (s,C-4),110.6 (d,C-3),105.2 (s,C-2),43.1 (t,C-9),36.01 (t,C-8)。以上数据与文献[9]对照基本一致,因此将化合物7鉴定为2-bromoaldisine。
化合物8白色粉末;UV ёmax 240,254 nm; ESI-MS m/z 229 [M+H]+;1H NMR (600 MHz,DMSO) δH:12.63 (brs,H-NH),7.82 (t,J = 6.2,6.2 Hz,H-2),7.41 (brt,J =6.9,4.1Hz,H-5),7.11 (s,H-7),6.94 (d,J = 6.9 Hz,H-6),6.34 (d,J = 6.2 Hz,H-3),4.11 (s,H-OCH3),3.80 (s,H-OCH3); 13C NMR (150 MHz,CD3OD) δC:156.7 (s,C-9),149.8 (s,C-3a),142.1 (d,C-2),133.9 (s,C-9a),132.8 (s,C-6a),131.1 (s,C-8),129.7 (d,C-5),116.5 (s,C-9b),112.5 (d,C-6),100.8 (d,C-7),98.0 (d,C-3),60.1 (q,C-OCH3),56.3 (q,C-OCH3)。以上数据与文献[10]对照基本一致,因此将化合物8鉴定为Aaptamine。
化合物9ESI-MS m/z 215 [M+H]+;1H NMR (600 MHz,DMSO) δH:12.62 (brs,H-NH),10.11 (brs,H-OH),7.83(t,J = 6.6,6.7 Hz,H-2),7.26 (brt,J = 5.1,7.2 Hz,H-5),7.12 (s,H-7),6.81 (d,J = 7.2 Hz,H-6),6.34(d,J = 7.1 Hz,H-3),3.93 (s,H-OCH3); 13C NMR (150 MHz,CD3OD) δC:152.1 (s,C-9),151.6 (s,C-8),149.6 (s,C-3a),141.9 (d,C-2),129.3 (d,C-5),128.7 (s,C-9a),127.9 (s,C-6a),116.8 (s,C-9b),112.8 (d,C-6),97.1 (d,C-3),56.2 (q,C-OCH3)。以上数据与文献[11]对照基本一致,因此将化合物9鉴定为demethylaaptamine。
3 结论
笔者对南海海绵Pseudoceratina purpurea的化学成分进行了系统的研究,共从中分离得到9个化合物,分别为hyrtiosin A (1),5-羟基-1H-吲哚-3-羧酸 (2),11-hydroxy-12-(5-hydroxy-1H-indole-3-yl)-ethanone (3),Stevensine (4),Spongiacidin A (5),Oroidin (6),2-bromoaldisine (7),Aaptamine(8),demethylaaptamine (9)。这些化合物均为首次从海绵中分离得到。这些化合物是否有活性、有何种活性,还待进一步研究。
参考文献
[1]彭学东,邓松之,肖定军,等. 南海海绵Pseudoceratina purpurea活性成分的研究Ⅱ[J]. 中国海洋药物,2004(1):11-13.
[2] 吴旭东. 南海海绵 Haliclona cymaeformis 和海绵 Topsentia.sp. 海绵化学成分和生物活性研究[D].青岛:中国海洋大学,2011.
[3] 李云秋,王宾,杨斌,等. 南海海绵Haliclona sp.的化学成分研究[J]. 热带海洋学报,2011,30(1):124-126.
[4] 彭学东,邓松之,肖定军,等. 南海海绵Pseudoceratina purpurea活性成分研究Ⅰ[J]. 广州化学,2003,28(2):1-4.
[5] KOBAYASHI H,OHTA T,NOZOE S,et al. Hytiosins A and B,new indole alkaloids from the Okinawa marine sponge,Hytius erecta[J]. Tetrahedron,1990,46(23):7699-7702.
[6] INABA K,SATO H,TSUDA M,et al.Spongiacidins A D,new bromopyrrole alkaloids from Hymeniacidons sponge[J].JNatProd,1998,61:693-695.
[7] FORENZA S,MINALE L,RICCIO R,et al.New bromo-pyrrole derivatives from the sponge Agelas oroides[J].JChemComm D,1971(18):1129-1130.
[8] SCHMITZ F J,GUNASEKERA S P,TILLEKERATNE L M V.Marine natural products:pyrrolactams from several sponges[J].JNatProd,1985,48(1):47-53.
[9] WALZ A J,SUNDBERG R J.Synthesis of 8-methyl-1-methyl-1H-benzo[de] [1,6]napthyridin-9-ol (Isoaaptamine) and analogues[J].JOrgChem,2000,65 (23):8001-8010.
[10] SUGINO E,CHOSHI T,HIBINO S.Process in total syntheses of marine alkaloids,aaptamines[J]. Heterocycle,1999,50(1):543-557.
[11] NAKAMURA H,KOBAYASHI J,OHIZUMI Y.Isolation and structure of aaptamine a novel heteroaromatic substance possessing á blocking activity from the sea sponge Aaptosaaptos[J]. Tetrahedron Lett,1982,23(52):5555-5558.

