液氨预处理(LAT)促进玉米秸秆的高效酶解糖化
刘建军 ,邵千钧 ,吴 龙 ,晋芳伟
(1.三明学院 机电工程学院,福建 三明 365004;2.机械现代设计制造技术福建省高校工程研究中心,福建 三明 365004;3.福建三明高新技术产业开发区博士后工作站,福建 三明 365004;4.机械工程福建省重点学科,福建 三明 365004;5.绿色铸锻及其高端零部件制造协同创新中心,福建 三明 365004;6.福建省高端铸锻零部件制造工程技术研究中心,福建 三明 365004;7.宁波大学,浙江 宁波,315211)
纤维素乙醇被称为第二代生物燃料技术,它以木质纤维素类生物质为原料,而农作物秸秆是该类生物质的重要来源之一。我国年产秸秆6.98亿t,其中玉米秸秆1.71亿t,约占秸秆总量的1/4[1],目前秸秆的利用率偏低。预处理、酶解、发酵是纤维素乙醇炼制过程中的3个关键技术环节,预处理是克服木质纤维素原料的酶解顽抗性的必要手段[2-3]。预处理方法主要有:酸法、碱法、水热法、蒸汽爆破法和氨纤维爆破法等[4-5]。预处理效果通过酶解率、预处理成本、是否产生毒害酶解或发酵的抑制剂、环境危害等因素来判断。我国学者围绕纤维素乙醇研究对玉米秸秆采用了酸法[6]、碱法[7]、水热法、汽爆法[8]、微波与酸化汽爆[9]等多种预处理方式,进行了预处理和酶解的相关试验研究,纤维素与半纤维素的72 h酶解率分别在80%和60%左右。国外学者围绕玉米秸秆的预处理与酶解糖化的研究更为细致而全面[4-5],并重视预处理过程中的物理化学变化、木质素移除与转化等促进酶解的机理方面的研究[10-12]。
对比预处理研究文献,以氨为介质的预处理方法对于玉米秸秆具有较好的预处理效果。氨是一种价格低廉的碱性原料,其水溶液或纯液氨可用于预处理。氨水预处理主要代表方法是氨回收渗滤法(ammonia recycle percolation,ARP),又可根据处理温度、氨含量与水分不同,细分为 ARP法[13]、SAA 法(soaking in aqueous ammonia)[14]和 LMAA 法(low-moisture anhydrous ammonia)[15]等,但它的处理周期长,如ARP法长达10~60 d。液氨主要用于氨爆法或氨纤维膨胀法(ammonia fiber expansion,AFEX),处理后的玉米秸秆在添加纤维素酶15 FPU/(g葡聚糖)时168 h的葡聚糖和木聚糖的酶解率达到95%和80%以上[16],酶解效果非常好。
本研究在AFEX的基础上提出了LAT法,采用液氨加温处理,预处理温度范围加大,但不采用快速释放氨气的爆破法。AFEX过程基本上不产生酶解与发酵抑制剂和环境危害物[16],本实验与之相近。因此对LAT预处理后玉米秸秆的酶解效果与酸、碱、热水、汽爆、AFEX等预处理方法进行了对比。
1 实验材料与方法
1.1 材料
玉米秸秆(糯玉米)采自福建省三明市(东经117.35°、北纬26.13°),采收期为7月份(播种至青穗采收约65 d)。实验采用地上部分的整株植物,将其切割成约1~2 cm长条状,初晒后经40℃烘干至含水率低于15%,用FZ102微型植物粉碎机粉碎成50~100目粉末。经混合均匀后采用水分分析仪MA35(赛多利斯)测得其含水率,并用塑料袋密封后置-20℃冰箱中存放备用。
用于高效液相色谱(HPLC)分析的对照品的葡萄糖、木糖等均采购自Sigma-Aldrich公司,纯度为99%以上;预处理用的氨采购自杭州龙山化工有限公司。
添加的水解酶为纤维素酶 (novozyme NS50013)、β-葡萄糖苷酶 (novozyme NS50010),由诺维信(中国)有限公司提供。NS50013纤维素酶的活性由滤纸法测定,它是一种混合酶,具有木聚糖酶活性,故实验中未添加木聚糖酶。
1.2 方法
实验分析方法参照了美国国家可再生能源实验室(National Renewable Energy Laboratory,NREL)制定的实验规程(Laboratory Analytical Procedure,LAP)[17],并减少了酶制剂的添加量(由60 FPU/(g葡聚糖)改为15 FPU/(g葡聚糖)),加大了反应容量(由原规程中的10 mL增加为15 mL)。
1.2.1 组分测定
玉米秸秆中碳水化合物和酸不溶性木质素(Klason木质素)采用酸水解法测定,碳水化合物组分由LAP002方法测定,酸不溶性木质素由LAP003方法测定。LAP002和LAP003采用二步酸解法,在一次实验中完成。
酸水解的具体步骤是先用分析天平称量已知含水率并去除抽提物的秸秆原料约0.3 g,加入72%硫酸3 mL,在30℃水浴中保持2 h,加去离子水84 mL(稀释至4%硫酸),放入灭菌锅中121℃保持1 h。经真空过滤后将滤纸上的固形物烘干至恒重,用HPLC法(色谱分析柱采用BioRad醇酸柱HPX-87H)测定各种单糖的含量,并折算成葡聚糖(纤维素)、木聚糖、阿拉伯聚糖等比例,由滤纸上的固形物质量与灰分测定来确定不溶性木质素含量。
灰分测定采用LAP005规程,用分析天平称量1 g左右已知含水率的原料,将其放入已测定质量的有盖陶瓷坩锅中,置入箱式电阻炉中程序缓慢升温,约2 h后升至575℃,保持此温度4 h以上。冷至105℃时将坩锅取出放入干燥器,冷却后称量质量并计算灰分。
1.2.2 液氨预处理(LAT法)
LAT法预处理:根据原料确定反应用量,将确定量的液氨注入移液钢瓶(300 mL),并加热小钢瓶至50℃左右;将待处理的已知含水率的原料放置在反应器(改装的高压反应釜,大连自控设备厂)中,并将反应器抽成真空;然后将氨注入反应器,加热反应器到预定温度;在预定温度下驻留一定的时间,而后氨被释放(约30 s),即预处理过程完成。取出处理原料置于通风柜中让处理后原料中的氨逸出,然后在烘箱中低于40℃干燥。称重并测得含水率,计算预处理后生物质原料得率,将处理后的原料放入-20℃冰箱冷藏备用。
LAT预处理优化的工艺参数选择分别为:预处理的温度、含水率、驻留时间等,另外氨用量也可以作为参数供优化。
1.2.3 酶水解
酶水解参照LAP009的相关规程进行,酶解液总量为15 mL,每组样品酶解至少做一组重复。根据规程,酶解采用1%葡聚糖当量,即称取0.15 g葡聚糖当量的秸秆放入酶解瓶(20 mL样品瓶),依次加入蒸馏水、柠檬酸钠缓冲溶液(平衡后pH值为4.8)、抗生素(四环素和环己酰亚胺),经预混合1h后添加纤维素酶、β-葡萄糖苷酶。每克葡聚糖当量的生物质原料中添加纤维素酶15 FPU/(g葡聚糖)、β-葡萄糖苷酶64 pNPGU/(g葡聚糖)。酶解条件是温度设定为50℃,摇床转速为150 r·min-1。酶解取样时间分别为24、72 h。
酶解取样1 mL放入离心管,放置加热器(设置温度99℃)中加热20 min,使酶蛋白变性失效,放入-20℃冰箱冷却5 min,再放入离心机(艾本德 5424,设置转速 14500 r·min-1)离心 5 min,经 0.22 μm一次性针头过滤器过滤(聚醚砜膜)后转入HPLC分析瓶,放入4℃或-20℃冰箱冷藏待分析。
1.2.4 单糖的测定
酸解或酶解液中糖的定量分析用HPLC法,设备为带示差检测器的Agilent Technologies 1200系列色谱仪。采用BioRad公司的HPX-87H色谱柱(该色谱柱可适用于中性或酸性溶液),流动相为0.005 mol·L-1稀硫酸,流速为 0.60 mL·min-1,柱温为 50 ℃。
1.2.5 酶解率计算
酶解转化率(酶解率)为实际获得单糖含量与理论最高可得单糖含量之比,而理论最高可得单糖根据原料中经组分分析(二步酸解法,LAP002)的聚糖含量进行折算。以葡聚糖的酶解率为例,其计算公式是:

酶解率d为百分数,式中分子为酶解所获得葡萄糖含量折算成葡聚糖的量,其中g为酶解液中葡萄糖的含量 (单位为g/L),15为酶解液的体积,162/180为化学式中葡萄糖因聚合失去一个水分子的比例;分母为理论上加入的葡聚糖量,b为加入的原料干基质量,c为组分分析(酸解法)葡聚糖含量。
2 结果与讨论
2.1 原料成分分析
原材料的组分如表1所示,碳水化合物和木质素含量通过二步酸解法分析获得,灰分通过箱式电阻炉加热分析获得。秸秆中葡聚糖(纤维素)和木聚糖的含量合计为56.21%,这是理论上可以转化为单糖的聚糖主要来源。
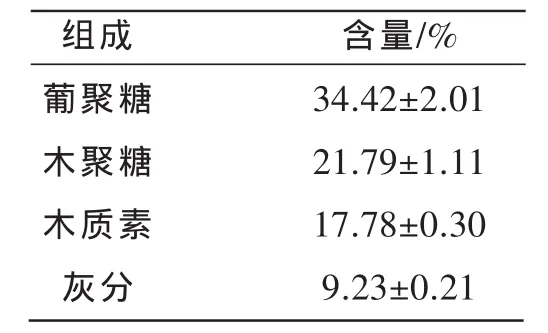
表1 玉米秸秆的组分分析(干基)
2.2 预处理温度对酶解效果的影响
预处理温度对酶解率的影响如图1所示,横坐标为预处理温度,即预处理加热到此温度下并保留一定时间的温度(实验过程中温度波动范围为±5℃);葡聚糖/木聚糖的转化率用柱状图表示(左侧纵坐标),每千克干基秸秆原料获得的单糖量为点线图(右侧纵坐标)。本实验固定液氨与原材料(干基)质量比为1∶1,其他预处理条件预设为含水率60%、预处理驻留时间为5 min。在70℃~130℃范围内,葡聚糖酶解率的总体变化趋势是随着温度升高而增加,在90℃后,提升更趋缓慢;木聚糖酶解率在90℃有较大值,110℃有所下降,130℃又有提升。单糖总体得率随着温度升温而略有上升,90℃时葡聚糖和木聚糖的转化率分别为86.0%和79.2%,每千克干基秸秆可得单糖524.7 g,转化率约为理论最高转化率的83.3%;130℃时葡聚糖和木聚糖的转化率分别为91.8%和82.1%,可得单糖554.4 g,转化率约为理论量高转化率的88.0%。
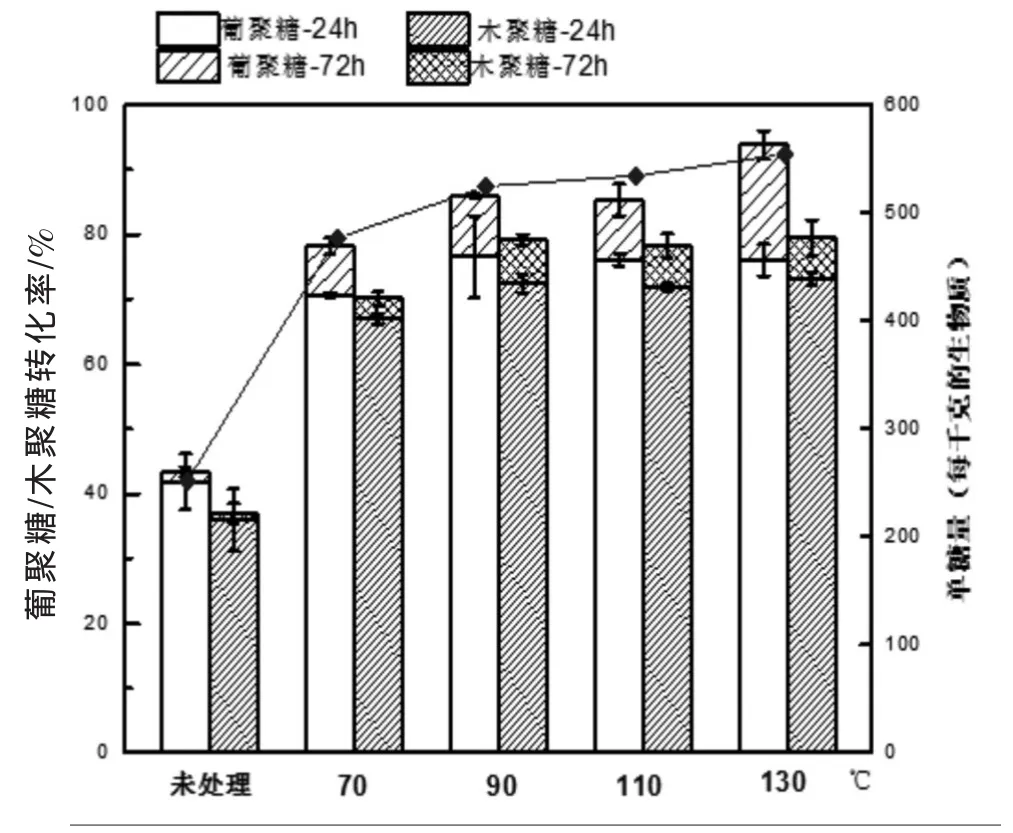
图1 LAT预处理温度对玉米秸秆葡聚糖和木聚糖的酶解率的影响
LAT预处理的优化温度略高于AFEX预处理,AFEX预处理用于玉米秸秆的优化温度为90℃[16],而LAT预处理在90~130℃均具有较好的效果。LAT预处理后的酶解率与AFEX相当,AFEX在优化条件下,添加纤维素酶15 FPU/(g葡聚糖)的72 h葡聚糖和木聚糖的酶解率分别为接近90%和70%[18],本研究中的130℃预处理后的酶解效果优于AFEX。
2.3 预处理含水率对酶解效果的影响
预处理含水率是指预处理前物料的含水率,采用的是水分与干基物料的比例(此处为干基水分含水率),含水率对玉米秸秆葡聚糖和木聚糖的酶解率的影响如图2所示。实验中含水率分别采用20%、40%、60%、80%,其他反应条件为90℃、氨与秸秆质量比为1∶1,反应时间为5 min。在实验区间范围内,含水率在60%时具有最高的转化率,此时葡聚糖和木聚糖72 h酶解率分别为85.97%和79.15%,每千克秸秆可得单糖524.7 g。
预处理前含水率的变化对酶解效果的影响与AFEX用于玉米秸秆的情形相近,为60%[18];但与芒草等作物存在差异,芒在AFEX中最佳含水率出现在80%和200%[19],LAT法在其他类生物质原料中的应用有待进一步研究。
2.4 预处理驻留时间对酶解效果的影响
LAT预处理驻留时间对酶解效果的影响如图3所示,实验驻留时间分别为3、5、10 min,其他条件为90℃、含水率60%、氨与原料比为1∶1。葡聚糖和木聚糖的转化率在驻留时间3~10 min范围内,转化率呈先上升后下降的趋势,在驻留时间为5 min时达到峰值。随着预处理时间加长,可能是聚糖或单糖分解导致酶解率下降,其原因待进一步分析。

图2 预处理含水率对玉米秸秆葡聚糖和木聚糖的酶解率的影响
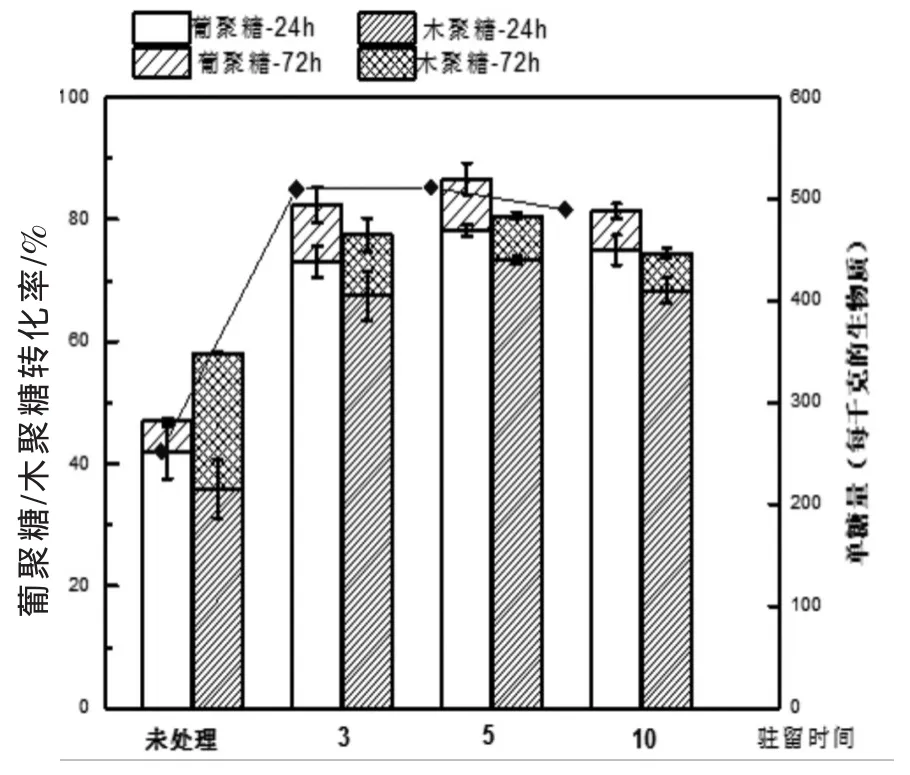
图3 预处理驻留时间对玉米秸秆葡聚糖和木聚糖的酶解率的影响
2.5 质量平衡
预处理与酶解的质量平衡流程图如图4所示。采用的预处理条件为:预处理温度130℃、含水率60%、驻留时间为5 min、液氨与生物质比例为1∶1,纤维素酶添加量为15 FPU/(g葡聚糖),72 h葡聚糖和木聚糖的酶解率分别为91.8%和82.1%,1000 g干基玉米秸秆经预处理后固体得率为95.35%,72 h酶解后可获得单糖524.3 g(仅计算葡萄糖和木糖),而未作预处理的单糖获得量为228.3 g,预处理后单糖得率是未处理原料的2.1倍。从质量分析中可以看出,木糖在酶解转化中占了相当大的比例,约占总糖量的36%。如何使木糖在预处理过程中不被降解,并且在后续发酵过程中充分转化为乙醇(采用基因工程改造的菌种),这在纤维素乙醇研究中非常重要。同时,质量平衡在预处理方法对比过程中非常重要[20],也值得研究者充分关注。

图4 玉米秸秆LAT预处理与酶解过程质量平衡流程图
2.6 预处理效果比较
国外学者采用氨水预处理的ARP法和SAA(法,葡聚糖的15 FPU/(g葡聚糖)、72 h的酶解率分别为88.5%[13]和92.5%[14],LMAA法乙醇的理论得率为90%[15]。AFEX法预处理用于玉米秸秆的酶解率比较高,一般在90%左右[16,18]。LAT和AFEX法由于采用的是液氨,未参与反应的氨可以再利用或回收,有利于降低成本和环境保护。
不同的预处理方法用于玉米秸秆,酶解效果存在较大的差异。如酸预处理,采用乳酸或乙酸及混合预处理,这3种方法的葡聚糖的转化率为83.92%~94.28%,木聚糖的转化率58.78%~81.08%[21];玉米秸秆经1%稀硫酸溶液浸润后经121℃处理60 min,72 h后原料的酶解率为62.5%(纤维素酶添加量6 FPU/(g葡聚糖))[6]。如碱预处理,预处理条件为1.5%NaOH,80℃下反应1 h时,48 h纤维素酶解率71.29%,半纤维素酶解率78.85%,总糖得率比未处理样品提高46.66%[7]。水热法预处理后48 h酶解率为63.13%[8];汽爆预处理后纤维素与半纤维素酶解率分别为81.5%和55.3%(纤维素酶添加量为10 FPU/(g葡聚糖),144 h酶解)[22];采用微波和酸化汽爆的优化条件下预处理,在添加纤维素酶12 FPU/(g葡聚糖)时,葡聚糖的转化率分别为47.5%和62.5%[9]。LAT预处理在优化条件下,葡聚糖与木聚糖的酶解率分别为91.8%和82.1%,与酸、碱、热水、汽爆等预处理方式相比,酶解率相对较高。
3 结论
通过对玉米秸秆的LAT预处理和酶解糖化过程的实验研究,有如下结论:
(1)LAT预处理能显著提高玉米秸秆原料的酶解率,预处理原料经酶解后的单糖产量是未经预处理的2.1倍,LAT法预处理后的酶解率和单糖得率高于酸、碱、水热和汽爆法等。
(2)LAT法预处理的优化条件是预处理温度为90~130℃、含水率为60%(干基)、预处理驻留时间为5 min。在此优化条件下(130℃),在纤维素酶添加量为15 FPU/(g葡聚糖)时,玉米秸秆中的葡聚糖和木聚糖72 h酶解率分别为91.8%和82.1%,每kg干基秸秆可得单糖524.3 g。
(3)温度、含水率和驻留时间都对预处理的效果有影响,而温度的影响为最大。
[1]朱建春,李荣华,杨香云,等.近30年来中国农作物秸秆资源量的时空分布[J].西北农林科技大学学报:自然科学版,2012,40:139-146.
[2]HIMMEL ME, DING S Y, JOHNSON D K, et al.Biomass recalcitrance: engineering plants and enzymes for biofuels production[J].Science, 2007, 315: 804-807.
[3]崔美,黄仁亮,苏荣欣,等.木质纤维素新型预处理与顽抗特性[J].化工学报, 2012, 63: 677-687.
[4]Mosier N,Wyman C,Dale B,et al.Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresour Technol, 2005, 96: 673-686.
[5]GEDDES C C,NIEVES I U,INGRAM L O.Advances in ethanol production [J].Curr Opin Biotechnol,2011,22:312-319
[6]宋安东,任天宝,张玲玲,等.玉米秸秆分批补料获得高还原糖浓度酶解液的条件优化[J].生物工程学报,2011,27:393-397.
[7]欧阳嘉,李鑫,董郑伟,等.碱法-酶法处理玉米秸秆的制糖工艺研究[J].南京林业大学学报:自然科学版,2010,34:1-5.
[8]杜金峰,张万忠,王云山,等.不同预处理方法对玉米秸秆酶解和乙醇发酵的影响[J].沈阳农业大学学报,2011,42:195-199.
[9]李冬梅.玉米秸秆为原料燃料乙醇制备的关键问题研究[D].哈尔滨:哈尔滨工业大学,2008.
[10]LI C,CHENG G,BALAN V,et al.Influence of physico-chemical changes on enzymatic digestibility of ionic liquid and AFEX pretreated corn stover[J].Bioresour Technol,2011,102: 6928-6936.
[11]KUMAR R MAGO G,BALAN V,et al.Physical and chemical characterizations of corn stover and poplar solids resulting from leading pretreatment technologies[J].Bioresour Technol,2009,100:3948-3962.
[12]PU Y,CAO S,RAGAUSKAS A J.Application of quantitative 31P NMR in biomass lignin and biofuel precursorscharacterization[J].Energy & Environmental Science,2011,4:3154-3165.
[13]KIM T H,LEE Y Y.Pretreatment and fractionation of corn stover by ammonia recycle percolation process[J].Bioresour Technol,2005,96:2007-2013.
[14]KIM T H,LEE Y Y.Pretreatment of corn stover by soaking in aqueous ammonia[J].Applied Biochemistry and Biotechnolog,2005,121:1119-1132.
[15]YOO C G,NGHIEM N P,HICKS K B,et al.Pretreatment of corn stover using low-moisture anhydrous ammonia(LMAA) process[J].Bioresour Technol,2011,102:10028-10034.
[16]TEYMOURI F,LAUREANO -PEREZ L,ALIZADEH H,et al.Optimization of the ammonia fiber explosion(AFEX) treatment parameters for enzymatic hydrolysis of corn stover[J].Bioresour Technol,2005,96:2014-2018.
[17]NREL (National Renewable Energy Laboratory).Standard Biomass Analytical Procedures (LAPs)[EB /OL].http: //www.nrel.gov /biomass/analytical_procedures.html.
[18]TEYMOURI F,LAUREANO-PEREZ L,ALIZADEH H,et al.Ammonia fiber explosion treatment of corn stover [J].Applied Biochemistry and Biotechnology,2004,113:951-963.
[19]MURNEN H K,BALAN V,CHUNDAWAT S P,et al.Optimization of ammonia fiber expansion (AFEX) pretreatment and enzymatic hydrolysis of Miscanthus x giganteus to fermentable sugars[J].Biotechnol Prog,2007,23:846-850.
[20]GARLOCK R J,BALAN V,DALE B E,et al.Comparative material balances around pretreatment technologies for the conversion of switchgrass to soluble sugars[J].Bioresour Technol,2011,102:11063-11071.
[21]XU J,THOMSEN MH,THOMSEN A B.Enzymatic hydrolysis and fermentability of corn stoverpretreated by lactic acid and /or acetic acid[J].Journal of biotechnology, 2009, 139: 300-305.
[22]钟健,杨敬,钞亚鹏,等.高效协同酶解中性汽爆玉米秸秆的工艺优化[J].化工学报,2011(10):2867-2875.

