茯苓对脾虚水湿内停大鼠的健脾利水药效物质研究
李 斌 冉小库 孙云超 窦德强
(辽宁中医药大学药学院,大连,116600)
茯苓对脾虚水湿内停大鼠的健脾利水药效物质研究
李 斌 冉小库 孙云超 窦德强
(辽宁中医药大学药学院,大连,116600)
目的:研究茯苓对脾虚水湿内停大鼠健脾利水的药效物质,并探讨其可能的作用机制。方法:采用优化后的饮食不节结合劳倦过度法,造成动物脾虚模型,进而腹腔水负荷生理盐水建立脾虚水湿内停模型。以肛温、体重、表观指标及尿液中D-木糖排出量作为大鼠脾虚造模期的评价指标。以粪便含水率、血清总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、水通道蛋白1、胃泌素(GAS)及腹腔水负荷造成水湿內停后的大鼠体重下降率及尿量等指标,阐明茯苓健脾利水的有效组分。结果:造模期间,大鼠体重下降,而肛温无变化,故表明动物已造成脾虚。经筛选后确定茯苓对脾虚水湿内停大鼠健脾利水作用的最低有效剂量为7.5 g/kg。茯苓水煎液、乙酸乙酯组分和多糖组分能显著提高脾虚后大鼠体重。除醇洗组分外茯苓其他拆分组分能显著提高大鼠血清白蛋白水平。多糖组分能降低肾髓中水通道蛋白1的水平。茯苓乙酸乙酯组分和多糖组分能有效提高血清胃泌素水平。茯苓乙酸乙酯组分能有效提高大鼠水负荷后体重下降率,且增加尿量。结论:茯苓对脾虚水湿内停动物利水作用主要通过其利尿作用来实现。茯苓乙酸乙酯组分、石油醚组分及多糖组分应为其健脾的物质基础,乙酸乙酯组分也为其利尿的物质基础。因此,以三萜类为主要成分的乙酸乙酯组分和茯苓多糖可能为其“甘”味物质基础,乙酸乙酯组分可能也为其淡味的物质基础。
脾虚;水湿内停;茯苓;利尿;利水
中医认为,“脾为后天之本,气血生化之源”。脾主运化,能有效调节全身各脏腑气血津液精的代谢,是后天维持人体生命活动的根本。脾虚证,为脾之气血阴阳不足,运化摄纳功能失职所致的证候,是多种证候的统称。邹澍《本草经疏》归纳“脾虚十二证,饮食劳倦,伤脾发热,饮食不消化,属脾气虚;伤食必恶食,停食,为恣饮汤水或冷茶、冷酒所致。水肿属脾气虚,兼脾阴虚;噎膈属气血两虚,由于血液衰少,而非痰气壅逆所成”。中医临床中,脾虚证为较为常见的病症,主要表现为消化和吸收功能障碍,会产生食少纳呆、腹泻、消瘦、乏力等症状,导致机体抵抗力下降,全身免疫功能失调。脾居中焦,为津液升降输布的枢纽。若脾主运化功能失调,可导致水湿内停;过量运动后,阳气不足,不能固护肌表,玄府不密,津液外泄,异常出汗[1]。
研究基于本973课题负责人匡氏提出的“中药一味一性,一药X味Y性(Y≤X)。”为核心内容的中药性味科学内涵假说进行设计。这个假说可进一步解释为“药味主要与药物的具体功效相关,药性(气)是药物通过不同途径以主要影响机体的能量代谢、物质代谢为特征的、与治疗作用有关或无关的、但均可影响药物治疗作用的发挥或与副作用发生有关的一类生物学效应。并且中药的性味是可拆分和可组合的”。本研究基于这一假说,通过茯苓对脾虚动物健脾和利水的影响阐明茯苓之“甘、淡”两味可能的物质基础。
茯苓为多孔菌科植物真菌茯苓Poriacocos(Schw.)Wolf的干燥菌核,性平,味甘、淡。主要功效为利水渗湿,健脾,宁心[2]。用于水肿尿少,痰饮悸眩,脾虚食少,便溏泄泻,心神不安,惊悸失眠。为临床常用利水药。尽管茯苓作为传统常用中药,但其药味却鲜有研究。按照上述假说,前期首先对茯苓的水煎液进行组分拆分,并对各组分化学成分交叉性进行分析[3],表明各组分之间差异度大于85%。进一步对拆分组分的化学成分进行表征,表明茯苓石油醚组分(PEF)、主要为单萜和倍半萜,乙酸乙酯组分(EAF)主要为三萜,树脂水洗组分(AEF)主要为小分子糖,树脂醇洗组分(AEF)主要为吲哚乙醇及氨基酸和多糖组分(CEF)主要为大分子组成的多糖。本研究以脾虚水湿内停大鼠为研究对象,对茯苓利水功效药效组分进行研究,并初步探讨了药效组分的可能作用机制,为其性味组分归属奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 动物 清洁级SD大鼠,体重180~220 g,雄性,6~8周龄,由辽宁长生生物技术有限公司提供,合格证号:SCXK(辽)2010-0001。
1.1.2 药物与试剂 肥猪肉(购于大商新玛特超市);甘蓝(购于大商新玛特超市);氢氯噻嗪片(山西云鹏制药有限公司;批号A130702);生理盐水(吉林省都邦药业股份有限公司,批号1405180511);考马斯亮蓝(南京建成生物工程研究所,批号20140820);白蛋白测试盒(南京建成生物工程研究所,批号20140805);总胆固醇试剂盒(南京建成生物工程研究所,批号20130116);高密度脂蛋白测试盒(南京建成生物工程研究所,批号20130718);低密度值蛋白测试盒(南京建成生物工程研究所,批号20130723);D-木糖试剂盒(南京建成生物工程研究所,批号20140827);D-木糖(国药集团化学试剂有限公司,批号20131121);水通道蛋白1 Elisa测试盒(北京诚林生物科技有限公司,批号:201408);GAS Elisa测试盒(北京诚林生物科技有限公司,批号:201410)。
1.1.3 实验仪器 FA-1004电子天平(上海精科天平厂);KQ-250DE型超声波清洗器(昆山市超声仪器有限公司);TDZ4-WS低速台式离心机(长沙湘仪离心机仪器有限公司);UV-2100紫外分光光度计(上海UNICO公司);HH-S型电热恒温水浴锅(巩义市予华仪器有限公司);SUNRISE型酶标仪(瑞士TECAN公司)。
1.1.4 主要试剂配制 1)肥猪油的制备:将肥猪肉切成小块后,放置于100 ℃的纯净水中蒸煮,不断翻炒,至猪油炼出,放凉后,于-20 ℃冰箱中保存。使用时取出,加热使之溶解。
2)茯苓水煎液制备:称取茯苓生药450 g,10倍量水充分浸泡1 h,煎煮2 h,过滤,加10倍量水煎煮1 h,过滤,趁热抽虑,浓缩为3.0 g/mL的茯苓水煎液,4 ℃保存备用。
3)茯苓各拆分组分的配制:茯苓拆分组分制备见文献[3]。取茯苓各拆分组分冻干粉末适量,加入0.5%CMC-Na溶解。各组分收率如表1所示。
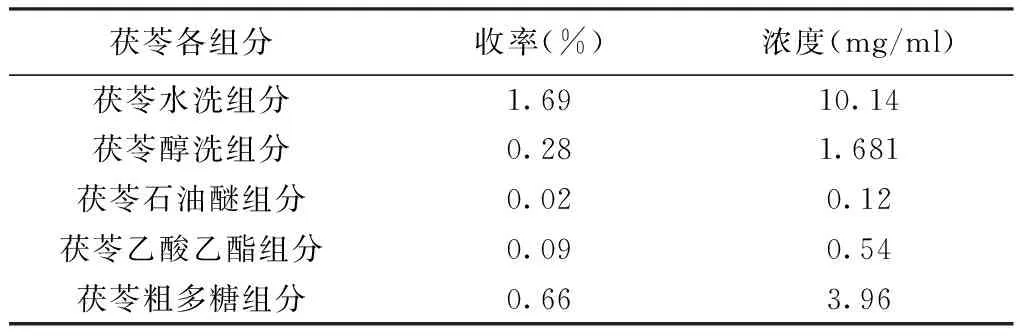
表1 茯苓各组分收率及给药溶液浓度
1.2 实验方法
1.2.1 脾虚模型大鼠制备 脾虚模型参照文献[4]。单日喂食甘蓝,双日灌胃猪油1.5 mL/100 g。每日游泳造成力竭,大鼠口鼻没入水中,四肢及尾巴摆动缓慢,口鼻一次性冒泡5个为止。正常组正常喂食,不游泳。模型组每只大鼠给予4 g/只鼠粮。
1.2.2 分组及给药
1.2.2.1 茯苓水煎液不同剂量实验 随机选取10只正常大鼠作为正常组,随机造模动物60只,按照文献[5]经表观指标评价选取合格动物,分为5组,每组10只,分别为模型组、利水阳性药组、茯苓低、中、高剂量组。正常组大鼠每天给予10 g/只鼠粮,其余各组大鼠每天给予4 g/只鼠粮,并不再喂食甘蓝和猪油,以维持模型动物症状的稳定性。正常组:灌胃给纯净水1 mL/100 g;模型组:灌胃给纯净水1 mL/100 g;利水阳性药组:灌胃剂量为1 mg/100 g氢氯噻嗪;茯苓水煎液低剂量组:灌胃剂量为1.5 g/kg生药;茯苓水煎液中剂量组:灌胃剂量为7.5 g/kg生药;茯苓水煎液高剂量组:灌胃剂量为15 g/kg生药。以上各组均每天给药1次,1 mL/100 g,连续7d。
1.2.2.2 茯苓拆分组分实验 随机选取10只正常大鼠作为正常组,随机造模动物90只,同上选取合格动物,分为8组,每组10只,分别为模型组、利水阳性药组、茯苓各拆分组分组。正常组:灌胃给纯净水1 mL/100 g;模型组:灌胃给纯净水1 mL/100 g;利水阳性药组:灌胃剂量为1 mg/100 g氢氯噻嗪;茯苓水煎液组:灌胃剂量为7.5 g/kg生药;茯苓水洗组分组:灌胃剂量为0.1268 g/kg;茯苓醇洗组分组:灌胃剂量为0.021 g/kg;茯苓石油醚组分组:灌胃剂量为0.0015 g/kg;茯苓乙酸乙酯组分组:灌胃剂量为0.00675 g/kg;茯苓多糖组分组:灌胃剂量为0.0495 g/kg。以上各组均每天给药1次,1 mL/100 g,连续7d。
1.2.3 检测指标
1.2.3.1 造模期间指标 造模期间,第1、4、7、10、14天对大鼠测定体重及肛温。
1.2.3.2 给药后测定指标 1)称定给药前后大鼠体重。
2)尿d-木糖排出量检测。禁食12 h后用3%D-木糖灌胃,2 mL/100 g,收集5 h尿液,然后按D-木糖试剂盒说明书进行测试[6]。
3)测定粪便含水率。参照文献的方法,收集大鼠粪便后,于80 ℃烘箱内干燥24 h,取出放凉,测干质量。测定后,放入80 ℃烘箱内干燥1 h,取出称重。两次重量差值不大于3 mg,即认为重量恒定[7]。
粪便含水率(%)=(湿质量-干质量)/湿质量×100%
4)水负荷实验。各组大鼠禁食12 h,称量体重,作为正常对照值,然后每只大鼠腹腔注射10%体重的生理盐水,水负荷后分别称量0时、1时、2时、4时、6时体重及6 h尿量,期间禁食、禁水。计算每个时间点体重下降值。并同时测定排尿量[8]。
5)血生化指标检测。各组大鼠不禁水禁食12 h,动物眼静脉丛取血,3000 r/min,离心15 min,吸取上清,按试剂盒说明书进行测试,测定总蛋白,白蛋白,总胆固醇,HDL-C,LDL-C。
6)AQP1检测。肾髓制备组织匀浆,按照1:9加入PBS,于组织匀浆机制作匀浆,3000 r/min离心20 min,吸取上清液,-20 ℃保存,待测AQP1,按照试剂盒说明书操作步骤测定肾髓水通道蛋白1。
7)血清GAS测定。各组大鼠禁食不禁水12 h,动物眼静脉丛取血,3000 r/min,离心15 min,吸取上清,测定血清GAS。按照试剂盒说明书操作步骤测定。
1.3 统计学方法 采用SPSS 19.0统计软件,计量资料用均数±标准差表示,单因素方差分析进行比较。检测同时满足正态性和方差齐性,用LSD检验;检测不同时满足正态性和方差齐性,用Dunnett T3检验。除特殊说明,均采用LSD检验。
2 结果
2.1 不同剂量组测定指标
2.1.1 造模期间模型体重及肛温的测定 造模第1天模型组与正常组体重无明显差异,造模第4天时模型组体重明显下降,随着造模时间的延长模型组大鼠体重显著降低,第4、7、10、14天大鼠体重均与正常组有统计学意义(P<0.01);但在造模期间大鼠的肛温无明显变化(见图1及图2)。
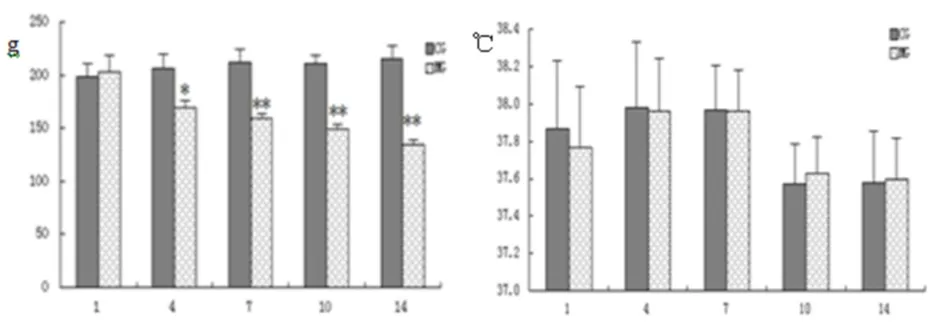
图1 造模期间体重变化(g) 图2造模期间肛温变化(℃)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01(CG空白组;MG模型组)
2.1.2 总体体征的变化 模型组大鼠从第3天开始,游泳耐力下降,表现出逐渐消瘦,粪便时干时软,偶尔便溏,后期食量摄入量减少,饮水量减少。表现出消瘦,懒动,倦怠,蜷缩聚堆,眯眼及弓背等。
2.1.3 给药前后体重变化 给药前、给药后各组大鼠体重均极显著低于正常组(P<0.01),与模型组相比较,给药后大鼠体重,茯苓低、高剂量组、阳性药组有统计学意义(P<0.01),茯苓中剂量组有统计学意义(P<0.05),与空白组相比,给药前、给药后各组大鼠体重均极显著低于空白组(P<0.01),给药后茯苓各剂量组和阳性药组大鼠体重变化不大。(见图3)。

图3 各组大鼠给药前后体重测定(g)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.1.4 尿中D-木糖排出量测定 D-木糖的吸收代谢情况是可以反映机体胃肠吸收排泄功能的强弱,D-木糖含量的降低是评判脾虚的重要指标。与正常组相比,各组大鼠尿液中排出D-木糖含量较低,有统计学意义(P<0.01)。与模型组相比,茯苓各给药组略有升高。(见图4)。
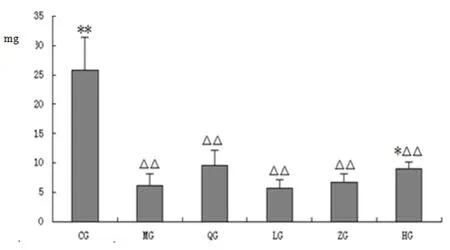
图4 各组大鼠尿D-木糖排出量测定(mg)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.1.5 粪便含水率测定 粪便含水率与正常组相比,模型组、茯苓中剂量组、茯苓高剂量组、阳性药组有统计学意义(P<0.01)。与模型组相比,阳性药组有统计学意义(P<0.01)。(见图5)。
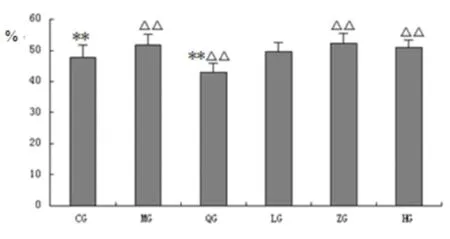
图5 各组大鼠粪便含水率测定(%)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.1.6 水负荷实验测定 给予生理盐水负荷后,模型组的水液代谢能力明显低于正常组(P<0.01),茯苓各剂量组较模型组均有统计学意义(P<0.01)。茯苓在2 h后呈现出较强的代谢能力。(见表2及表3)。
大鼠在0~2 h排尿量,与正常组相比,模型组、茯苓低、高剂量组有均有统计学意义(P<0.01),与模型组相比,茯苓中剂量组,阳性药组有统计学意义(P<0.01);大鼠在2~4 h排尿量,与正常组相比,模型组有统计学意义(P<0.01),茯苓低、高剂量组有统计学意义(P<0.05),与模型组相比,茯苓低、高剂量组、阳性药组有统计学意义(P<0.01);大鼠在4~6 h排尿量,与正常组相比,模型组、茯苓低剂量组有均有统计学意义(P<0.01),茯苓中、高剂量组有统计学意义(P<0.05);6 h总共的尿量,与正常组相比,模型组、茯苓各剂量组有均有统计学意义(P<0.01),与模型组相比,茯苓中剂量组、阳性药组有统计学意义(P<0.01),茯苓低、高剂量组有统计学意义(P<0.05)。(见图6)。
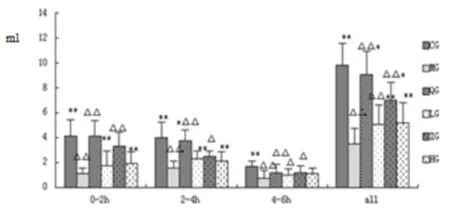
图6 各组大鼠排尿量测定(mL)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.1.7 血生化指标检测 生化指标可反应出机体对营养物质的吸收利用情况。总蛋白降低常见于营养及吸收障碍,白蛋白更是作为临床诊断水肿的重要指标,白蛋白降低是水肿发生的直接指标。总胆固醇其血清浓度可作为脂代谢的指标,总胆固醇增高会诱发机体发生各种疾病。高密度脂蛋白(HDL)和低密度脂蛋白(LDL)都属于载脂蛋白,是血脂在血液内转运的一种形式,高密度脂蛋白(HDL)的功能是逆向转运胆固醇,是将脂类由外周转运至肝脏分解代谢。低密度脂蛋白(LDL)的功能是转运内源性胆固醇,是将脂类由肝脏向外周转运。总蛋白含量空白组高于其他各组,与空白组相比,模型组、茯苓低、高剂量组有统计学意义(P<0.01);与模型组相比茯苓各剂量组、阳性药组有统计学意义(P<0.01)。白蛋白含量,与空白组相比,模型组、阳性药组、茯苓低剂量组有统计学意义(P<0.01);与模型组比,各组均有统计学意义(P<0.01)。总胆固醇和LDL-C含量,与空白组比,茯苓高剂量组有统计学意义(P<0.01);与模型组相比,茯苓各剂量组和阳性药组有统计学意义(P<0.01)。HDL-C含量,与空白组相比模型组有统计学意义(P<0.01),茯苓高剂量组有统计学意义(P<0.05);与模型组相比,茯苓各剂量组和阳性药组有统计学意义(P<0.01)。(见图7)。

图7 各组大鼠血生化指标测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.1.8 肾髓水通道蛋白1水平测定 AQP1主要表达于肾近曲小管和亨利袢降支的顶质膜与侧膜上,主要参与原尿中水分的重吸收。体外实验表明,AQP1降低导致近曲小管和亨利袢降支细段的渗透性及重吸收能力降低,逆流倍增系统遭破坏,表现为多尿。因此,AQP1水平升高的大鼠可出现尿液浓缩功能增强,表现为少尿。与正常相比,茯苓低、中剂量组、阳性药组有统计学意义(P<0.01),模型组、茯苓高剂量组有统计学意义(P<0.05)(见图8)。
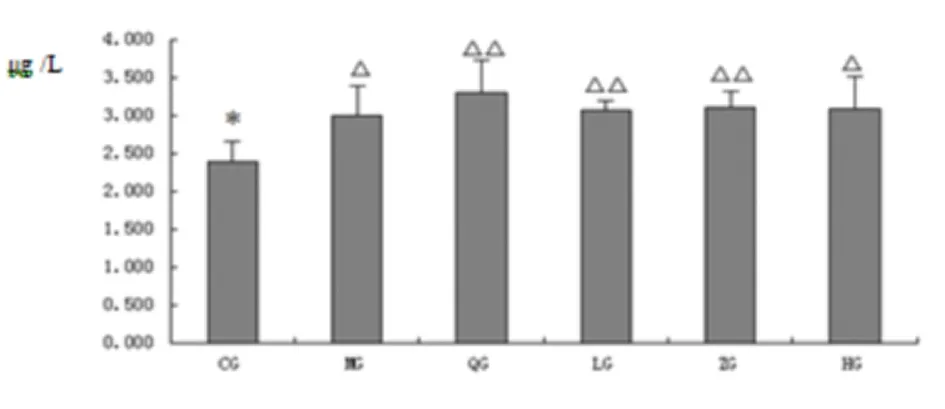
图8 各组大鼠肾髓中水通道蛋白1水平测定(μg/L)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;LG茯苓低剂量组;ZG茯苓中剂量组;HG茯苓高剂量组)
2.2 拆分组分组测定指标
2.2.1 拆分组分组模型体重及肛温的测定 造模第1天模型组与正常组体重无明显差异,造模第4天时模型组体重明显下降,随着造模时间的延长模型组大鼠体重显著降低,第4、7、10、14天大鼠体重均与正常组有统计学意义(P<0.01);但在造模期间大鼠的肛温无明显变化(见图9及图10)。
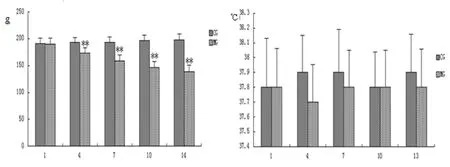
图9 造模期间体重变化(g) 图10 造模期间肛温变化(℃)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01(CG空白组;MG模型组)
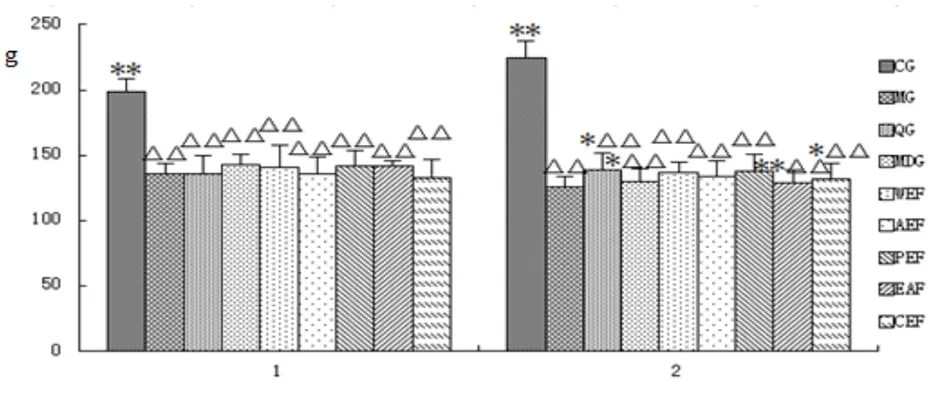
图11 各组大鼠给药前后体重测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组;1给药前;2给药后)
2.2.2 总体体征的变化 模型组大鼠从第3天开始,游泳耐力下降,表现出逐渐消瘦,粪便时干时软,偶尔便溏,后期食量摄入量减少,饮水量减少。表现出消瘦,懒动,倦怠,蜷缩聚堆,眯眼及弓背等。
2.2.3 给药前后体重变化 与正常组相比,给药前、给药后各组大鼠体重均极显著低于空白组(P<0.01),与模型组比,给药前茯苓各组分组无统计学意义,给药后茯苓水煎液组、茯苓多糖组体重增高(P<0.05),茯苓乙酸乙酯组体重下降(P<0.01),其余茯苓各组分组大鼠体重变化不显著。(见图11)。
2.2.4 尿D-木糖排出量测定 与正常组相比,模型组与茯苓各组尿液中D-木糖含量有统计学意义(P<0.01)。(见图12)。
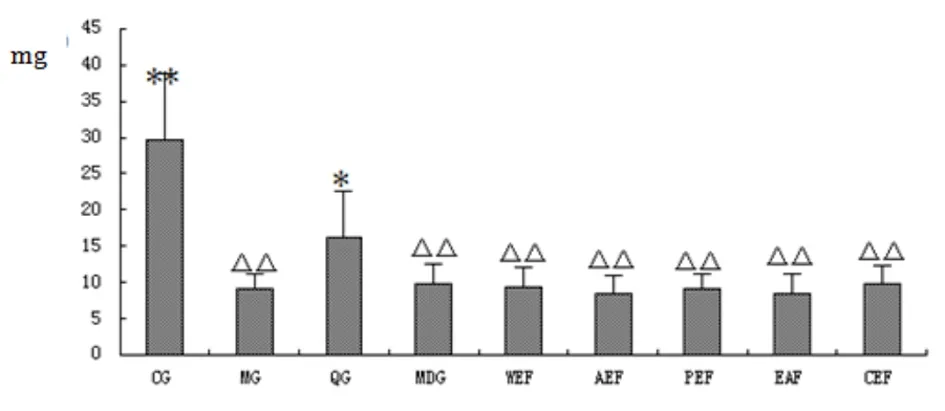
图12 各组大鼠尿D-木糖排出量测定(mg)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
2.2.5 粪便含水率测定 与正常组相比,模型组、茯苓水煎液组、茯苓水洗组粪便含水量有统计学意义(P<0.01);与模型组比较,茯苓乙酸乙酯组含水量降低且有统计学意义(P<0.05)茯苓多糖组含水量降低且有统计学意义(P<0.01)。(见图13)。

图13 各组大鼠粪便含水率测定(%)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
2.2.6 水负荷实验结果 大鼠在0~1 h体重下降率,与正常组相比,模型组有统计学意义(P<0.01),正常动物给药组组、茯苓水洗组、茯苓醇洗组有统计学意义(P<0.01);大鼠在1~2 h体重下降值,与正常组相比,模型组、茯苓水煎液组、茯苓水洗组、茯苓醇洗组、茯苓石油组、茯苓多糖组有统计学意义(P<0.05);大鼠在2~4 h体重下降率,与空白组相比,模型组有统计学意义(P<0.01),茯苓水洗组、茯苓石油醚组有统计学意义(P<0.05);大鼠在4~6 h体重下降率,未见差异;6 h总下降率,与正常组相比,模型组、茯苓各组分组组有均有统计学意义(P<0.01),与模型组相比,茯苓水煎液组、茯苓乙酸乙酯组有统计学意义(P<0.05)。(见表4及表5)。
6 h总尿量,与空白组相比,模型组、茯苓各组分组组有均有统计学意义(P<0.01),与模型组相比,茯苓水煎液组、茯苓乙酸乙酯组明显升高且有统计学意义。(见图14)。

图14 各组大鼠排尿量测定(ml)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
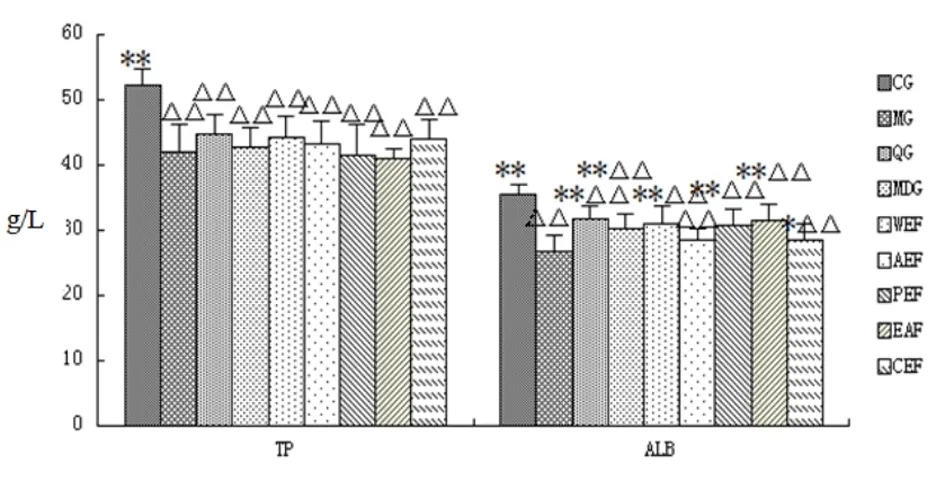
图15 各组大鼠血生化指标测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
2.2.7 血生化指标检测 总蛋白含量,与正常组相比,模型组、茯苓各组分组均有统计学意义(P<0.01);与模型组比,茯苓各组分均未见差异。白蛋白含量,与空白组相比,模型组、茯苓各组分组均有统计学意义(P<0.01);与模型组比,茯苓水煎液组、茯苓水洗组、茯苓石油醚组、茯苓乙酸乙酯组有统计学意义(P<0.01),茯苓多糖组有统计学意义(P<0.05)。(见图15)。

表2 各组大鼠水负荷后体重下降值的测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01。采用Dunnett T3检验。
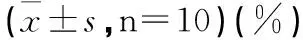
表3 各组大鼠水负荷后单位体重下降率测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01。采用Dunnett T3检验。

表4 各组大鼠水负荷后体重下降值测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01。采用Dunnett T3检验。
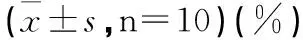
表5 各组大鼠水负荷后单位体重下降率测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01。采用Dunnett T3检验。
2.2.8 肾髓水通道蛋白1水平测定 与正常组相比,模型组、茯苓各组分组有统计学意义(P<0.01);与模型组比,茯苓茯苓多糖组显著降低(P<0.05)。(见图16)。

图16 各组大鼠肾髓水通道蛋白1水平测定
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
2.2.9 血清GAS测定 GAS是胃肠道主要激素之一,由G细胞分泌,以胃窦部最多,其次是胃底、十二指肠和空肠等处。GAS的生理功能主要为刺激胃酸的分泌,促进胃黏膜和壁细胞的生长以及胃肠道的蠕动。GAS的降低表明胃肠功能的代谢减缓。GAS含量,与正常组相比,模型组、茯苓各组分组均有统计学意义(P<0.01);与模型组比,茯苓水煎液组、茯苓乙酸乙酯组、茯苓多糖组有统计学意义(P<0.01)(见图17)。

图17 各组大鼠血清GAS测定(μg/L)
注:△表示与空白组相比,P<0.05;△△表示与空白组相比,P<0.01;*表示与模型组相比P<0.05;**表示与模型组相比P<0.01(CG空白组;MG模型组;QG阳性药组;MDG茯苓水煎液组;WEF茯苓水洗组;AEF茯苓醇洗组;PEF茯苓石油醚组;EAF茯苓乙酸乙酯组;CEF茯苓多糖组)
3 讨论
根据中医脾虚水湿内盛的相关理论,脾虚可造成机体内水湿停滞,即体内水液代谢发生异常[9]。人体的水液有四大排出途径,即呼吸、汗液、小便、大便而排出体外。其中任何一种代谢方式受到影响,都势必会造成机体内环境的紊乱,而导致水湿内盛。由于脾在水液的上下布散运动中发挥着枢纽作用,因此脾运化水液的功能减退,必然导致水液在体内停聚而产生水、湿、痰、饮等病理产物,甚至导致水肿[10-11]。
在本实验研究中,主要通过药理实验,探究茯苓不同剂量及其拆分组分对脾虚水湿内停大鼠的治疗作用,进而明确茯苓利水渗湿的药效物质基础。
脾虚水湿内停动物模型的造模方法是首先采用劳倦加饮食失节法造成动物脾虚,然后观查脾虚动物对腹腔水负荷后的脾虚水湿内停动物的水代谢的影响。
我们首先对茯苓不同剂量进行考察,造模前各组大鼠体重无明显差异,但随着造模时间的延长,体重明显下降,且有统计学意义。而肛温在整个过程中均无明显变化,无统计学意义。说明模型大鼠表现出的症状应是脾气虚,而不是阳虚或阴虚。水负荷实验中,模型组表现出明显的水液代谢障碍。给予茯苓水煎液后,体重值及单位体重下降率出现明显的增高。说明茯苓有较强的利水作用,且以中剂量组为最佳。D-木糖的吸收代谢情况是可以反映机体吸收功能的强弱,D-木糖含量的降低是评判脾虚的重要指标[12]。模型组大鼠尿量中D-木糖含量显著低于空白组,和模型组相比,茯苓中剂量水煎液可以有效改善脾虚水湿内停动物模型的脾虚状态,提高其相应的消化吸收功能。对大鼠进行腹腔水负荷后,可看出空白组排尿能力较正常,模型大鼠体现出明显的排尿障碍,而茯苓各给药组的尿量明显增加,说明茯苓的水液代谢途径是通过尿液排出。
总蛋白、白蛋白、HDL-C的含量模型组均低于正常组,总胆固醇,LDL-C的含量模型组均高于正常组,这都说明脾虚运化失司,水谷精微生化乏源,水液运化障碍。中剂量茯苓均能有效改善这些指标。茯苓各剂量组粪便含水量明显低于模型组,可认为茯苓的排水途径不可能是由粪便排出。茯苓水煎液可以为脾虚水湿内停动物模型的有效健脾燥湿最低有效剂量。
AQP1位于肾脏近曲小管及亨利袢降支的顶质膜与侧膜上,主要介导原尿中水分的重吸收。离体实验证明,AQP1降低导致近曲小管和亨利袢降支细段的渗透性及重吸收能力降低,逆流倍增系统遭破坏,表现为多尿。因此,AQP1水平升高的大鼠可出现尿液浓缩功能增强,表现为少尿[13-14]。茯苓各剂量组体现出明显升高大鼠肾髓中水通道蛋白1的作用。说明茯苓对水的调节作用不通过AQP1实现。
其后,对茯苓拆分组分进行研究。D-木糖的吸收情况是可以反映机体吸收功能的强弱,D-木糖的降低是评判脾虚的重要指标。茯苓水煎液升高D-木糖含量。而各组分未见升高,仅多糖组有此趋势。茯苓水煎液、茯苓乙酸乙酯组尿量升高,且粪便含水量明显降低说明茯苓的水液代谢途径是由尿液排出。因此,茯苓利水渗湿的有效组分是乙酸乙酯组分。总蛋白主要反映机体对营养物质的吸收功能,白蛋白主要为判断体内水湿与否的重要指标[15]。从总蛋白和白蛋白的含量上,也可看出,茯苓水洗、多糖组含量均有升高,而茯苓乙酸乙酯组仅升高白蛋白含量。
GAS是胃肠道主要激素之一,由G细胞分泌,以胃窦部最多,其次是胃底、十二指肠和空肠等处。GAS的生理功能主要为刺激胃酸的分泌,促进胃黏膜和壁细胞的生长以及胃肠道的蠕动。据实验报道,健脾除湿药或燥湿化湿药有提高脾虚动物血清GAS的作用[16]。由此可知,中医运用健脾除湿药和除湿化湿药治疗脾虚证而获效的机理,可能即与提高脾虚患者血清GAS含量,从而刺激胃酸、胃蛋白酶和胰酶的分泌,促进胃窦的收缩有关。模型组与正常组比较GAS含量明显降低,与现代医学认为的脾虚与胃泌素分泌减少有关相一致,脾气不足则气推动乏力,胃肠运动减慢[17]。茯苓乙酸乙酯组、茯苓多糖组GAS显著升高,综上可说明,茯苓对脾虚水湿内停动物利水作用主要通过其利尿作用来实现。茯苓乙酸乙酯组分、石油醚组分及多糖组分应为其健脾的物质基础,乙酸乙酯组分也为其利尿的物质基础。因此,以三萜类为主要成分的乙酸乙酯组分和茯苓多糖可能为其“甘”味物质基础,乙酸乙酯组分可能为其其淡味的物质基础。
[1]郑洪新.中医基础理论[M].北京:北京科技出版社,1997:25-180.
[2]国家药典委员会.中华人民共和国药典(茯苓)[S].北京:中国医药科技出版社,2010:224.
[3]林喆,徐煜彬,冉小库,等.茯苓化学组分拆分及不交叉性研究[J].中国中药杂志,2013,38(24):4340-4346.
[4]曲长江,刘劲,宫艳华,等.大黄泻下与劳倦过度单、复因素造模脾虚小鼠过氧化与抗氧化改变的比较研究[J].中国中西医结合消化杂志,2001,9(4):213-215.
[5]陈雷,李德新,崔家鹏,等.用模糊数学中模式识别方法进行脾气虚大鼠模型评价的实验研究[J].中国中医基础医学杂志,2006,12(2):118-120.
[6]高小玲,郭文峰,李茹柳,等.四君子汤对脾虚大鼠尿木糖排泄率及肠黏膜ATP的影响[J].中药材,2009,32(8):1242-1245.
[7]CLAUSS M,SCHWARM A,ORTMANN S,et al.The morphophysiological adaptations of browsing and grazing mammals[M].The ecology of browsing and grazing.Berlin.Springer,2008:47-88.
[8]李慧玉,雷帆,王玉刚,等.甘遂对水负荷小鼠排尿以及肾脏AQP2,IL-1β,TNF-α mRNA表达的影响[J].中国中药杂志,2012,37(5):606-610.
[9]吴咸中,高金亮.脾虚证的现代研究[M].天津:天津科技翻译出版公司,1992:46-48.
[10]张声生,陈明,王禾,等.慢性胃病脾虚痰湿证T细胞免疫调节及胃宁乐方干预治疗影响的研究[J].中国医药学报,2002,17(12):731-733.
[11]彭淑珍,李勇敏,王福云,等.健脾消积液对脾虚动物免疫功能的影响[J].湖南中医杂志,1999,15(2):56.
[12]薛丽莉,薛金,杜晨光.益脾止泻汤对脾虚泄泻大鼠血清D-木糖含量及血浆胃动素的影响[J].中国中医急症,2009,18(6):951-952.
[13]王从军,王红,杨体泉,等.水通道蛋白1在泌尿系统中表达的研究进展[J].实用儿科临床杂志,2011,26(23):1836-1839.
[14]蒲春霞.水通道蛋白研究进展[J].成都大学学报:自然科学版,2010,29(2):104-106.
[15]朱忠勇.实用医学检验学[M].北京:人民军医出版社,1992:32-35.
[16]秦新裕,雷勇.胃肠肽激素与胃肠动力[J].中国实用外科杂志,2001,21(6):229-331.
[17]贾波,邓中甲,黄秀深,等.白术茯苓汤不同配伍对脾虚大鼠胃泌素、胃动素、血管活性肠肽的影响[J].中医杂志,2002,43(12):938-940.
(2015-12-09收稿 责任编辑:洪志强)
The effective substances of Fuling on the invigorating spleen and promoting the water metabolism in the rat model with the water and dampness retention caused by spleen deficiency
Li Bin,Ran Xiaoku,Sun Yuncao,Dou Deqiang
(Collegeofpharmacy,LiaoningUniversityofTraditionalChineseMedicine,Dalian116600,China)
Objective:To explore the effect of Fuling for invigorating spleen and promoting the water metabolism in the rat model with the water and dampness retention caused by spleen deficiency so as to explore its effective substances.Methods:The optimized methods of improper diet and overstrain were used to replicate spleen-deficiency model.The rats with spleen deficiency were further administered intraperitoneal (i.p.) water to prepare the cohesion model of water and dampness.The changes of the rectal temperature,weight,the apparent situation and concentration of D-xylose in urine of rats was used to evaluate the spleen deficiency animal model.The water ratio of faeces,the TP,ALB,TC,HDL-C and LDL-C in serum,AQP1 in the renal medullary part and GAS as the main indexes in the spleen deficiency model with cohesion of water and dampness to elucidate the effective fraction of Fuling.Results:During the period of model preparation,the rats weight was decreased and no change was observed in rectal temperature,indicating that spleen deficiency of rats has been formed.The 7.5 g/kg dose of the water decoction of Fuling was tested as effective dosage.The water decoction,ethyl acetate fraction (EAF) and crude polysaccharide fraction (CPF) could obviously increase the weight of rats with spleen deficiency.Except alcohol eluate fraction (AEF),the other fractions of Fuling could increase the level of ALB in serum of rats with spleen deficiency significantly.CPF could decrease the level of AQP1 in renal medullary part of rats with spleen deficiency.EAF and CPF could promote the GAS level in serum of rats with spleen deficiency.EAF could increase the loss rates of body weight and the volume of urine of spleen deficiency rats with cohesion of water and dampness.Conclusion:The promoting action of Fuling on water metabolism is mainly via its diuretic function.EAF and CPF are the effective fractions of Fuling for invigorating spleen and EAF is also the effective fraction of Fuling for removing dampness.Consequently,the EAF mainly composed of triterpenoids and CPF might be the effective substances for the sweet flavor of Fuling and EAF might be the effective substances for the pale flavor of Fuling.
Spleen deficiency; Water and dampness retention; Fuling; Diuretic
国家重点基础研究计划(973计划)项目(编号:2013CB531803);辽宁省高等学校创新团队课题(编号:LT2013020)资助项目
窦德强,教授,Tel:+86(411)85890186,Fax:+86(411)05890128,E-mail:deqiangdou@126.com
R28
A
10.3969/j.issn.1673-7202.2015.12.007

