脑局部重离子辐射诱导大鼠外周旁效应研究
雷润宏,赵拓,吴国松,吕柯孬,王潇,马宏
(1. 北京理工大学生命学院,北京100081;2. 中国原子能科学研究院,北京102413)
引言
载人空间站、载人登月和火星探测等国家重大科技专项的启动[1],为空间生命科学研究提供了前所未有的机遇,同时也提出了长期载人航天飞行的安全性问题[2]。太空环境中的射线主要来自宇宙射线,包括银河宇宙射线(galactic cosmic rays,GCR),太阳宇宙射线(solar particle events,SPE)和地球辐射带(earth radiation belts,ERBs)[3]。来自太阳系以外的银河系宇宙射线中,有大约1.3%的高能重离子,其具有持续性和高能量的特点,在太阳耀斑爆发期间,来自太阳的重离子射线的含量在5~10%之间。重离子具有高传能线密度和尖的布喇格峰,并且与X-射线、γ-射线不同,前者为特定范围内能量的急性释放,而后者具有随深度的不同能量释放呈指数增加或减小的特点[4],因此重离子辐射的损伤能力不容忽视,对宇航员的健康存在着巨大的威胁。中枢神经系统对外周器官有调控作用,辐射导致的中枢神经系统损伤,能在外周器官产生旁效应[5,6]。当前关于空间重离子辐射生物学效应的研究,主要围绕相对较低剂量(< 4 Gy)、全身辐照、短期(< 7天)和重叠效应展开[7~9],难以在多器官损伤条件下对辐射损伤的级联反应调控及响应次序进行明确阐释。因此,本文建立了一次性高剂量重离子大鼠脑局部辐射动物模型,对外周器官产生的长时程损伤效应进行了评估。
2 材料与方法
2.1 实验动物
雄性Wistar大鼠42只,(体重180 g ± 10 g)购自北京维通利华实验动物技术有限公司。将动物先适应性饲养5天,自由摄食饮水,循环光照(12小时+12小时),环境温度为20~26℃,湿度40~70%。
2.2 12C6+重离子辐射
大鼠重离子辐射在中国科学院近代物理研究所重离子加速器上进行。将实验大鼠按照体重配对原则,随机分为对照组和辐射组(每组21只,每个时间点7只)。腹腔注射戊巴比妥钠麻醉,剂量为40 mg/kg体重,药物浓度为20 mg/mL,生理盐水配制。大鼠在麻醉状态下,12C6+离子束以垂直方式进入眼球后缘至枕骨前缘区域,能量为165 MeV/u,传能线密度为30 KeV/μm,剂量率为0.3~0.5 Gy/min,坪区辐照,吸收总剂量为15 Gy。暴露区域以外的身体其他部位用铅砖及铝块进行了防护。辐射后继续饲养,直至处死。对照组同期麻醉和固定,未进行辐射暴露。
2.3 大鼠组织取材与病理分析
在辐射后1个月、2个月和3个月,大鼠经戊巴比妥钠麻醉(剂量为60 mg/kg体重,药物浓度为20 mg/mL,生理盐水配制),打开胸腔,生理盐水心脏灌流,至全身血液被置换,分取各个器官的组织,包括主动脉,心脏,气管,肺,食管,胃,肝脏和肾脏,部分放入新鲜配制的4%多聚甲醛固定,48 h后更换一次固定液,用于制作切片,部分–80℃冰箱冻存,用于蛋白提取。固定之后的切片制作和病理分析,委托中国医学科学院医学实验动物研究所完成(病理编号:1351001-1351094)。
2.4 组织切片TUNEL染色
TUNEL染色根据商用试剂盒的说明书操作,步骤简述如下:二甲苯脱蜡,5 min × 3次;之后梯度乙醇水化,100%浓度,5 min × 2次,95%浓度3 min,70%浓度3 min,0.01 mol PBS 5 min;抗原修复使用20 μM蛋白酶K消化,室温15 min,用蒸馏水洗涤,2 min × 3次;消除内源性过氧化物酶,3%过氧化氢处理5 min,PBS洗涤,5 min × 2次;用Equilibration Buffer平衡至少10 s,甩干之后滴加TdT enzyme,置于湿盒中,37℃条件下60 min;用Stop/Wash Buffer轻摇漂洗15 s后室温浸洗10 min,之后PBS洗涤,1 min × 4次,甩干液体;滴加Anti-Digoxigenin Conjugate,湿盒中室温孵育30 min,PBS洗涤,2 min × 5次;DAB底物处理3~5 min,蒸馏水洗涤,1 min × 3次,之后用蒸馏水孵育5 min;二甲苯透明,2 min × 3次,甩干之后用PVP封片剂封片。自然晾干,倒置显微镜下观察,拍照。
2.5 蛋白提取与ELISA细胞因子检测
组织样品经冷冻研磨之后,加入RIPA裂解液,用移液枪轻轻吹打均匀并超声破碎,4℃ 12000 × g离心15 min,取上清,分装之后-80℃冰箱冻存,用于ELISA检测。根据ELISA试剂盒说明书进行实验操作。步骤简述如下:1. 从室温平衡半小时的铝箔袋中取出所需数量的板条,2. 设置标准品孔和样本孔,标准品孔加入不同浓度的标准品各50 μL,3. 样本孔加入10 μL样本,再加入样本稀释液40 μL,空白孔不加,4. 除空白空外,标准品孔和样品空各加入辣根过氧化物酶(HRP)标记的抗体100 μL,用封板膜封闭各孔,37℃恒温箱60 min,5. 弃去液体,吸水纸上拍干,用稀释好的洗涤液洗涤5次,每次1 min,每次每孔须加入至少350 μL洗涤液,最后一次洗完后彻底拍干,6. 每孔加入底物A、B各50 μL,37℃避光孵育15 min,7. 每孔加入反应终止液50 μL,15 min内在450 nm波长处测定各孔OD值,8. 以标准品浓度为横坐标,对应的OD值为纵坐标,得出标准品线性回归方程,按照方程,计算各个样本中所测因子的浓度,用蛋白浓度做归一处理。
2.6 数据统计与分析
所有实验数据利用Microsoft Of fi ce Excel 2010和GraphPad PRISM(Version 5.01)进行统计分析。以误差线的形式表示标准偏差(±s),组间采用单因素方差分析方法进行显著性分析。实验组与正常组的数据经统计分析后,*代表P <0.05,**代表P < 0.01,***代表P < 0.001。ELISA检测的n的范围为5~7;组织切片分析每组3个标本,每个标本取4张切片,每张切片取5~8个视野,在相对一样的视野位置进行观察,拍照。
3 结果与分析
3.1 脑局部重离子辐射引起心肌萎缩和局灶性纤维化
尽管心脏对辐射的敏感性较低,但是与对照组相比,15 Gy碳离子脑局部辐射后1个月,如图1A中1R圈出区域所示,心肌出现明显的局灶性纤维化,表现为心肌纤维呈灰色,肌浆空泡化,而对照组染色均匀,心肌纤维排列规整、紧密(图1A中1C)。辐射后2个月时,如图1A中2R所示,心肌纤维之间的闰盘排列不整齐(绿色箭头),心肌纤维之间出现空隙(红色箭头),心肌纤维发生萎缩,心肌纤维之间连接不紧密,而对照组心肌纤维排列整齐(图1A中2C)。辐射后3个月时,如图1A中3R所示,心肌纤维排列不规整,出现严重的扭曲(绿色箭头),心肌纤维之间的空隙增大(红色箭头),而对照组心肌纤维结构清晰,排列整齐,着色均匀,肌纤维大小一致(图1A中3C)。同时,心肌组织ELISA检测发现,与各个时间点对照组相比,脑局部重离子辐射引起心肌组织中炎症相关细胞因子蛋白水平显著性升高(图1B),包括氨基脲敏感性胺氧化酶(SSAO),前列腺素E2(PGE2),一氧化氮合酶(iNOS),白细胞介素6(IL-6),肿瘤坏死因子-α(TNF-α)和与炎症有关的趋化因子CCL20。上述结果表明,非靶向的脑局部重离子辐射会引发长时程的大鼠心肌纤维化,心肌萎缩和炎症发生。
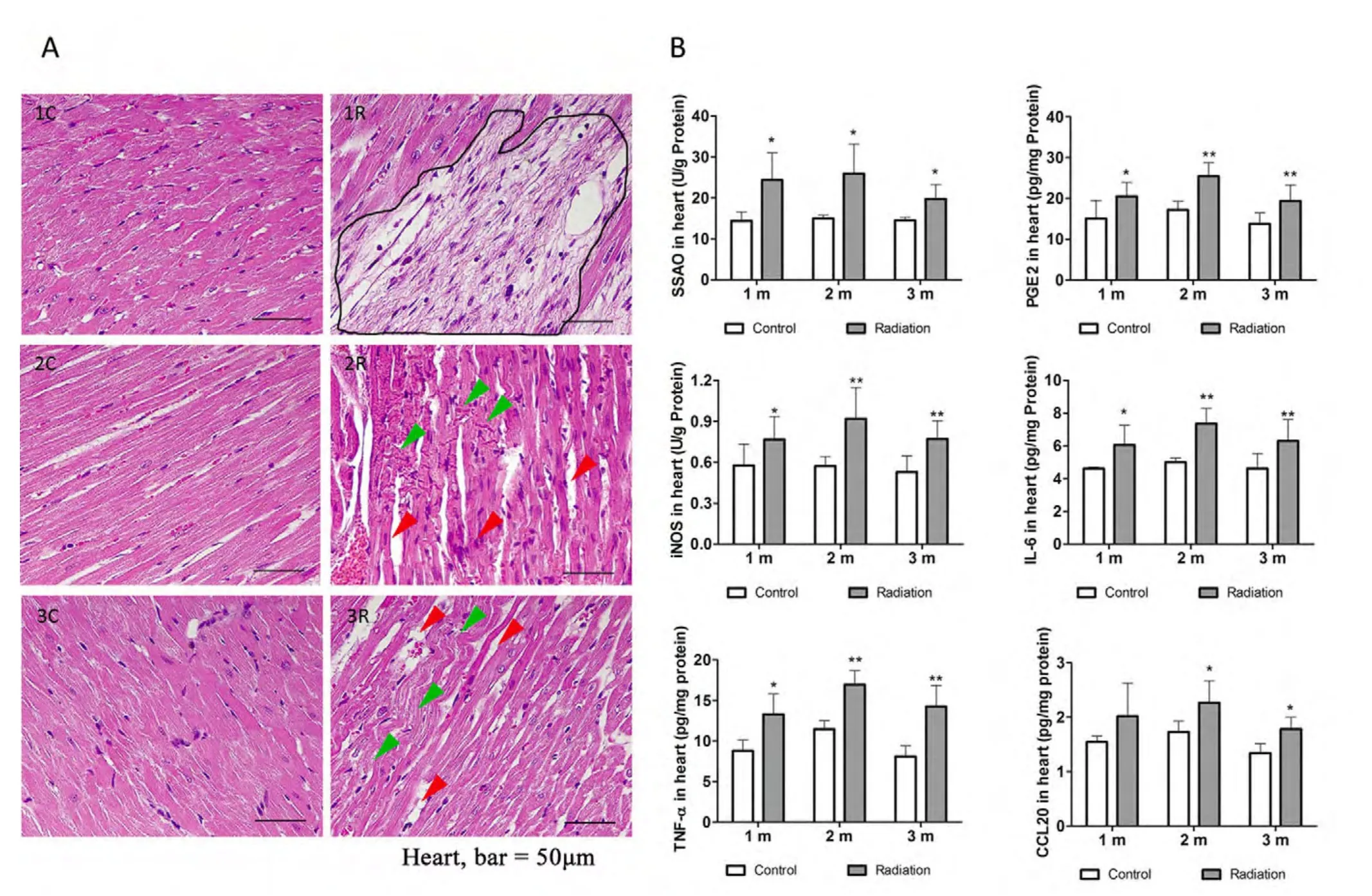
图1 脑局部重离子辐射引起心肌组织病变并引发炎症。A:心肌组织H&E染色病理分析。1C,2C,3C表示1个月、2个月和3个月的对照组;1R,2R,3R表示1个月、2个月和3个月的辐射组。1R中圈出区域所示为局灶性纤维化特征;2R中绿色箭头所示为排列杂乱的闰盘,红色箭头所示为心肌纤维之间的空隙;3R中绿色箭头所示为排列扭曲的心肌纤维;标尺=50μm,Heart:心肌。B:心肌组织炎症因子水平分析。Control,对照组;Radiation,辐射组;1m,2m,3m表示未辐射或辐射后1个月、2个月和3个月。*:p<0.05;**:p<0.01。Fig. 1 Brain-localized heavy ion radiation induced pathologic changes and in fl ammation in myocardial tissue. A: Pathologic analysis of heart tissues after HE staining. 1C, 2C, 3C, control group one, two and three months after irradiation, 1R, 2R, 3R, radiation group one, two and three months after irradiation. The area in 1R of 1A presents the myocardial fi brosis. Green arrows in 2R indicate the intercalated discs of myocardium,red arrows in 2R point the gap between myocardial fi bers. In 3R, green arrows present the twisted myocardial fi bers while the red arrows indicate the gaps between the myocardial fi bers. Bar=50μm. B: Changes of in fl ammation factors in heart tissues. 1m, 2m, 3m, one, two and three months after irradiation, control, mock irradiated group, Radiation: irradiated group. *, p < 0.05, **, p < 0.01.
3.2 脑局部重离子辐射引发主动脉炎症
主动脉HE染色病理分析未发现明显病变。通过ELISA检测发现,在辐射后第2个月,主动脉中的炎症因子,包括SSAO,TNF-α,CCL20,iNOS,IL-6和PGE2未发生显著性改变,但是在辐射后第3个月明显升高(图2),提示主动脉中有炎症发生,但是相对较为迟缓。
3.3 脑局部重离子辐射引起气管、肺部损伤
脑局部重离子辐射之后1个月,TUNEL检测发现大鼠气管腺上皮细胞凋亡(图3A中1R-a,白色箭头)。病理分析发现,气管出现粘膜及粘膜下层水肿(图3A中1R-b,红色箭头),同时,气管腺上皮组织内出现大量空泡(图3A中1R-b,黄色箭头)。在辐射后3个月时,气管粘膜和粘膜下层细胞发生凋亡(图3A中3R-a,白色箭头),病理分析发现,气管粘膜及粘膜下层水肿(图3A中3R-b,红色箭头),同时气管腺上皮组织内出现空泡(图3A中3R-b,黄色箭头),但相比辐射后1个月略少。
在肺组织中,辐射后1个月时,有细胞凋亡发生(图3B中1R-a,白色箭头),同时发现肺部血管周围水肿,表现为间质淡染且疏松(图3B中1R-b,绿色箭头)。此外,肺泡排列紊乱,并且有肺泡破裂(图3B中1R-a、1R-b,黑色箭头)。在辐射后3个月,凋亡细胞未明显增加,而肺泡破裂明显(图3B中3R-a,黑色箭头)。
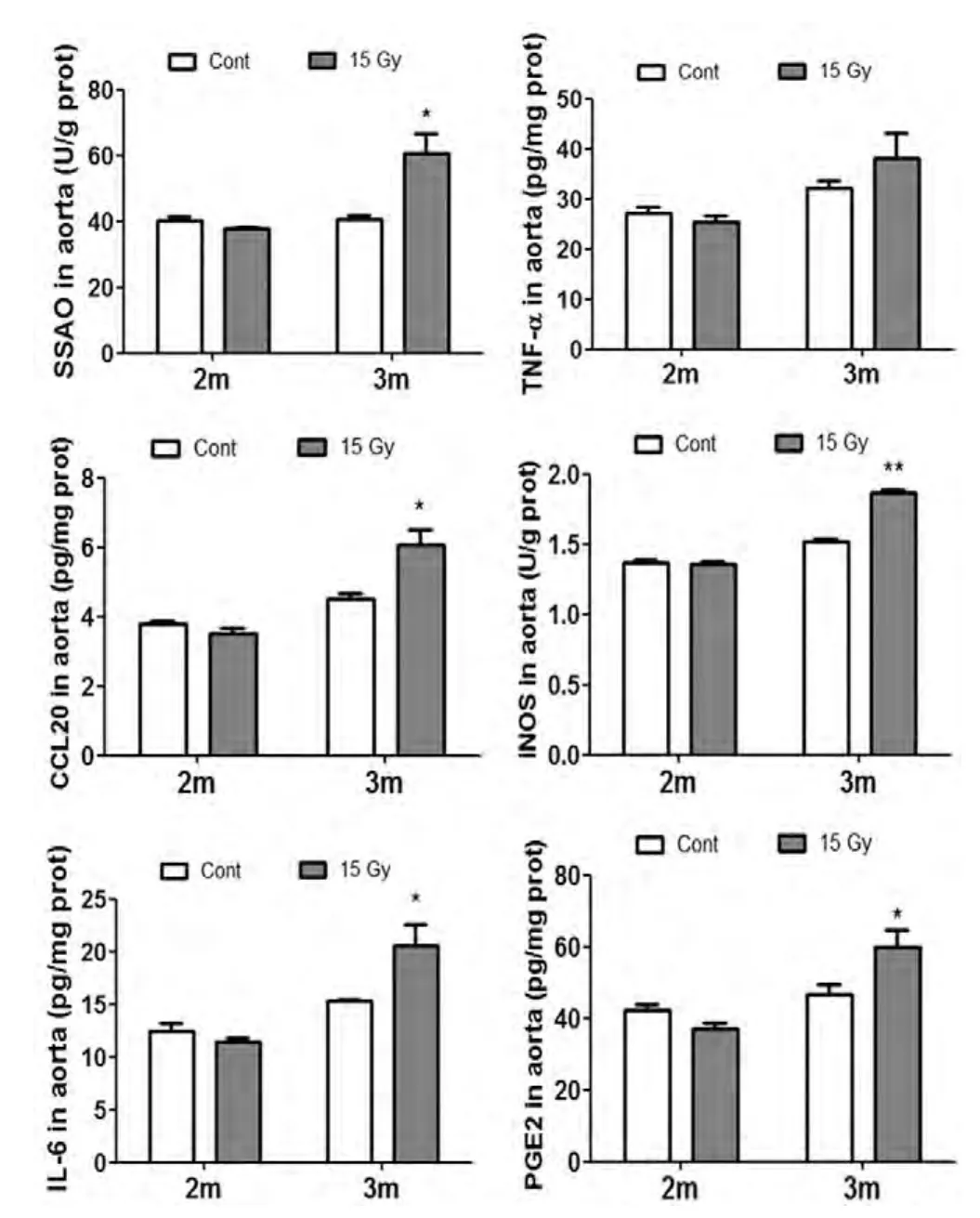
图2 脑局部重离子辐射主动脉炎症因子水平分析。通过ELISA检测的炎症相关因子包括SSAO,TNF-α,CCL20,iNOS,IL-6和PGE2。2m,3m表示未辐射或辐射后2个月,3个月。Cont,对照组;15 Gy:15 Gy辐射组。Aorta:主动脉。*:p<0.05;**:p<0.01。Fig. 2 Brain-localized heavy ion radiation induced in fl ammation in aorta. The inflammation factors measured by ELISA include SSAO, TNF-α, CCL20, iNOS, IL-6 and PGE2. 2m, 3m, two and three months after irradiation. cont, control group, 15 Gy, irradiated group.*, p < 0.05, **, p < 0.01.
3.4 脑局部重离子辐射引起食管、胃部细胞凋亡
食管H&E染色病理检测未见明显病变,但是TUNEL检测发现,辐射后1个月,食管凋亡细胞多于对照组,并且大多分布于粘膜肌层(图4A中1R,白色箭头)。辐射后3个月,食管粘膜上皮细胞凋亡略有增加(图4A中3R,白色箭头)。
胃部H&E染色病理检测未见明显病变。辐射组胃部粘膜层的黏液细胞在辐射后第1个月时凋亡明显(图4B中1R,白色箭头),在辐射后3个月时,黏液细胞凋亡较辐射后1个月时减少,与对照组无显著性差别(图4B中3R)。此外,辐射后1个月与3个月样本中,胃粘膜层的黏液细胞较对照组稀疏、松散,提示黏液细胞在辐射条件下脱落增加,细胞间紧密连接破坏,胃粘膜屏障受损。
3.5 脑局部重离子辐射引起肝脏细胞凋亡
TUNEL凋亡分析发现,辐射后1个月,肝组织中有少量凋亡细胞出现(图5中1R,白色箭头),而在辐射后第3个月,凋亡细胞数量明显增多(图5中3R,白色箭头),并且中央静脉边界模糊。但是,脑局部重离子辐射之后1个月和3个月,肝脏病理检测未发现明显病变,这可能与肝脏具备较强的自我修复能力相关。
3.6 脑局部重离子辐射引起肾脏细胞凋亡
脑局部重离子辐射之后1个月和3个月,肾脏病理检测未发现明显病变。凋亡分析发现,辐射后1个月凋亡细胞未见明显增加,肾小体轮廓清晰,但是辐射后3个月,凋亡细胞明显多于对照组(图6中3R,白色箭头),肾小体轮廓模糊。
4 讨论
中枢神经系统重离子辐射引起的外周器官旁效应,可通过多种途径产生,包括基于下丘脑-垂体-肾上腺皮质轴(HPA轴)的神经内分泌系统,由神经纤维释放神经递质直接对外周靶器官进行调控的交感神经系统以及能够通过脑脊液进行中枢神经系统和外周免疫系统物质交换的中枢神经系统淋巴管网络。此外,经由血液循环系统,神经损伤产生的多种信号物质也可参与对外周靶向器官的调节作用,包括炎症因子,趋化因子,生长因子和小分子等。
有研究表明,辐射条件下的心肌损伤,可由微血管损伤和炎症、氧化应激水平升高引起[10~12]。本研究结果发现,心肌和主动脉中均有高水平表达的炎症因子,提示在非靶向的脑局部重离子辐射条件下,心血管系统遭受严重损伤,炎症因子可能发挥介导作用,而主动脉的病变多由心脏本身的功能异常和血液动力学改变引起[13],因此具有迟发的特点。此外,肺部的自我修复能力较强,放射性肺损伤多在辐射后较长时间发生,表现为放射性肺纤维化和放射性肺炎。在15Gy脑局部重离子辐射条件下,大鼠肺部的病理损伤在辐射后1个月至3个月均明显,表明其损伤机制可能与靶向的放射性损伤不同。同时,胃部的直接放疗会导致胃肠功能紊乱,在脑局部重离子辐射条件下,食管及胃部损伤可能主要与循环系统中的小分子有关,如炎症因子等。再次,肝脏因具有较强的修复能力,属于放射迟反应组织,在本研究中发现尽管重离子脑局部辐照引起肝脏细胞凋亡,且凋亡程度在辐射后3个月时较辐射后1个月增加,但是肝脏组织基本结构未发生明显改变,这也可能与肝细胞具有较强的修复能力有关。与此相反,肾脏属于放射敏感组织,但是在非靶向的辐射条件下,我们看到其病理改变也不明显,只有一定数量的细胞凋亡发生,并且发生时间较晚,提示靶向与非靶向辐射损伤效应机制可能存在较大区别,须深入研究。

图3 脑局部重离子辐射后气管、肺脏病变分析。A:气管TUNEL染色和H&E染色分析。B:肺组织TUNEL染色和H&E染色分析。1C,3C表示1个月和3个月的对照组;1R,3R表示1个月和3个月的辐射组。A中1R-a,3R-a和B中1R-a白色箭头表示发生凋亡的细胞;1R-b,3R-b中黄色箭头和红色箭头分别表示气管腺上皮组织内的空泡和粘膜及粘膜下层水肿。B中1R-a,1R-b和3R-a中黑色箭头表示破裂的肺泡;1R-a中白色箭头表示凋亡的细胞;1R-b和3R-b中绿色箭头表示肺部血管周围水肿。标尺=50μm。Trachea:气管,Lung:肺。Fig. 3 Brain-localized heavy ion radiation induced pathologic changes in trachea and lung. A: TUNEL assay and H&E staing of trachea.B: TUNEL assay and H&E staining of lung. 1C, 3C, control group one and three months after irradiation, 1R, 3R, radiation group one and three months after irradiation. The white arrows in 1R-a, 3R-a of fi gure A and 1R-a of fi gure B present the TUNEL-positive cells. Yellow and red arrows in 1R-b and 3R-b indicate the cavitation bubbles in epithelium of tracheal gland and edema in mucosa and sub-mucosa of trachea, respectively.The black arrows in 1R-a, 1R-b and 3R-a of B present the rupture of alveoli. The green arrows in 1R-b and 3R-b of fi gure B indicate the edema around blood vessels in lung. Bar=50μm.
空间重离子辐射能对航天员造成全身性的辐射损伤[14],对于其机制的探索,受到全身辐照条件下重叠效应的影响,因此,研究局部器官辐射条件下的损伤反应,特别是脑局部重离子辐射后外周器官的损伤反应,有助于对重叠效应进行分级阐述。此外,随着对重离子束流精准控制和肿瘤标记技术的快速发展,临床放疗以单次高剂量取代多次小剂量的治疗方案逐步得到推广[15],但是一次性高剂量辐射导致的外周器官的损伤效应,尚未进行系统的研究。本研究在脑局部重离子一次性高剂量辐射的大鼠模型上,从病理分析、细胞凋亡分析和细胞因子表达层面上研究了外周器官的长期损伤效应,以期为进一步研究重离子辐射的长时程损伤效应提供实验依据和参考。此外,本研究有助于阐明空间重离子全身辐照后机体损伤重叠效应的级联次序,从而加深对空间辐射损伤的认识、评价和预防,可以为空间辐射损伤生物标志预警体系提供理论依据。
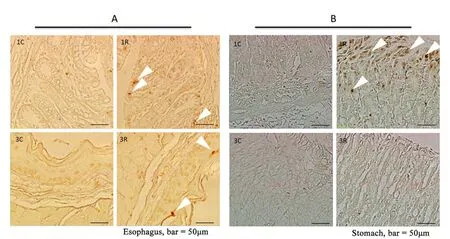
图4 脑局部重离子辐射食管、胃部细胞凋亡分析。A:食管TUNEL染色。B:胃TUNEL染色。1C,3C表示1个月和3个月对照组;1R,3R表示1个月和3个月辐射组。A中1R,3R和B中1R内白色箭头所示为TUNEL阳性细胞。标尺=50μm。Esophagus:食管,Stomach:胃。Fig. 4 Brain-localized heavy ion radiation induced cell apoptosis in esophagus and stomach. A, TUNEL assay of esophagus. B, TUNEL assay of stomach. 1C, 3C, control group one and three months after irradiation, 1R, 3R, radiation group one and three months after irradiation. The white arrows in 1R, 3R of fi gure A and 1R of fi gure B present the TUNEL-positive cells. Bar=50μm.
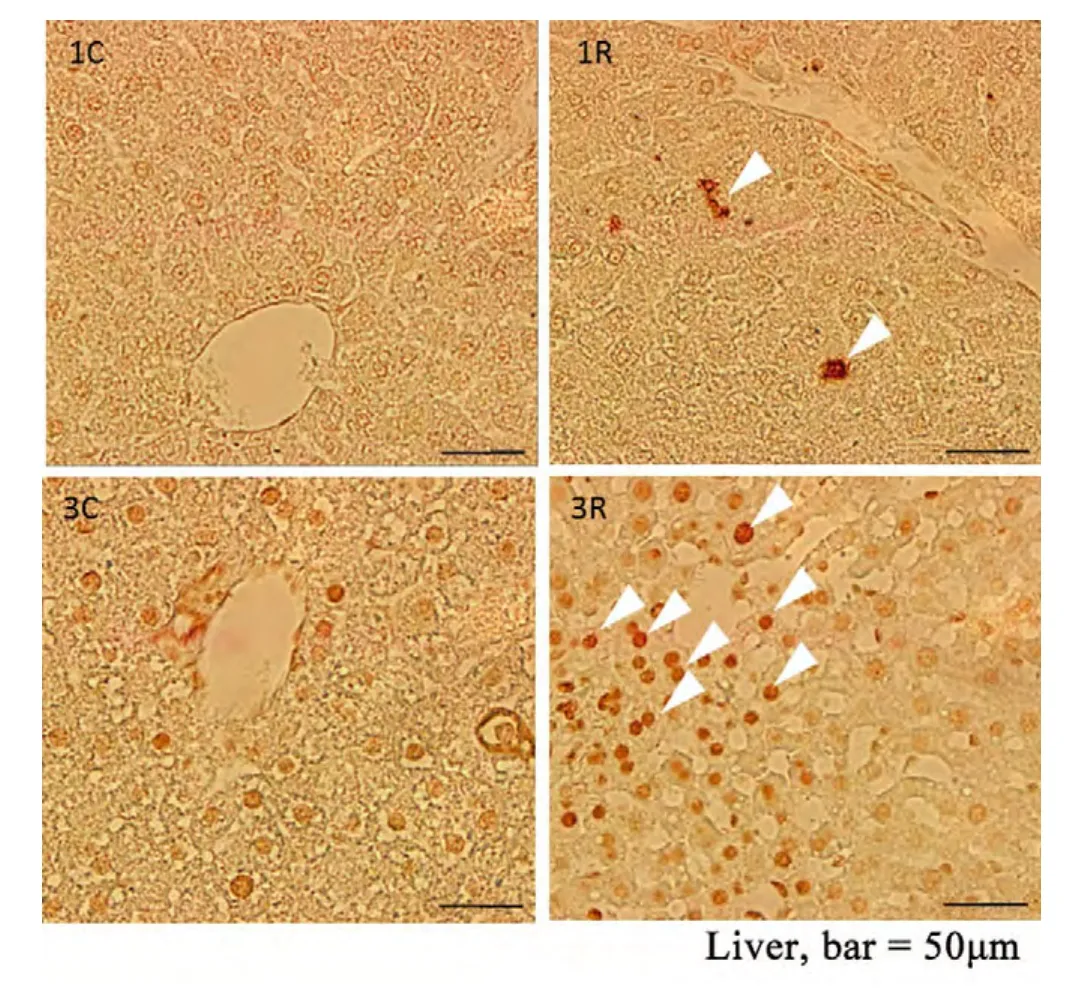
图5 脑局部重离子辐射引起肝脏细胞凋亡。1C,3C表示1个月和3个月的对照组;1R,3R表示1个月和3个月的辐射组。1R,3R中白色箭头所示为TUNEL阳性细胞。标尺=50μm。Liver:肝脏。Fig. 5 Brain-localized heavy ion radiation induced cell apoptosis in liver. 1C, 3C, control group one and three months after irradiation,1R, 3R, radiation group one and three months after irradiation. The white arrows in 3R present the TUNEL-positive cells. Bar=50μm.
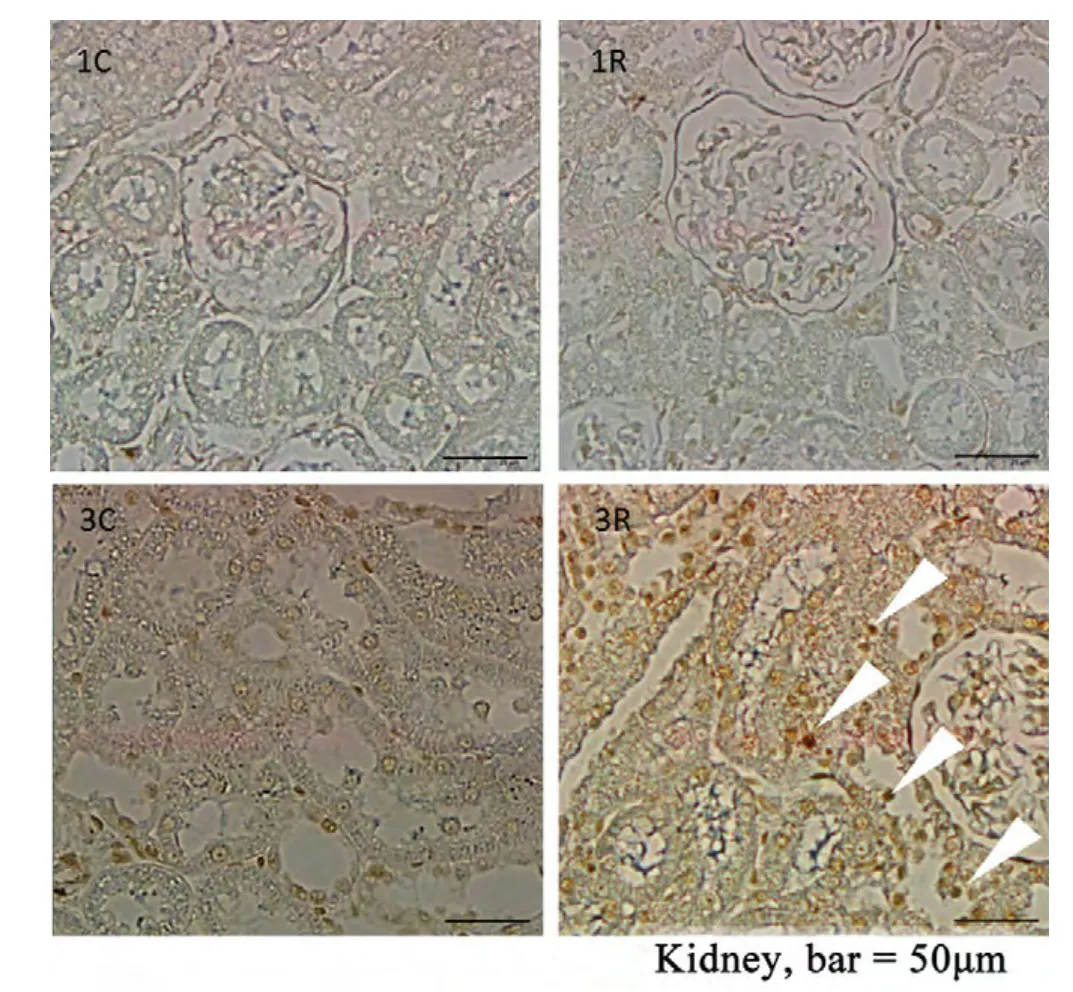
图6 脑局部重离子辐射引起肾脏细胞凋亡。1C,3C表示1个月和3个月的对照组;1R,3R表示1个月和3个月的辐射组。1R,3R中白色箭头所示为TUNEL阳性细胞。标尺=50μm。Kidney:肾脏。Fig. 6 Brain-localized heavy ion radiation induced cell apoptosis in kidney. 1C, 3C, control group one and three months after irradiation, 1R, 3R, radiation group one and three months after irradiation. The white arrows in 1R, 3R present the TUNEL-positive cells. Bar=50μm.
[1] 周建平. 我国空间站工程总体构想. 载人航天, 2013, 19(2): 1-10.
[2] Chancellor J C, Scott G B, Sutton J P. Space Radiation: The Number One Risk to Astronaut Health beyond Low Earth Orbit [J]. Life(Basel), 2014, 4 (3): 491-510.
[3] Marin A, Martin M, Linan O,et al.Bystander effects and radiotherapy [J]. Rep Pract Oncol Radiother, 2015, 20 (1): 12-21.
[4] Blakely E A, Kronenberg A. Heavy-ion radiobiology: new approaches to delineate mechanisms underlying enhanced biological effectiveness. Radiat Res, 1998 , 150(5 Suppl): S126-45.
[5] Kalthur G, Kumar P, Devi U,et al.Susceptibility of peripheral lymphocytes of brain tumour patients to in vitro radiation-induced DNA damage, a preliminary study [J]. Clin Exp Med, 2008, 8 (3):147-150.
[6] Smith R W, Wang J X, Schultke E,et al.Proteomic changes in the rat brain induced by homogenous irradiation and by the bystander effect resulting from high energy synchrotron X-ray microbeams [J].Int J Radiat Biol, 2013, 89 (2): 118-127.
[7] Cheema A K, Suman S, Kaur P,et al.Long-term differential changes in mouse intestinal metabolomics after gamma and heavy ion radiation exposure [J]. PLoS One, 2014, 9 (1): e87079.
[8] Datta K, Suman S, Kallakury B V,et al.Heavy ion radiation exposure triggered higher intestinal tumor frequency and greater beta-catenin activation than gamma radiation in APC(Min/+) mice[J]. PLoS One, 2013, 8 (3): e59295.
[9] Hamada N. Recent insights into the biological action of heavy-ion radiation [J]. J Radiat Res, 2009, 50 (1): 1-9.
[10] Lanzerotti L J. Space Radiation and Human Flight to Mars [J].Space Weather, 2014, 12 (7): 447-447.
[11] Baker J E, Fish B L, Su J,et al.10 Gy total body irradiation increases risk of coronary sclerosis, degeneration of heart structure and function in a rat model [J]. Int J Radiat Biol, 2009, 85 (12):1089-1100.
[12] Schultz H S, Trott K R. Radiation-induced cardiovascular diseases:Is the epidemiologic evidence compatible with the radiobiologic data? [J]. Int J Radiat Oncol Biol Phys, 2007, 67 (1): 10-18.
[13] Tanweer O, Wilson T A, Metaxa E,et al.A comparative review of the hemodynamics and pathogenesis of cerebral and abdominal aortic aneurysms: lessons to learn from each other [J]. J Cerebrovasc Endovasc Neurosurg, 2014, 16 (4): 335-349.
[14] Stewart F A, Hoving S, Russell N S. Vascular Damage as an Underlying Mechanism of Cardiac and Cerebral Toxicity in Irradiated Cancer Patients [J]. Radiat Res, 2010, 174 (6): 865-869.
[15] Durante M, Reppingen N, Held K D. Immunologically augmented cancer treatment using modern radiotherapy [J]. Trends Mol Med,2013, 19 (9): 565-582.