新型含均三氮唑Schiff碱吡唑基Mannich碱的合成*
郑玉国,魏全鲜,陆 寅,徐开宇,周 青,孙长梅,周 莉,张国义
(兴义民族师范学院绿色化学合成技术研究所民族药用生物资源研究与开发实验室,贵州兴义 562400)
1,2,4-三唑及其衍生物具有广泛的生物活性,如抗菌、杀虫、除草、抗病毒、抗炎和心血管等[1-5],在新药设计中常被作为活性药效基团。目前已开发出了抑菌剂三唑酮、烯唑醇、亚胺唑等,除草剂氨唑草酮和唑啶草酮等,杀虫剂三唑磷和唑蚜威等数十个高效低毒的1,2,4-三唑农药品种,其合成和生物活性研究一直是农药化学研究的热点。
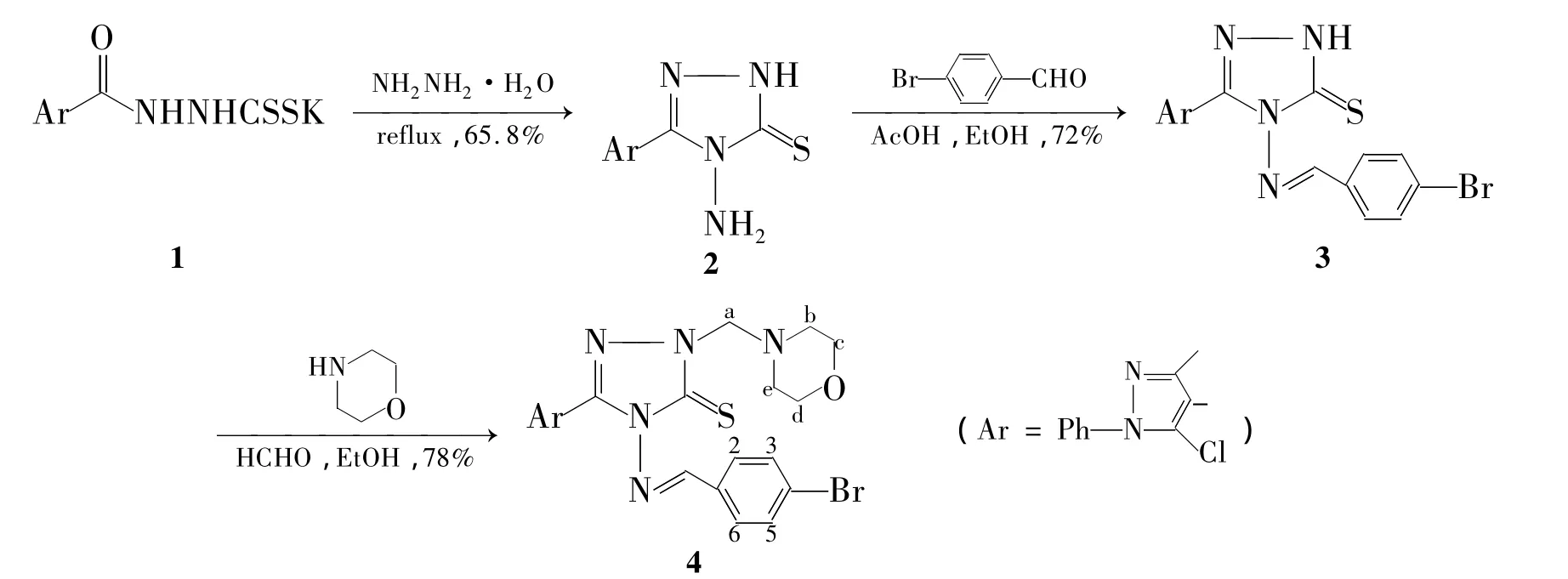
Scheme 1
含吡唑环衍生物因具有如抗菌、杀虫、除草、抗病毒等广泛的生物活性[6-8],一直以来以其母体结构修饰在药物研发中备受关注。自20世纪50年代年代吡虫威作为杀虫剂上市以来,短短几十年已开发了数十个农药品种,如杀菌剂呋吡菌胺和吡噻菌胺,杀虫剂唑虫酰胺、氟虫腈、敌蝇威、锐劲特和吡虫酰胺等。近年来,许多具有生物活性的吡唑环衍生物陆续被报道。吗啉是农药、医药的重要中间体,而Schiff碱化合物的抗菌、抗癌、杀虫、抗病毒及除草等生物活性亦是备受关注的研究对象[9-10]。Mannich反应是构筑有机分子骨架的经典方法,由其衍生而得到的Mannich碱具有抗菌、消炎、抗肿瘤等广泛的生物活性,常具有比母体分子更好的生物活性、更低的毒副作用性[11-12]。
本文根据药物设计中的活性基团拼接原理,将吡唑官能团和1,2,4-三唑连接到Schiff碱骨架上,利用Mannich反应,设计并合成了含吗啡均三氮唑Schiff碱吡唑基Mannich碱化合物。即以N-(1-苯基-3-甲基-5-氯)吡唑甲酰肼基二硫代甲酸钾(1)和水合肼为起始原料,经闭环反应制得4-氨基-5-(1-苯基-3-甲基-5-氯吡唑)-1,2,4-三唑-3-硫酮(2);2与对溴苯甲醛经缩合反应得4-(4-溴苯次甲亚胺)-5-(1-苯基-3-甲基-5-氯吡唑)-1,2,4-三唑-3-硫酮(3);以乙醇为溶剂,3在甲醛溶液中与吗啉于75℃反应4 h合成了新化合物——2-(吗啉亚甲基)-4-(4-溴苯次甲亚胺)-5-(1-苯基-3-甲基-5-氯 吡 唑)-1,2,4-三 唑-3-硫 酮 (4,Scheme 1),总收率37%,其结构经1H NMR,IR和元素分析确证。
该方法具有反应条件温和,产品易纯化,制备步骤简单,产率较高等优点,为类似化合物的合成提供参考。
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度未校正);JEOL-ECX 400 NMR型核磁共振仪(DMSO-d6为溶剂,TMS为内标);IR Prestige-21型红外光谱仪(KBr压片);Elementar Vario-III型元素分析仪。
1参照文献[3]方法制备;其余所用试剂均为分析纯。
1.2 合成
(1)2的合成
在反应瓶中加入1 3.64 g(10 mmol)和80%水合肼30 mL,搅拌下流反应2 h。自然冷却至室温,过滤,滤液用10%盐酸调至中性,析出固体,过滤,滤饼用水洗涤,干燥后用无水乙醇重结晶得白色晶体2,产率65.8%,m.p.266 ℃ ~268 ℃;1H NMR δ:14.01(s,1H,NH),7.53 ~7.62(m,5H,ArH),5.65(s,2H,NH2),2.29(s,3H,CH3);IR ν:3 436(NH2),3 253(NH),3 064(ArH),1 632(N=C),1 363(C=S)cm-1;Anal.calcd for C12H11N6SCl:C 46.98,H 3.61,N 27.39;found C 47.12,H 3.83,N 27.66。
(2)3的合成
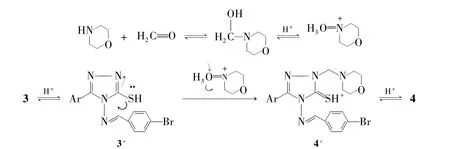
Scheme 2
在反应瓶中加入2 3.07 g(10 mmol),对溴苯甲醛2.22 g(12 mmol)和无水乙醇30 mL,搅拌使其溶解;加入2滴冰醋酸,于65℃反应3 h(TLC检测)。冷却至室温,过滤,滤饼用无水乙醇重结晶得白色固体3,产率72%,m.p.202℃ ~204℃;1H NMR δ:14.37(s,1H,NH),9.87(s,1H,NCH),7.62 ~7.81(m,9H,ArH),2.30(s,3H,CH3);IR ν:3 112,2 958,1 674,1 608,1 561,1 470,1 442,1 236 cm-1;Anal.calcd for C19H14N6SClBr:C 48.17,H 2.98,N 17.74;found C 48.33,H 3.27,N 17.92。
(3)4的合成
在反应瓶中依次加入3 4.74 g(10 mmol),冰醋酸2 滴,甲醛溶液1.5 mL(20 mmol),吗啉 1.3 g(15 mmol)及无水乙醇30 mL,搅拌下回流反应4 h(TLC检测)。冷却至室温,静置析出固体,过滤,滤饼用无水乙醇重结晶得白色片状晶体4,产率 78%,m.p.242 ℃ ~244 ℃;1H NMR δ:9.97(s,1H,NCH),7.81(d,J=8.4 Hz,2H,2,3-H),7.76(d,J=8.4 Hz,2H,5,6-H),7.53 ~7.60(m,5H,PhH),5.19(s,2H,a-H),3.59(t,J=4.6 Hz,4H,b,e-H),2.77(t,J=4.6 Hz,4H,c,d-H),2.31(s,3H,CH3);IR ν:3 056,2 959,1 620,1 589,1 558,1 514,1 498,1 479,1 452,1 442,1 381,1 296,823,767,693 cm-1;Anal.calcd for C24H23N7OSClBr:C 50.31,H 4.05,N 17.11;found C 50.54,H 4.24,N 17.31。
2 结果与讨论
2.1 合成
在2的合成中,由于NH2的存在,酸化时要控制pH值不能太低,否则,会导致析出产物溶解在水中,致使产率大大降低。在3的合成中,加入少量的冰乙酸使羰基碳具有更强的电正性,更容易进行亲核加成反应。在4的合成中,加入2滴冰乙酸使C=O和C=S易极化,从而更易烯醇化,更容易进行缩合反应。反应过程中因甲醛易挥发,且3与4的极性相近,所以甲醛与吗啉的用量要过量以使3反应完全,便于后处理。
2.2 反应机理
4可能的反应机理见Scheme 2。首先甲醛与吗啉缩合形成亚胺盐,其以碳正离子的形式与硫酮的烯醇式结构进行亲核加成-消去反应得4。
2.3 表征
2转变为3后,1H NMR谱中NH2质子峰(δ 2.29)消失,NH 质子峰(δ 14.37)仍存在;在低场出现亚胺(N=CH)质子峰(δ 10.05),说明 NH2与醛基发生了反应。经Mannich反应生成4后,出现了CH2质子峰(δ 5.19),说明发生了反应。在4的1H NMR谱中,由于受三唑环的去屏蔽作用影响,N=CH质子吸收峰向低场移动,其δ 9.97出现单峰,说明N=C双键只有一种几何构型,从化合物热力学稳定趋势推断N=C双键为反式(E);δ 3.59处的4个质子峰归属吗啉环上的b,e-H,由于受邻位亚甲基的耦合,裂分为三重峰;δ 2.77处的4个质子峰归属吗啉环上的c,d-H,由于受邻位亚甲基的耦合,裂分为三重峰。这两组质子相互偶合(J=4.6 Hz)。苯环上质子峰出现在 δ 7.53 ~7.81,其中 2,3,5,6-H 的质子峰出现在 δ 7.81和 δ 7.76,由于受相邻质子耦合裂分为二重峰(J=8.4 Hz);吡唑环上CH3质子峰出现在 δ 2.31。
IR 分析表明,2 中3 436 cm-1,3 253 cm-1和1 363 cm-1的吸收峰为NH2,NH和C=S伸缩振动谱带;生成3后,3 436 cm-1处的 NH2谱带消失,在1 674 cm-1处新出现C=N吸收峰,NH和C=S吸收峰仍然存在。经Mannich反应生成4后,NH 吸收峰消失,3 056 cm-1和 2 959 cm-1吸收峰为苯环上C=C-H伸缩振动峰,1 620 cm-1处吸收峰为C=N伸缩振动,由于三唑环的供电子的共轭效应,比一般C=N的红外吸收偏低;苯环C=C骨架伸缩振动吸收在1 558 cm-1~1 442 cm-1,1 296 cm-1附近有N-N=C伸缩振动吸收峰,1 381 cm-1中强吸收峰为C=S伸缩振动吸收峰,2 600 cm-1~2 500 cm-1内无尖锐吸收峰,说明无S-H峰,说明目标化合物的硫以C=S的形式存在;在823 cm-1有苯环上C-H的面外变形振动吸收峰,表明其中一个苯环为对位二取代,767 cm-1和693 cm-1为苯环的C-H的面外变形振动吸收峰,表明其中一个苯环为单取代。
[1]魏学,郑玉国,薛伟,等.新型 1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及抗病毒活性[J].合成化学,2010,18(5):595 -598.
[2]Li F L,Dai B,Song H B,et al.Synthesis,structure,and fungicidal activity of triorganotin(4H-1,2,4-triazol-4-yl)benzoates[J].Heteroat Chem,2009,20(7):411-417.
[3] 李黔柱,宋宝安,蔡学健,等.N-(1,2,4-三唑)含氟肉桂醛亚胺的合成及生物活性[J].有机化学,2010,30(4):569 -575.
[4]Wang B L,Shi Y X,Ma Y,et al.Synthesis and biological activity of some novel trifluoromethyl-substituted 1,2,4-triazole and bis(1,2,4-triazole)Mannich bases containing piperazine rings[J].J Agric Food Chem,2010,58(23):5515 -5522.
[5]Wang M H,Zhu R Z,Fan Z J,et al.Bitriazolyl acyclonucleosides synthesized via Huisgen reaction using internal alkynes show antiviral activity against tobacco mosaic virus[J].Bioorg Med Chem Lett,2011,21(1):354-357.
[6]杨金凤,陶晶,李炳奇,等.芳基吡唑腙及其双杂环化合物的合成与抗菌活性[J].合成化学,2009,17(2):151-154.
[7]闫启东,徐俊,徐峰,等.1-[6-(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪-3-基]酰肼及其衍生物的合成与表征[J].合成化学,2011,19(6):709 -713.
[8]廖国辉,张阳,魏宁宁,等.1-甲基-3-二氟甲基-4-吡唑酰胺类衍生物的合成及其抑菌活性[J].合成化学,2011,19(1):19 -23.
[9]郑玉国,薛伟,郭晴晴,等.三唑席夫碱苯并吡喃酮衍生物合成及其抗病毒活性[J].合成化学,2012,20(3):316-319.
[10]于赛男,李智超,胡英芝,等.含三氟甲基和双希夫碱化合物的合成与表征[J].合成化学,2010,18(2):226-228.
[11]Almajan G L,Barbuceanu S F,Almajan E R,et al.Synthesis,characterization and antibacterial activity of some triazole Mannich bases carrying diphenylsulfone moieties[J].Eur J Med Chem,2009,44(7):3083 -3089.
[12] 唐雪梅,晏菊芳,张映霞,等.4-[3-(4-溴苯基)-3-氧代-1-芳基丙氨基]-N-(嘧啶-2-基)苯磺酰胺的合成及其葡萄糖苷酶抑制活性初步研究[J].有机化学,2009,29(11):1790-1798.

