新型多氟芳烃-并H-吡唑并[5,1-a]异喹啉衍生物的合成*
肖 潜
(韩山师范学院化学系,广东 潮州 521041)
吡咯并异喹啉化合物以及吡唑并吡咯化合物是杂环化合物中重要的一类衍生物,具有广泛的生物活性,如抗病毒[1]、抗肿瘤[2]和抗菌[3]等。近期,有研究表明,吡唑并异喹啉衍生物对CDC25B,TC-PTP和PTP-1B有良好的活性抑制作用[4]。多氟芳烃因其独特的化学性质[5]也深受药物化学工作者的高度重视。在此基础上,我们[6]曾以2-取代乙炔基取代苯甲醛腙和多氟芳烃为原料高效便捷地构建了含多氟芳烃-并H-吡唑并[5,1-a]异喹啉骨架化合物。
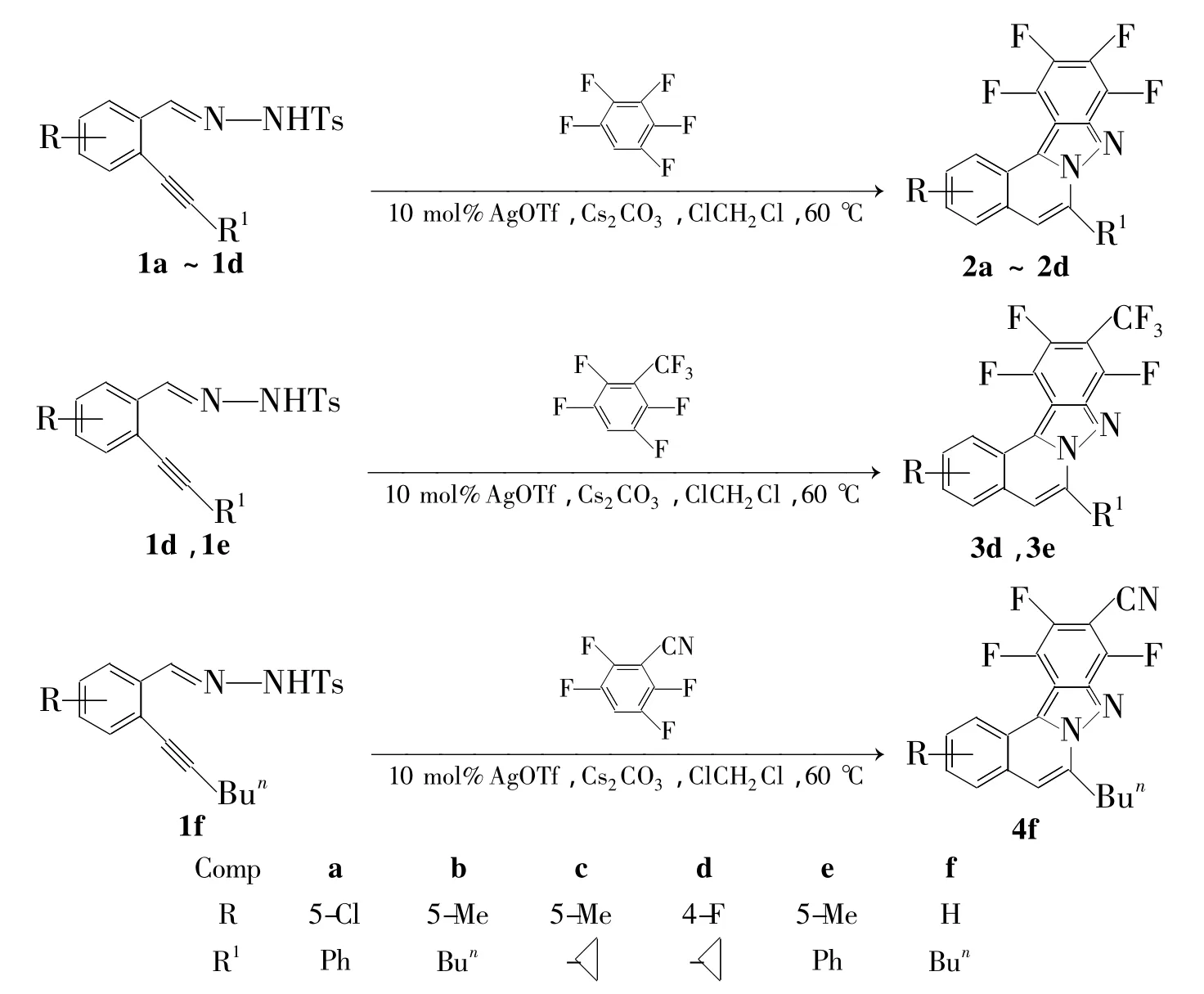
基于多样性导向合成的理念,为了寻找先导化合物及新的活性物质,本文以2-取代乙炔基取代苯甲醛腙(1a~1f)和多氟芳烃为原料,采用一锅法串联反应合成7种新型的含多氟芳烃的异喹啉骨架化合物(2a~2e,3d,3e和4f,Scheme 1),其结构经1H NMR,19F NMR和HR-ESI-MS表征。
2~4的合成,为新药的开发研究提供实验数据和理论依据。
1 实验部分
1.1 仪器与试剂
WRS-2型熔点仪(温度未校正);JEOL JNMECA-400(400M Hz)型核磁共振仪(CDCl3为溶剂,TMS为内标);Finnigan MAT 8430型高分辨质谱仪。所用试剂均为分析纯。
1.2 合成
(1)1a~1f的合成通法
在反应瓶中依次加入取代2-取代乙炔基取代苯甲醛5 mmol,对甲苯磺酰肼(H2NHNTs)5 mmol,乙醇50 mL及几滴浓盐酸,搅拌下于室温反应至终点。过滤,滤饼用乙醇重结晶得无色透明晶体1a ~1f。
(2)2~4的合成(以2a为例)
在反应瓶中加入2-苯基乙炔基-5-氯苯甲醛腙(1a)122.4 mg(0.3 mmol),三氟甲磺酸银7.7 mg 及二氯乙烷 0.6 mL,搅拌下于60℃反应1 h。加入碳酸铯173.6 mg(0.9 mmol),五氟苯(2)126.0 mg(0.75 mmol)及 DMF 1.0 mL,于60℃反应至终点(TLC跟踪)。过滤,旋干滤液后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=100∶1]纯化得白色固体2a。
用类似的方法合成白色固体2b~2d;用2-三氟甲基-1,3,5,6-四氟苯替代五氟苯,用类似的方法合成白色固体3d 和3e;用 2-氰基-1,3,5,6-四氟苯替代五氟苯,用类似的方法合成白色固体4f。
2a:收率 58%,m.p.255.4 ℃ ~256.1 ℃;1H NMR δ:8.94 ~8.92(m,1H),7.93(s,1H),7.86(d,J=8.2 Hz,1H),7.57 ~7.53(m,6H);19F NMR δ:-135.77(s,1F),-155.35(d,J=23.2 Hz,1F),-156.21(d,J=23.2 Hz,1F),-163.89(d,J=23.2 Hz,1F);HR-ESI-MS m/z:Calcd for C21H9N2F4Cl{[M+H]+}401.046 3,found 401.044 4。
2b:收率 47%,m.p.174.5 ℃ ~175.1 ℃;1H NMR δ:8.55(s,1H),7.71(d,J=8.2 Hz,1H),7.48(d,J=7.7 Hz,1H),7.31 ~7.26(m,1H),3.30(t,J=7.5 Hz,2H),2.62(s,3H),1.94 ~ 1.91(m,2H),1.59 ~ 1.53(m,2H),1.04(t,J=7.3 Hz,3H);19F NMR δ:- 136.53(d,J=36.1 Hz),-156.30(d,J=35.1 Hz),-156.73(d,J=35.0 Hz),-166.69(t,J=18.1 Hz);HR-ESI-MS m/z:Calcd for C20H16N2F4{[M+H]+}361.132 2,found 361.132 0。
Scheme 1
2c:收率 41%,m.p.246.4 ~246.9 ℃;1H NMR δ:8.64(s,1H),7.69(d,J=7.7 Hz,1H),7.47(d,J=8.0 Hz,1H),7.10(s,1H),2.94 ~2.88(m,1H),2.61(s,3H),1.31 ~1.29(m,2H),0.98 ~ 0.96(m,2H);19F NMR δ:-135.65(s,1F),-156.73(d,J=23.2 Hz,1F),-157.53(d,J=23.2 Hz,1F),-166.01(d,J=23.2 Hz,1F);HR-ESI-MS m/z:Calcd for C19H12N2F4{[M+H]+}345.100 9,found 345.101 0。
2d:收率 52%,m.p.233.7 ℃ ~234.3 ℃;1H NMR δ:8.88 ~ 8.87(m,1H),7.47 ~ 7.45(m,2H),7.08(s,1H),2.98 ~2.95(m,1H),1.35 ~ 1.32(m,2H),1.01 ~ 0.99(m,2H);19F NMR δ:-110.67(s,1F),-136.42(d,J=23.2 Hz,1F),-156.35(d,J=34.8 Hz,1F),-156.70(d,J=23.2 Hz,1F),-165.21(d,J=23.2 Hz,1F);HR-ESI-MS m/z:Calcd for C18H9N2F5{[M+H]+}349.075 9,found 349.074 4。
3d:收率 58%,m.p.213.1 ℃ ~213.5 ℃;1H NMR δ:8.90 ~ 8.87(m,1H),7.48 ~ 7.46(m,2H),7.14(s,1H),2.99 ~2.92(m,1H),1.37 ~ 1.35(m,2H),1.02 ~ 1.00(m,2H);19F NMR δ:-55.69(s,3F),-110.14(s,1F),-127.44(t,J=23.2 Hz,1F),-137.12(d,J=23.2 Hz,1F),-151.04(d,J=23.2 Hz,1F);HR-ESI-MS m/z:Calcd for C19H9N2F7{[M+H]+}399.072 7,found 399.072 4。
3e:收率 40%,m.p.248.4 ℃ ~248.7 ℃;1H NMR δ:8.73(s,1H),7.94 ~7.92(m,2H),7.82(d,J=7.9 Hz,1H),7.58 ~7.57(m,5H),2.66(s,3H);19F NMR δ:-55.63(d,J=23.2 Hz,3F),-127.20(t,J=23.2 Hz,1F),-136.36(s,1F),- 151.32(d,J=23.2 Hz,1F);HR-ESI-MS m/z:Calcd for C23H12N2F6{[M+H]+}431.097 7,found 431.097 7。
4f:收率 45%,m.p.172.4 ℃ ~172.8 ℃;1H NMR δ:8.72(s,1H),7.88 ~ 7.87(m,1H),7.73 ~7.70(m,2H),7.42(s,1H),3.31(t,J=7.4 Hz,2H),1.97 ~1.90(m,2H),1.60 ~1.57(m,2H),1.05(t,J=7.3 Hz,3H);19F NMR δ:-119.08(d,J=20.5 Hz,1F),-135.59(t,J=18.7 Hz,1F),- 145.15(d,J=17.4 Hz,1F);HR-ESI-MS m/z:Calcd for C20H14N3F3{[M+H]+}354.121 3,found 354.121 7。
2 结果与讨论
2.1 反应机理
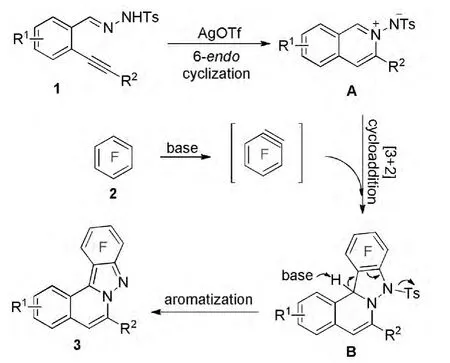
首先,在三氟甲磺酸银的作用下,1发生分子内的环化得到异喹啉氮氮叶立德A;之后,多氟芳烃在强碱的作用下生成多氟苯炔中间体;两者发生[3+2]环化后得到中间体B;最后,在强碱的作用下B芳构化,得到目标产物3(Scheme 2)。
Scheme 2
多氟芳烃2,3,5,6-四氟吡啶和2,4,5-三氟硝基苯与1f不能适用于该反应,未能获得目标化合物,可能是由于在该条件下无法生成苯炔中间体所致。
2.2 结构表征
以4f为例。在1H NMR谱图中,苯环上的氢出现在 δ 8.72~7.42,与苯环相连的亚甲基上的两个氢以三重峰出现在δ 3.31,其余两个亚甲基以多重峰出现在 δ 1.97~1.57,而甲基则以三重峰出现在δ 1.05。在19F NMR谱图中出现三个峰积分均为1∶1∶1,与化合物结构相符。ESI-HRMS谱图出现分子离子峰,与数据吻合。
[1]Marco E,Laine W,Tardy C,et al.Molecular determinants of topoisomerase I poisoning by lamellarins:Comparison with camptothecin and structure activity relationships[J].J Med Chem,2005,48(11):3796 -3807.
[2]Kluza J,Gallego M,Loyens A,et al.Cancer cell mitochondria are direct proapoptotic targets for the marine antitumor drug lamellarin D[J].Cancer Res,2006,66(6):3177-3187.
[3]Johns B A,Gudmundsson,K S,Turner E M,et al.Pyrazolopyridine antiherpetics:SAR of C2'and C7 amine substituents[J].Bioorg Med Chem,2005,13(7):2397-2411.
[4]Chen Z Y,Wu J.Efficient generation of biologically active H-pyrazolo[5,1-a]isoquinolines via multicomponent reaction[J].Org Lett,2010,12(21):4856 -4859.
[5]Zahn A,Brotschi C,Leumann C J.Pentafluorophenyl-phenyl interactions in biphenyl-DNA[J].Chem Eur J,2005,11(7):2125 -2129.
[6]Zhang L,Xiao Q,Ye S Q,et al.Generation of polyfluoroaryl-fused H-pyrazolo[5,1-a]isoquinolines through a reaction of N'-(2-alkynylbenzylidene)hydrazide with polyfluoroarene[J].Chemistry An Asian Journal,2012,7(8):1909-1914.

